- Растворы. Способы выражения концентрации растворов
- Растворы. Способы выражения концентрации растворов
- Способы выражения концентрации растворов
- Примеры решения задач
- Задачи для самостоятельного решения
- 4.3.2 Титр раствора и титр по определяемому веществу.
- 4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
Растворы. Способы выражения концентрации растворов
Материалы портала onx.distant.ru
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0%
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
Мольный процент представляет мольную долю, умноженную на 100:
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0
Объёмный процент представляет собой объёмную долю, умноженную на 100.
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см 3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4 в кислой среде | ? | 0,03 М KMnO4 в нейтральной среде | ? |
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4 в нейтральной среде | 0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см 3 .
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см 3 .
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см 3 ), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см 3 .
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см 3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
Источник
4.3.2 Титр раствора и титр по определяемому веществу.
Концентрацию растворов, применяемых в титриметрии, выражают не только через моль-экв/л (нормальность), но и через титр раствора ( 

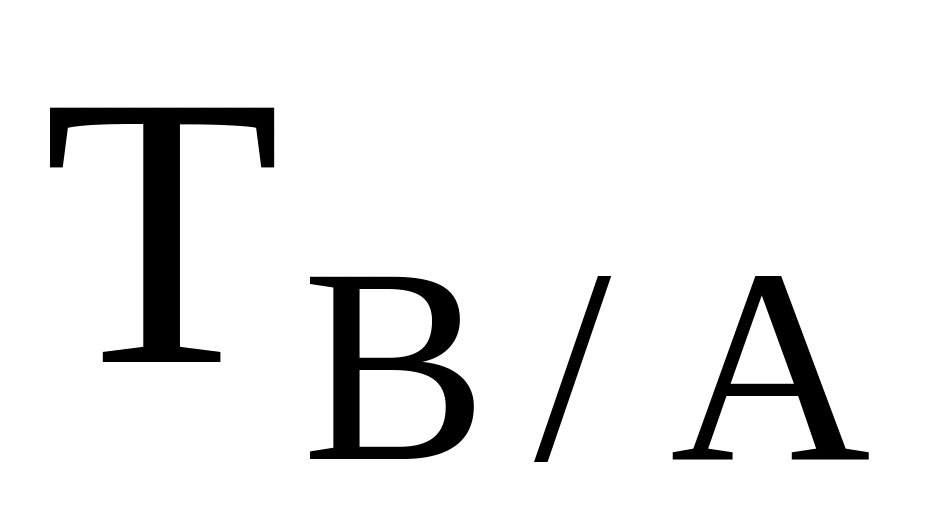
Титр вещества 
Титр вещества показывает содержание компонента А, выраженное в граммах, в 1 мл его раствора и вычисляется по формуле:


где 

Иногда титр для удобства в расчетах выражают в мг/мл. Через простой титр легко рассчитать молярную концентрацию (молярность) или молярную концентрацию эквивалента (нормальность) раствора, подставив туда выражение массы вещества через титр.


Пример. Пусть в растворе соли, объемом 250 см 3 содержится 0,5 г 
Исходя из формул (4.8) и (4.9), Т(Na2CO3) = 0,005/250 = 



Титр по определяемому веществу 
Титр по определяемому веществу или условный показывает какое количество вещества А (г) эквивалентно массе титранта В, которая содержится в 1 мл раствора титранта В. Так как масса титруемого вещества А и объем раствора В относятся к разным веществам, то размерность такого титра не указывается. Титр по определяемому веществу (условный) позволяет вычислить какое количество вещества А в граммах титруется 1-м миллилитром титранта В.
= 
Между титрами Т(В) и существует простая связь, вытекающая из закона эквивалентов. Ее легко получить, учитывая, что
m(В) = 

где V(B) в мл – объем раствора В, пошедший на реакцию (титрование) с веществом А; m(В) – масса вещества реагента В (титранта), m(А) – масса вещества А, эквивалентная массе реагента В в его растворе объемом V(B).


Тогда молярная концентрация эквивалента (нормальность) раствора В через значение может быть определена как:

Если для рабочего раствора В известно значение , то масса определяемого компонента А (г) в пробе объемом 


4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
В титриметрии используют растворы, концентрация которых установлена каким-либо способом с высокой степенью точности. Такие растворы называют стандартными титрованными или просто титрованными. Растворы классифицируют по назначению и по способу установления их концентрации.
По назначению их условно делят на рабочие растворы и растворы стандартов (первичные и вторичные).
Рабочими называют растворы, которые используются непосредственно в анализе при определении содержания вещества. Если рабочий раствор не относится к стандартным, то его необходимо отстандартизировать непосредственно перед выполнением анализа, так как концентрация в процессе хранения могла существенно измениться. Точную концентрацию рабочего раствора находят путем титрования стандартного раствора или установочных веществ (метод точных навесок). Это касается, например, таких рабочих растворов, как: NaOH, Na2S2O35H2O.
Под стандартным раствором понимают такой титрованный раствор, который устойчиво сохраняет свою концентрацию при длительном хранении. Основное назначение стандартных растворов определение точной концентрации рабочих и иных растворов, применяемых в титровании.
Процесс установления точной концентрации раствора путем его титрования по стандарту называется стандартизацией.
По способу определения концентрации различают первичные стандарты или растворы с приготовленным титром и стандартизированные растворы.
Стандартизированные растворы это такие растворы, концентрация которых устанавливается по стандарту и заранее не может быть точно определена. К ним относятся растворы кислот, щелочей, гидролизующихся и гигроскопичных солей, а также веществ, которые могут реагировать с атмосферным кислородом и углекислотой. Известно множество способов приготовления стандартизированных растворов. Наиболее часто для этой цели применяют: приготовление по приближенной навеске (щелочи, соли), методы разбавления или смешения растворов (кислоты, соли), методы ионного обмена (растворы солей).
Стандартные растворы классифицируют по способу определения их концентрации. Различают: первичные стандарты или растворы с приготовленным титром и вторичные стандарты растворы с установленным титром.
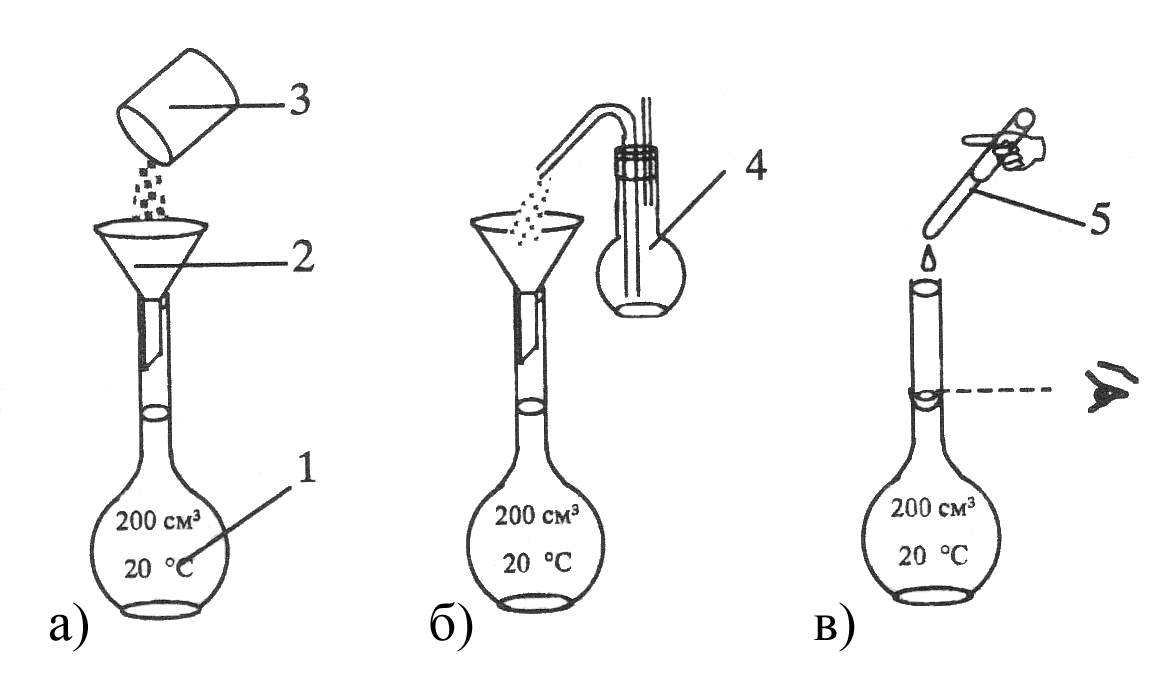
Первичные стандарты это растворы, которые готовят либо по точной навеске вещества (рис. 4.10), либо путем разведения специально приготовленных стандартизированных реагентов – фиксаналов (рис. 4.11). Фиксанал представляет собой стеклянную запаянную ампулу, выпускаемую промышленностью и содержащую строго нормированное количество реагента, обычно рассчитанного на 1 л 0,1 н. раствора.
Приготовление раствора по точной навеске начинают с расчета ее массы по заданной концентрации (титру или нормальности) и объему колбы. Навеску стандартного вещества взвешивают на аналитических весах с точностью до 110 4 г и количественно переносят в мерную колбу, где ее растворяют при перемешивании (рис. 4.10).
Рисунок 4.10 – Порядок операций при приготовлении раствора первичного
стандарта по точной навеске: 1 – мерная колба Мора; 2 – воронка;
3 – бюкс с навеской вещества; 4 – промывалка с дистиллированной водой;
5 – пипетка или капельница.
а – перенос навески вещества в мерную колбу; б – ополаскивание воронки;
в – доведение объема раствора стандарта до метки.
Этим методом обычно готовят растворы солей, таких как бура (Na2B4O710H2O), K2Cr2O7. Количество вещества в растворе находят или по значению точно взятой массы навески (при ее переносе необходимо тщательно промыть бюкс), или рассчитывают методом разности, определяя точную массу бюкса сначала с навеской, а затем – пустого, уже после переноса вещества в колбу. В случае необходимости концентрацию раствора заново пересчитывают с учетом фактически взятой массы навески.
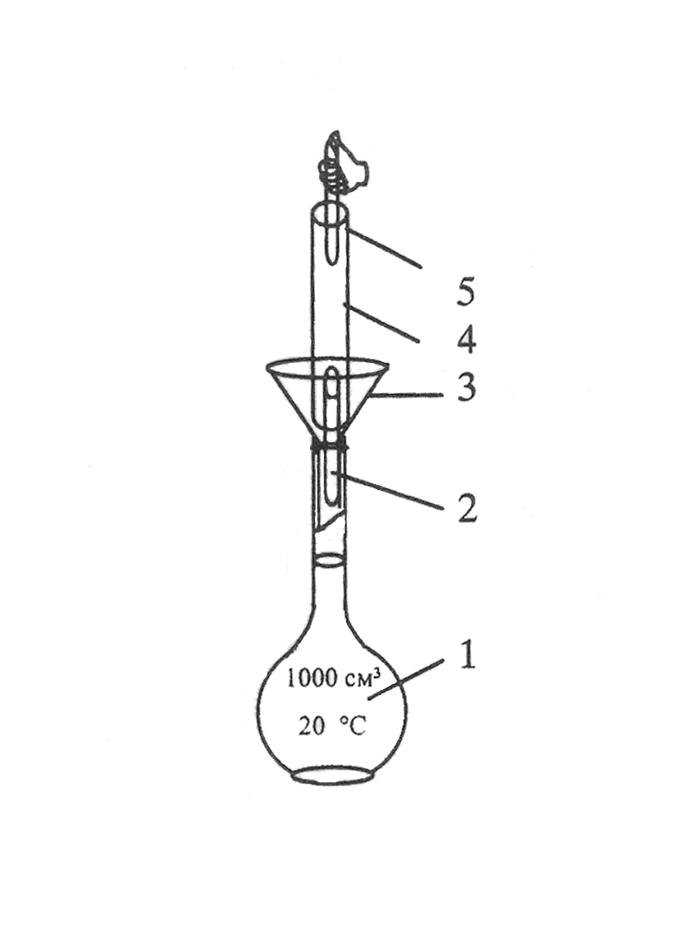
Порядок приготовления раствора методом разведения из фиксанала показан на рисунке 4.11. Чтобы стандарт, полученный этим методом, был качественным и отвечал всем требованиям, необходимо исключить потери вещества при вскрытии ампулы и переносе его в колбу, а также следить, чтобы осколки ампулы не попали в раствор. Это во многом зависит от правильности обращения с ампулой.
Рисунок 4.11 – Способ приготовления растворов первичного стандарта
методом разведения из фиксанала: 1 – мерная колба Мора на 1л;
2 – нижний боек; 3 – воронка; 4 – ампула фиксанала; 5 – верхний боек.
Перед использованием, ампулу следует ополоснуть дистиллированной водой и только затем ее вскрывать специальным бойком. Сразу же после переноса вещества в колбу, нужно тщательно промыть ампулу дистиллированной водой, не менее, чем 6-ти кратным ее объемом. Этот метод приготовления первичного стандарта проще, чем по точным навескам, но уступает ему в точности. Его используют не только для получения растворов солей, но и различных кислот.
Так как для приготовления раствора первичного стандарта пригодны только точная мерная посуда и аналитические весы, то и к веществам, применяемым для этой цели, предъявляют ряд обязательных требований. В качестве первичного стандарта можно использовать только такие реактивы, которые характеризуются:
высокой чистотой (обычно не хуже, чем 99,99 – 99,999% квалификации ч.д.а. и о.с.ч.);
точным соответствием формульному составу и относительно высокой молекулярной массой;
устойчивостью при хранении как в твердом виде, так и в растворе (отсутствие процессов гидратации, гидролиза, окисления и карбонизации);
простотой в приготовлении и хорошей растворимостью;
необратимостью реакции при стандартизации, селективностью;
возможностью точной фиксации Т. Э. каким-либо методом.
Вторичным стандартом называют такие стандартизированные растворы, которые устойчивы при хранении и могут быть использованы для стандартизации других растворов.
Вторичные стандарты готовят как растворы приблизительной концентрации любым известным методом, а перед употреблением определяют их точную концентрацию путем стандартизации по первичному стандарту. Поэтому при приготовлении вторичных стандартов не требуется высокая точность измерения массы вещества или объема раствора, как в случае первичных стандартов. Для этой цели вполне пригодны технохимические весы и неточная мерная посуда (цилиндры, мензурки, градуированные пробирки).
Примером раствора, обладающего свойствами вторичного стандарта, является соляная кислота. Ее разбавленные растворы могут храниться длительное время, до 1-го месяца и более, без заметного изменения концентрации. Бура, используемая в протолитометрии для стандартизации HCl, относится к первичным стандартам и готовится по точной навеске. Тогда, как рабочий раствор NaOH – свойствами стандарта не обладает вообще и его концентрацию приходится устанавливать заново при каждом использовании.
Источник