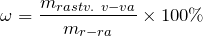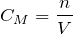Дисперсные системы и растворы
Дисперсные системы и их виды
Существует классификация дисперсных систем по размеру частиц дисперсной фазы. Выделяют, молекулярно-ионные ( 100 нм) системы.
Различают гомогенные и гетерогенные дисперсные системы. Гомогенные системы по-другому называют истинными растворами.
Растворы
По агрегатному состоянию растворы делят на газообразные (воздух), жидкие, твердые (сплавы). В жидких растворах существует понятие растворителя и растворенного вещества. В большинстве случаев растворителем служит вода, однако это могут быть и неводные растворители (этанол, гексан, хлороформ).
Способы выражения концентрации растворов
Для выражения концентрации растворов используют: массовую долю растворенного вещества (
Молярная концентрация (СМ, моль/л) показывает, сколько моль растворенного вещества содержится в одном литре раствора. Растворыс концентрацией 0,1 моль/л называют децимолярными, 0,01 моль/л – сантимолярными, а с концентрацией 0,001 моль/л – миллимолярными.
Нормальная концентрация (СН, моль-экв/л) показывает число эквивалентов растворенного вещества в одном литре раствора.
Моляльная концентрация (Сm, моль/1кг H2O) – число моль растворенного вещества, приходящееся на 1 кг растворителя, т.е. на 1000 г воды.
Мольная доля растворенного вещества (N) – это отношение числа моль растворенного вещества к числу моль раствора. Для газовых растворов мольная доля вещества совпадает с объемной долей ( φ).
Растворимость
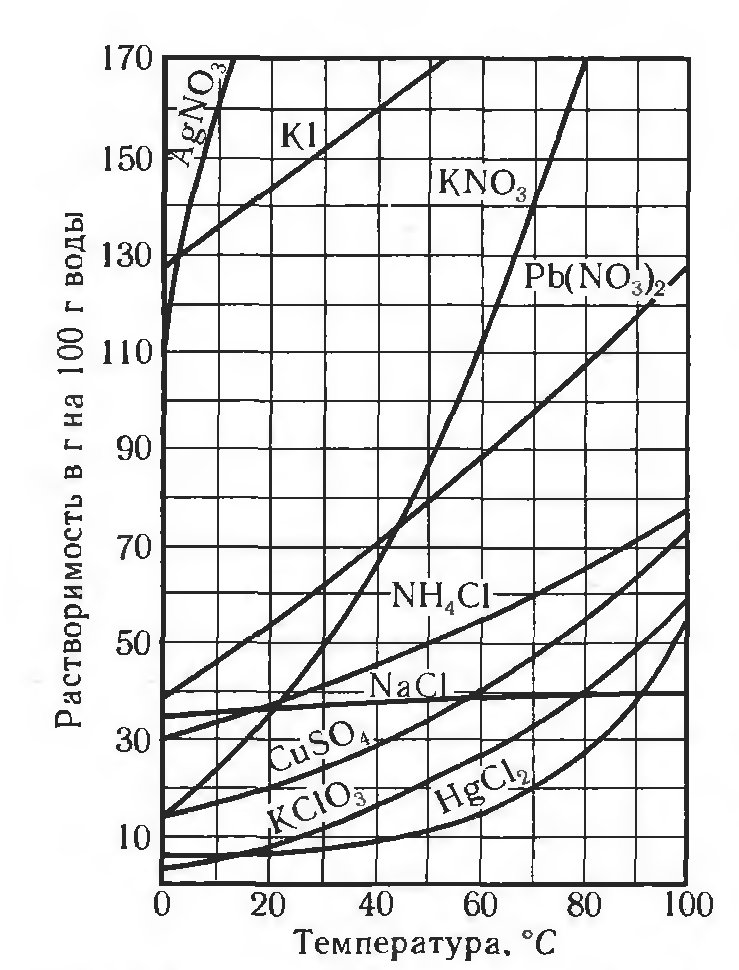
По растворимости растворы и вещества делят на 3 группы: хорошо растворимые (сахар), малорастворимые (бензол, гипс) и практически нерастворимые (стекло, золото, серебро). Абсолютно нерастворимых веществ в воде нет, нет приборов, с помощью которых возможно вычислить количества вещества, которое растворилось. Растворимость зависит от температуры (рис. 1), природы вещества и давления (для газов). При повышении температуры, растворимость вещества увеличивается.
Рис. 1. Пример зависимости некоторых солей в воде от температуры
С понятием растворимости тесно связано понятие насыщенного раствора, поскольку растворимость характеризует массу растворенного вещества в насыщенном растворе. Пока вещество способно растворяться раствор называют ненасыщенным, если вещество перестает растворяться – насыщенным; на некоторое время можно создать пересыщенный раствор.
Давление пара растворов
Пар, находящийся в равновесии с жидкостью называется насыщенным. При заданной температуре давление насыщенного пара над каждой жидкостью – величина постоянная. Поэтому каждой жидкости присуще давление насыщенного пара. Рассмотрим это явление на следующем примере: раствор неэлектролита (сахарозы) в воде – молекулы сахарозы значительно больше молекул воды. Давление насыщенного пара в растворе создает растворитель. Если сравнить между собой давление растворителя и давление растворителя над раствором при одинаковой температуре, то в растворе число молекул, перешедших в пар над раствором меньше, чем в самом растворе. Отсюда следует, что давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре.
Если обозначить давление насыщенного пара растворителя над чистым растворителем p0, а над раствором – p, то относительное понижение давления пара над раствором будет представлять собой (p0-p)/p0.
На основании этого Ф.М. Рауль вывел закон: относительное понижение насыщенного пара растворителя над раствором равно молярной доле растворенного вещества : (p0-p)/p0 = N (молярная доля растворенного вещества).
Криоскопия. Эбулиоскопия. Второй закон Рауля
Понятия криоскопии и эбулиоскопии тесно связаны с температурами замерзания и кипения растворов, соответственно. Так, температура кипения и кристаллизация растворов зависят от давления пара над раствором. Любая жидкость кипит при той температуре, при которой давление ее насыщенного пара достигает внешнего (атмосферного давления).
При замерзании кристаллизация начинается при той температуре, при которой давление насыщенного пара над жидкой фазой равно давлению насыщенного пара над твердой фазой. Отсюда – второй закон Рауля: понижение температуры кристаллизации и повышение температуры кипения раствора пропорционально концентрациям растворенного вещества. Математическое выражение этого закона:
где К и Е криоскопическая и эбулиоскопическая константы, зависящие от природы растворителя.
Примеры решения задач
| Задание | Какое количество воды и 80%-го раствора уксусной кислоты следует взять для получения 200 г 8%-го раствора? |
| Решение | Записываем формулу для нахождения массовой доли: |
Пусть масса 80% раствора уксусной кислоты равна х г. Найдем массу растворенного в нем вещества:
mр.в-ва(CH3COOH) =mр-ра × 
Найдем массу растворенного вещества в растворе 8%-й уксусной кислоты:
Масса 80% раствора уксусной кислоты равна 20 (г).
Найдем необходимое количество воды:
m(H2O) = 200 (г) – 20 (г) = 180 (г)
| Задание | Смешали 200 г воды и 50 г гидроксида натрия. Определите массовую долю гидроксида натрия в растворе. |
| Решение | Записываем формулу для нахождения массовой доли: |
Найдем массу раствора гидроксида натрия:
mр-ра (NaOH) = 200 +50 = 250 (г)
Найдем массовую долю гидроксида натрия:

 (NaOH)=20%
(NaOH)=20%| Задание | Определите массу 10%-го раствора карбоната натрия, которую нужно добавить к 1020 г 2%-го раствора, чтобы получить 3%-й раствор. |
| Решение | Записываем формулу для нахождения массовой доли: |
Найдем массу растворенного карбоната натрия в его 2%-м р-ре:
m(Na2CO3) в 2%-м р-ре = mр-ра(Na2СO3)2% × 
m(Na2CO3) в 2%-м р-ре = 1020 × 0,02 = 20,4г
Найдем массу растворенного карбоната натрия в его 10%-м р-ре:
Тогда масса 3%-го раствора карбоната натрия:
А масса растворенного карбоната натрия в нем:
m(Na2CO3) в 3%-м р-ре = (х + 1020) × 0,03 (г)
Найдем массу растворенного карбоната натрия в конечном растворе:
Источник
Химия. 11 класс
Конспект урока
Урок № 6. Дисперсные системы
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению истинных растворов и дисперсных систем: способам выражения концентрации растворов, видам дисперсных систем, их свойствам, способам коагуляции золей, строению гелей.
Аэрозоль – грубодисперсная система, в которой твёрдые или жидкие частицы размером более 10 -3 см равномерно распределены в газообразной среде.
Гель – полутвёрдая трёхмерная ячеистая структура, каркас которой образован коллоидными частицами, а в прослойках между частицами удерживается дисперсионная среда.
Грубодисперсная система – дисперсная система, в которой размер частиц дисперсной фазы более 10 -3 см.
Дисперсионная среда – сплошная фаза, составная часть дисперсной системы, в которой равномерно распределены частицы дисперсной фазы.
Дисперсная система – гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена в другой, сплошной фазе.
Дисперсная фаза – мелко раздробленные частицы, равномерно распределённые в дисперсионной среде.
Гетерогенная система – неоднородная система, в которой компоненты находятся в разных фазах и между ними существует видимая граница раздела фаз.
Гомогенная система – однородная система, все компоненты которой находятся в одной фазе, граница раздела фаз между компонентами отсутствует.
Золь (коллоидный раствор) – тонкодисперсная система, в которой твёрдые частицы дисперсной фазы размером 10 -7 – 10 -5 см равномерно распределены в жидкой среде.
Истинный раствор – гомогенная система, состоящая из двух или более компонентов, состав которой в определённых пределах можно изменять без нарушения однородности.
Коагуляция – процесс слипания коллоидных частиц в более крупные агрегаты.
Опалесценция – изменение окраски бесцветного коллоидного раствора с желтоватой в проходящем свете на голубую в отраженном свете.
Седиментация – процесс оседания крупных частиц дисперсной фазы.
Суспензия – грубодисперсная система, в которой твёрдые частицы размером более 10 -3 см равномерно распределены в жидкой дисперсионной среде.
Фаза – часть системы, однородная по составу и свойствам, отделённая от окружающей среды видимой границей раздела.
Электрофорез – движение коллоидных частиц золя в постоянном электрическом поле к одному из электродов.
Эмульсия – грубодисперсная система, в которой одна жидкая фаза в виде отдельных мелких капель равномерно распределена в другой жидкости, при этом жидкости взаимно нерастворимы.
Эффект Тиндаля – образование светлого конуса в отраженном свете при прохождении через дисперсную систему луча света.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Истинным раствором называется гомогенная система, состоящая из нескольких компонентов, состав которой в определённых пределах можно менять без нарушения однородности.
Растворимостью называется такое количество вещества, которое можно при данной температуре растворить в 100 г растворителя. Абсолютно нерастворимых веществ в природе не существует.
Молярная концентрация показывает количество растворённого вещества в 1 литре раствора. Сокращенно молярная концентрация, или молярность, обозначается буквой М, например, 1 М – один моль на литр. 
Для того, чтобы найти молярную концентрацию по величине известной массовой доли, необходимо знать плотность раствора. При этом массовая доля должна быть выражена не в процентах, а в долях, а плотность – в г/л.

С истинными растворами мы постоянно встречаемся в жизни. Пьём чай с сахаром, консервируем овощи. В сельском хозяйстве используют растворы минеральных удобрений и средств для борьбы с вредителями и болезнями растений. Растворы используют в промышленности, в медицине, в учебных и научно-исследовательских химических лабораториях.
Дисперсной называется гетерогенная система, состоящая, как минимум, из двух фаз, одна из которых мелко раздроблена и равномерно распределена во второй, сплошной фазе. В отличие от истинных растворов, дисперсная система неоднородна, а между составляющими её фазами всегда существует граница раздела. Мелкораздробленная фаза называется дисперсной фазой, а сплошная фаза – дисперсионной средой. В зависимости от размера частиц дисперсной фазы различают грубодисперсные (размер частиц больше 100 нм) и тонкодисперсные (от 1 до 100 нм), или коллоидные системы. Если размер частиц дисперсной фазы становится меньше 1 нм, система перестает быть гетерогенной, образуется истинный раствор. В истинном растворе вещество раздроблено до отдельных молекул или ионов. В зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды дисперсные системы разделяют на суспензии, эмульсии, пены и аэрозоли. В суспензии твёрдые частицы распределены в жидкости. Эмульсия состоит из мелких капель жидкости, равномерно распределённых в другой жидкости, причем эти жидкости взаимно нерастворимы. Пена – это мелкие пузырьки газа в жидкости. Аэрозоль представляет собой газообразную среду, в которой распылены мелкие твёрдые или жидкие частицы.
Получение и свойства коллоидных растворов
Тонкодисперсные коллоидные системы получили название «золь». Золи могут быть образованы как неорганическими веществами, так и органическими макромолекулами, размеры которых превышают 1 нм, например, белками. Приготовить золь можно смешиванием малорастворимого вещества с растворителем (раствор крахмала, яичного белка), так и с помощью химических реакций ионного обмена, гидролиза, окисления-восстановления, в которых один из продуктов реакции не растворяется в жидкости.
Золи прозрачны, как и истинные растворы. Чтобы отличить золь от истинного раствора, надо посмотреть на проходящий через раствор луч в отражённом свете. В коллоидном растворе свет рассеивается, образуя светлый конус. Это явление получило название «эффект Тиндаля» — по фамилии английского физика Джона Тиндаля, который впервые описал и объяснил это явление. С древних времён люди ценили драгоценный камень опал за игру света. Его окраска в зависимости от угла зрения изменяется с голубой на желтоватую. Опал – это затвердевший коллоидный раствор, а свойство золей изменять окраску в проходящем и отражённом свете получило название «опалесценция».
Если в U-образную стеклянную трубку налить золь гидроксида железа и погрузить в каждое колено трубки графитовые электроды, подсоединив их к источнику постоянного электрического тока, то жидкость в одном колене станет светлее, в другом интенсивность окраски увеличится. Происходит это, так как коллоидные частицы движутся в постоянном электрическом поле к одному из электродов. Это явление получило название «электрофорез».
Образование заряда на поверхности коллоидных частиц
Коллоидные частицы перемещаются в постоянном электрическом поле, так как они заряжены. Заряд на поверхности коллоидных частиц образуется по двум причинам. Одна из причин – адсорбция заряженных ионов на поверхности частиц дисперсной фазы. Огромное количество мелких частиц дисперсной фазы имеют большую суммарную поверхностную энергию. За счет этой энергии ионы из раствора, одноименные с частицами дисперсной фазы, притягиваются к поверхности, в результате коллоидные частица приобретают заряд. Например, коллоидная частица хлорида серебра, полученная в избытке ионов Cl — , имеет строение (mAgCl)·nCl — .
Другая причина образования заряда на поверхности коллоидных частиц – ионизация нерастворимых молекул. По такому механизму образуется заряд на поверхности коллоидных частиц золя кремниевой кислоты. Полярные молекулы воды отрывают от поверхностных молекул кремниевой кислоты ионы водорода, в результате на поверхности коллоидной частицы остаются заряженные гидросиликат ионы, которые придают заряд коллоидной частице. Коллоидные частицы золя кремниевой кислоты имеют строение (mH2SiO3)·nHSiO3 — .
Для золей, как и для истинных растворов, характерно броуновское движение, а тяжёлые и крупные частицы грубодисперсных систем в броуновском движении не участвуют. Одноимённые заряды коллоидных частиц препятствуют их слипанию, поэтому золи длительное время остаются устойчивыми. Размеры частиц дисперсной фазы в грубодисперсных системах слишком большие, со временем они оседают – происходит седиментация.
Коагуляция коллоидных растворов
Если к золю добавить раствор электролита, произойдет нейтрализация заряда коллоидных частиц. Золь потеряет устойчивость, частицы начнут слипаться. Слипание коллоидных частиц называется коагуляцией. Коагуляцию можно вызвать длительным нагреванием золя, а также сливанием золей с противоположно заряженными частицами. Если коллоидные частицы слабо взаимодействуют с дисперсионной средой, то в результате коагуляции образуется осадок. Если коллоидные частицы хорошо взаимодействуют с растворителем, то они захватывают часть жидкости, в результате образуется гель. Гель – трёхмерная ячеистая структура, каркас которой образован коллоидными частицами, а в ячейках удерживается жидкость.
Дисперсные системы в природе и на службе у человека
Коллоидные растворы широко распространены в природе. Плазма крови, яичный белок, сырая нефть, речная и озёрная вода, почвенный раствор являются золями. Дисперсными системами являются облака, туман, дым, морская пена, молоко, газированная вода. В промышленности и быту человек использует эмульсионные краски, клеи, лаки, косметические и лечебные гели и шампуни. В пищевой промышленности дисперсными системами являются тесто, желе, студни, соусы, бульоны, мармелад, суфле. Без преувеличения можно сказать, что коллоидная химия – это химия реальных систем.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Приготовление насыщенного раствора
Условие задачи: Для приготовления насыщенного раствора поваренной соли надо в 100 г воды растворить 36 г хлорида натрия. Какое количество (моль) поваренной соли будет растворено в 360 г насыщенного раствора? Ответ запишите с точностью до десятых долей.
Шаг первый: найдём массу насыщенного раствора соли, в котором растворено 36 г хлорида натрия. Для этого сложим массу растворителя и растворённого вещества:
Шаг второй: найдём массу хлорида натрия, которая содержится в 360 г насыщенного раствора. Для этого составим пропорцию:
В 136 г насыщенного раствора содержится 36 г хлорида натрия;
в 360 г такого же раствора содержится т г хлорида натрия.
т = (360·36) : 136 = 95,3 (г).
Шаг третий: вычислим молярную массу хлорида натрия:
М = 23 + 35 = 58 (г/моль).
Шаг четвертый: найдём, сколько моль хлорида натрия содержится в 95,3 г.
Для этого массу хлорида натрия разделим на его молярную массу:
95,3 : 58 = 1,6 (моль).
2. Расчёт объёма раствора, который можно приготовить из раствора известной концентрации
Условие задачи: Какой объём 0,25 М раствора NaOH можно приготовить из 200 мл раствора гидроксида натрия с массовой долей 12% и плотностью 1,13 г/см 3 ? Ответ запишите в мл в виде целого числа.
Шаг первый: найдём массу 200 мл 12%-ного раствора.
Для этого умножим объём раствора на его плотность:
Шаг второй: найдём массу гидроксида натрия, которая содержится в 226 г 12%-ного раствора.
Для этого составим пропорцию:
В 100 г раствора содержится 12 г гидроксида натрия;
в 226 г раствора содержится т г гидроксида натрия.
т = (226·12) : 100 = 27,12 (г)
Шаг третий: найдём количество моль гидроксида натрия, которое содержится в 27,12 г.
Для этого вычислим молярную массу гидроксида натрия:
М = 23 + 16 + 1 = 40 (г/моль).
Теперь разделим массу гидроксида натрия на его молярную массу:
27,12 : 40 = 0,68 (моль).
Шаг четвёртый: Найдём объём раствора, в котором это количество гидроксида натрия составит концентрацию 0,5 М.
Для этого составим пропорцию:
в 1000 мл раствора содержится 0,5 моль гидроксида натрия;
в V мл раствора содержится 0,68 моль гидроксида натрия.
Источник