Способы выражения состава
Нефтяной газ представлен в виде смеси углеводородов, поэтому для оценки его физико-химических свойств необходимо знать способы выражения состава смеси.
Массовая (весовая) доля (gi) – величина, нормированная на 1 (в долях) или на 100 % и характеризует, отношение массы i-го компонента (mi), содержащегося в системе к общей массе системы:
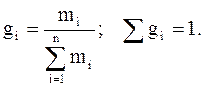
Молярная (мольная) доля (Ni) – величина, нормированная на 1 или на 100 % и характеризует, отношение числа молей i-го компонента (ni) к общему числу молей компонентов в системе:
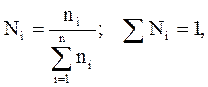
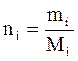
где mi – масса i-го компонента;
Мi – молекулярный вес i-го компонента.
Из соотношений 2.4–2.5 легко найти выражения для пересчетов массового и мольного составов:
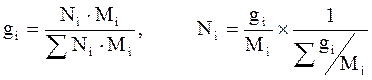
Объёмная доля – величина, нормированная на 1 или на 100 % и характеризует долю (Vi), которую занимает компонент в объёме системы. С учетом выражений 2.4–2.6 можно выразить взаимосвязь объёмной доли с массовыми и мольными долями:
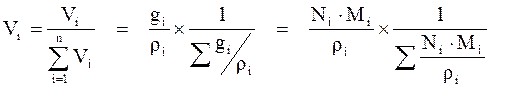
Для идеального газа соблюдается соотношение: объёмная доля компонента (Vi) равна мольной доли компонента (Ni), т. е. Vi = Ni, как следствие закона Авогадро. Для идеальной системы, как нефтяной газ, состав его можно рассчитать на основе любых данных: масс компонентов, объёмов, плотностей, парциальных давлений и др.
Рассмотрим пример. Дан объёмный состав нефтяного газа (Vi, %):
Найти: массовый состав (gi, в долях) газа?
Решение. Для идеального газа величины объёмных (Vi) и мольных (Ni) долей равны. Для расчета состава газа в массовых долях воспользуемся выражением (2.6). Учитывая молекулярные массы (кг/кмоль) компонентов нефтяного газа: CH4 – 16; C2H6 – 30; C3H8 – 44; C4H10 – 58; C5H12 – 72, найдем:
gCH4 = 61,3 •16 / (61,3•16 + 15,4•30 + 12,1• 44 + 6,8•58 + 4,4•72) =
980,8 / 2686,4 = 0,365,
Сумма всех долей массового состава равна 1.
Источник
Состав газа и конденсата, способы его выражения.
По фракционному составу природные газы разделяются на три группы: сухие газы, состоящие почти из одного метана. Они добываются из чисто газовых месторождений. В них отсутствуют тяжелые углеводороды, способные перейти в жидкое состояние при нормальных условиях; жирные, содержащие значительно меньше метана и большую долю пропан-бутановой фракции, которая при нормальной температуре и давлении выше 0,9 МПа находится в жидком состоянии. Они добываются из нефтяных месторождений; смесь сухого газа и конденсата. Онидобываются из газоконденсатных месторождений.
Конденсаты различных месторождений заметно отличаются по фракционному и химическому составам. Различают нестабильный и стабильный конденсаты.
Нестабильный конденсат C3 представляет собой жидкие углеводороды с растворенными в них газообразными компонентами, при определенных условиях, переходящие в жидкое состояние. Стабильный конденсат при нормальных условиях содержит только жидкие тяжелые углеводороды (С5Н12 + высшие).
Природные газы газовых и газоконденсатных месторождений по своему качественному составу близки между собой. Природные газы представляют собой смесь различных углеводородов:метана; этана; пропана; бутана; пентана; и высших.
Основная составляющая природных газов газовых и газоконденсатных месторождений – метан, содержание которого в газе колеблется от 70 до 99,5 % по объему.
Компонентный состав (ПГ).
природный газ это такая многокомпонентная смесь (в основном метан 80-99%) которая находится в газовой фазе, как при нормальных физических условиях, так и при пластовых давлениях и температурах на разрабатываемых в настоящее время месторождениях.
Основную часть природного газа составляет метан (CH4) — от 92 до 98 %. В состав природного газа могут также входить более тяжёлые углеводороды — гомологи метана: этан (C2H6), пропан (C3H8), бутан (C4H10).
а также другие неуглеводородные вещества: водород (H2), сероводород (H2S), диоксид углерода (СО2), азот (N2), гелий (Не).
Способы выражения состава (ПГ).

объемным способом – по отношению объемов отдельных компонент к объему всей смеси;
массовый — по отношению массы отдельных компонент к массе всей смеси;
мольный — по отношению количества молей отдельных компонент к количеству моллей всей смеси
Абсорбционная осушка газа.
Применяется для извлечения из газа водяных паров и тяжелых углеводородов. Для осушки газа в качестве абсорбента используются гликоли, а для извлечения тяжелых углеводородов — углеводородные жидкости. Абсорбенты, применяемые для осушки газа, должны обладать высокой взаиморастворимостью с водой, простотой и стабильностью при регенерации, низкой вязкостью при температуре контанта, низкой коррозионной способностью, не образовывать пен или эмульсий. На современных промыслах чаще применяют диэтиленгликоль (ДЭГ), триэтиленгликоль (ТЭГ).
Преимущество ДЭГа перед ТЭГом — меньшая склонность к ценообразованию при содержании в газе конденсата. Кроме того, ДЭГ обеспечивает лучшее разделение системы вода — углеводороды. Однако ТЭГ обеспечивает высокую степень осушки, что приводит к большому снижению «точки росы». ТЭГ имеет более высокую температуру разложения. Следовательно, ТЭГ можно нагревать до более высокой температуры и регенерацию (восстановление) его проводить без вакуума.
Чем выше концентрация подаваемого гликоля, тем глубже степень осушки. Концентрация гликоля зависит от эффективности его регенерации. При атмосферном давлении ДЭГ можно регенерировать до 96,7%, а ТЭГ-до 98,1%. Гликоли в чистом виде не вызывают коррозии углеродистых сталей.
Процесс абсорбции осуществляется в вертикальном цилиндрическом сосуде-абсорбере. Газ и абсорбент контактируют на тарелках, смонтированных внутри аппарата, перемещаясь противотоком: газ поднимается снизу вверх, а абсорбент стекает сверху вниз. Абсорбент по мере своего движения насыщается поглощаемыми им компонентами или влагой и через низ колонны подается на регенерацию. С верха колонны уходит осушенный газ. Эффективность абсорбции зависит от температуры и давления, числа тарелок в абсорбере, количества и качества абсорбента. Увеличение числа тарелок (а их устанавливают в абсорбере 14-18 шт.) оказывает такое же влияние, как и увеличение количества циркулирующего абсорбента. Верхний и нижний температурные пределы процесса определяются соответственно потерями гликоля от испарения и возрастанием его вязкости и равны 35-10рС.
Абсорбционный – основан на способности жидких абсорбентов поглощать из природного газа влагу. В качестве абсорбента (поглотителя) используют — этиленгликоль (ЭГ), диэтиленгликоль (ДЭГ), триэтиленгликоль (ТЭГ), а также масла, амины. Такие установки выгодны при осушке газа до точек росы, не превышающих –20 0 С.
Основным элементом установки есть абсорбер, в котором газ движется снизу вверх, а на встречу сверху — вниз стекает абсорбент. Газ, контактируя с абсорбентом осушается, абсорбент поглощая воду насыщается ей и направляется на регенерацию.
Газ от кустов скважин по газосборным коллекторам-шлейфам подается на пункт переключающей арматуры. В пункте переключающей арматуры сырой газ распределяется по шестнадцати входным ниткам в восемь блоков узла входа шлейфов (УВШ) объединенных попарно. Дальше газ поступает в сепаратор для отделения мех примесей от газа. Дальше идет в абсорбер где осушается газ. Осушенный газ, перед тем как попасть в МГ проходит сначала АВО с целью исключения растепления многолетнемерзлых присадочных грунтов и повышения надежности работы промыслового подземного газопровода. Потом поступает в узел замера газа.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Источник
Способы выражения состава
Нефтяной газ представлен в виде смеси углеводородов и неуглеводородных компонентов, поэтому для оценки его физико-химических свойств необходимо знать способы выражения состава смеси.
Массовая доля, весовой состав(gi) i-го компонента – величина, нормированная на 1 в долях или на 100 %. Она характеризует отношение массы i-го компонента (mi) в системе к общей массе системы:

Молярная доля, мольный состав (Ni) i-го компонента – величина, нормированная на 1 в долях или на 100 %, характеризует отношение числа молей i-го компонента (ni) к общему числу молей компонентов в системе:
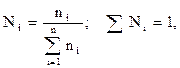

где mi – масса i-го компонента;
Мi – молекулярный вес i-го компонента.
Из соотношений (2.13–2.14) легко вывести выражения для пересчётов массового и мольного составов:

Объёмная доля i-го компонента – величина, нормированная на 1 или на 100 %, характеризует долю (Vi), которую занимает компонент в объёме системы. С учётом выражений (2.13–2.15) можно показать взаимосвязь объёмной доли с массовой и мольной долями:

Для идеального газа соблюдается соотношение – объёмная доля компонента (Vi) равна мольной доли компонента (Ni) → Vi = Ni. Этот постулат есть следствие закона Авогадро.
Нефтяной газ рассматривается как идеальная система и его состав можно рассчитать на основе любых данных: масс компонентов, объёмов, плотностей, парциальных давлений и других величин.
Рассмотрим пример.
Дан объёмный состав нефтяного газа (Vi, %): CH4 – 61,3 %;
Найти: какой будет массовый состав (gi, в долях) газа?
Решение. Для идеального газа величины объёмных (Vi) и мольных (Ni) долей равны. Для расчета состава газа в массовых долях воспользуемся выражением (2.6).
Учитывая молекулярные массы (г/моль) компонентов нефтяного газа: CH4 – 16; C2H6 – 30; C3H8 – 44; C4H10 – 58; C5H12 – 72, находим: gCH4 = 61,3·16/(61,3·16 + 15,4·30 + 12,1·44 + 6,8·58 + 4,4·72) =
Сумма всех долей массового состава равна 1.
Уравнение состояния
Для определения многих физических свойств природных газов используется уравнение состояния.
Уравнением состояния называется аналитическая зависимость между параметрами, описывающими изменение состояние вещества. В качестве таких параметров используются давление, температура, объём.Состояние газа при нормальных и стандартных условиях описывается уравнением Менделеева–Клапейрона:

где Р – абсолютное давление, Па;
Q – количество вещества, моль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная, Па×м 3 /(моль×град).
На основе уравнения состояния газа можно рассчитывать многие параметры нефтяного газа: плотность, мольный объём, количество молекул, число молекул, парциальные давления и другие, если рассматривать количество вещества в уравнении состояния газа (2.17), равное 1 молю (Q = 1 моль).
С учётом этого, уравнение состояния газа можно преобразовать следующим образом:
Если сумма молей равна единице (∑N = 1 моль), следует, что уравнение приобретает вид Þ Р·V = R·T.
Зная, что масса (m) одного моля идеального газа равна его молекулярной массе (М), умножив левую и правую части на молекулярную массу и массу газа, соответственно, получим:
Поделив обе части на V·R·T и преобразовав (2.19), получим выражение для расчёта плотности:
Р·M/R·T = m/V, m/V = M·Р/R·T, r = M·Р/R·T. (2.20)
Рассмотрим пример.
Дан один моль метана CH4.
Найти: какова будет плотность метана при н.у. и с.у.?
Решение. Зная, что молекулярная масса метана равна 16,04 г/моль и один моль метана занимает объём при н.у. 22,414 л, а при с.у. 24,055 л, находим:
Из выражения (2.20) и расчётов следует, что плотность газа с возрастанием давления будет расти, а с возрастанием температуры уменьшаться.
Плотность смеси газовых компонентов рассчитывают с учётом средней молекулярной массы смеси газа (Mсм) как отношение молекулярной массы смеси газа к его мольному объёму (Vм).
Например, для нормальных условий плотность газа будет рассчитываться по выражению:
Если плотность газа (ρо) задана при атмосферном давлении, равном 0,1013 МПа, то пересчёт её величины с учётом другого давления (Р) при той же температуре для идеального газа выполняется по формуле:
Рассмотрим другой пример.
Плотность метана при н.у. равна 0,716кг/м 3 . Определить плотность метана (СН4) при избыточном давлении, например при давлении 500 кПа и температуре 0 °С.
Решение. В этом случае общее давление (1 атм = 101,325 кПа) в системе будет равно Р = (500 + 101,325) = 601,325 кПа.
Зная, что молекулярная масса метана = 16,04 г/моль (кг/кмоль), универсальная газовая постоянная (R) = 8,314 Дж/(К·моль), температура (T) = 273,15 К, находим плотность метана по (2.20 и 2.22):
rCH4 = Р·М/R·T = 601,325·16,04/8,314·273,15 = 4,25 (кг/м 3 ),
Относительная плотность газов величина, рассчитанная по отношению к плотности воздуха, определенного при тех же условиях:
Плотность воздуха (ρвозд) при н.у. равна » 1,293 кг/м 3 , а при с.у. » 1,189 кг/м 3 .
Рассмотрим пример.
Для условий задачи, рассмотренной выше (пример раздела 2.2), рассчитать абсолютные (r) и относительные (ρ о см) плотности смеси газов, используя правое выражение (2.12) для расчета молекулярной массы (г/моль):
Мсм = 100/(36,5/16 +17,2/30 +19,8/44 +14,7/58 +11,8/72) = 26,874;
rсм = 26,874/22,414 = 1,119 (кг/м 3 );
ρ о см (н.у.) = 1,119/1,293 = 0,927.
Аналогично из (2.20) находится и выражение для мольного объёма:
Мольный объём при давлениях, равных или близких атмосферному и, для физических процессов, когда не происходит изменения числа молей в системе, оценивается соотношением:
где R – универсальна газовая постоянная;
Т – температура, К.
Рассмотрим пример.
Найти вид зависимости изменения мольного объёма газа от температуры → V = f(T).
Решение. Воспользуемся выражением (2.25) и получим объём, занимаемый одним молем идеального газа для условий задачи:
Vн.у. = 0,08206·273,15 = 22,414 (м 3 ,);
Vс.у. = 0,08206·293,15 = 24,055 (м 3 ).
Любой газ при н.у. (Т = 0 о С и Р = 100 кПа, 760 мм рт. ст.) занимает объём, равный 22,414 м 3 , а при с.у. (Т = 20 о С и Р = 100 кПа) занимает объём равен 24,055 м 3 .
С увеличением температуры мольный объём газа увеличивается. Мольный объём газов с возрастанием температуры будет расти, а с возрастанием давления уменьшаться(2.24).
У этого уравнения есть свои граничные условия. Оно справедливо для описания поведения газов при давлениях, близких к атмосферному (от 0,1 до 1,0–1,2 МПа), и при температурах ≈ 0–20 о С. При повышенном давлении газ сжимается и его состояние отличается от поведения идеальных газов.
Источник









