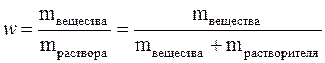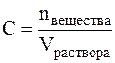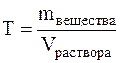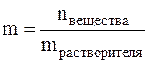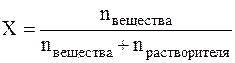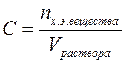Способы выражения состава растворов



Состав любого раствора может быть выражен как качественно, так и количественно. Обычно, при качественной оценке раствора применяют такие понятия как, насыщенный, ненасыщенный, пересыщенный (или перенасыщенный), концентрированный и разбавленный раствор.
Насыщенным называется раствор, в котором содержится максимально возможное при данных условиях (t, р) количество растворённого вещества. Насыщенный раствор часто находится в состоянии динамического равновесия с избытком растворённого вещества, при котором процесс растворения и процесс кристаллизации (выпадения вещества из раствора) протекают с одинаковой скоростью.
Для приготовления насыщенного раствора растворение вещества необходимо вести до образования осадка, не исчезающего при длительном хранении.
Ненасыщенным называется раствор, который содержит вещества меньше, чем его может раствориться при данных условиях.
Перенасыщенные растворы содержат в себе по массе больше растворённого вещества, чем его может раствориться в данных условиях. Образуются перенасыщенные растворы при быстром охлаждении насыщенных растворов. Они неустойчивы и могут существовать ограниченное время. Очень быстро лишнее растворённое вещество выпадает в осадок, а раствор превращается в насыщенный.
Следует отметить, что при изменении температуры насыщенный и ненасыщенный растворы могут легко обратимо превращаться друг в друга. Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация и растворение играют огромную роль в природе: приводят к образованию минералов, имеют большое значение в атмосферных и почвенных явлениях. На основе кристаллизации в химии распространён метод очистки веществ, который называется перекристаллизацией.
Для приблизительного количественного выражения состава раствора используют понятия концентрированный и разбавленный растворы.
Концентрированным называется раствор, в котором масса растворённого вещества соизмерима с массой растворителя, т.е. не отличается от него более чем в 10 раз.
Если же масса растворённого вещества более чем в десять раз меньше массы растворителя, то такие растворы называются разбавленными.
Однако следует помнить, что деление растворов на концентрированные и разбавленные условно, и чёткой границы между ними нет.
Точный количественный состав растворов выражают при помощи массовой доли растворённого вещества, его молярной концентрации, а также некоторыми другими способами.
Массовая доля растворённого вещества (w) – это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора,т.е.
Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора.
Молярная концентрация (С) или молярность – это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т.е.
Молярность измеряется в моль/л и показывает сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1М), если 0,1 моль вещества – децимолярным (0,1М), если 0,01 моль вещества – сантимолярным (0,01М), если 0,001 моль вещества – миллимолярным (0,001М).
Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т.е.
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора.
Моляльная концентрация или моляльность (m) – это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т.е.
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя.
Мольная доля (Х) – это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
Мольная доля – это безразмерная величина и измеряется в долях единицы или в %.
Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация – это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах), т.е.

Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалентавещества, то такой раствор называется однонормальным (1н), если 0,1 моль вещества – децинормальным (0,1н), если 0,01 моль вещества – сантинормальным (0,01н), если 0,001 моль вещества – миллинормальным (0,001н).
Источник
Способы выражения химического состава растворов, расчеты. Растворимость. Факторы, влияющие на растворимость.



Физические и химические свойства веществ, их разделение, выделение, очистка и идентификация. Химические реактивы, чистота, степени градации. Измерение количеств веществ, единицы (массовые, объемные, мольные).
Ответ: Физические свойства— это свойства, поддающиеся измерению и выражаемые числовыми значениями, по которым каждое вещество отличается от остальных веществ (масса, объем, температура, давление и т. д.).
Химические свойства или реакции веществ– превращения одних веществ в другие вещества.
Осаждение – это образование твердого осадка в растворе в ходе химической реакции.
Ректификация – это процесс разделения бинарных и многокомпонентных смесей за счет противоточного массо -и теплообмена между паром и жидкостью.
Дистилляция – перегонка (испарение) жидкости с последующим охлаждением и конденсацией паров.
Экстракция – метод извлечения вещества из раствора или сухой смеси с помощью подходящего растворителя.
Сорбция – поглощение твердым телом или жидкостью различных веществ из окружающей среды.
| Определяемый ион | Реакция | Признаки реакции |
| Mg 2+ | OH — | Mg(OH)2 – белый осадок |
| Cu 2+ | OH — NH4OHизб | Cu(OH)2 – голубой осадок [Cu(NH3)4] 2+ — темно-фиолетовый раствор |
| Fe 2+ | OH — K3[Fe(CN)6] | Fe(OH)2 – серо-зеленый осадок, буреет. Турбулева синь |
| Fe 3+ | OH — K4[Fe(CN)6] SCN — | Fe(OH)3 – коричневый осадок Берлинская лазурь Fe[Fe(SCN)6] –Красная окраска |
| Ni 2+ | OH — | Ni(OH)2 – яблочно-зеленый осадок |
| Co 2+ | OH — SCN — | Co(OH)2 – синий или грязно-розовый осадок [Co(SCN)6] 2- — Синяя окраска |
| Al 3+ | OH — | Al(OH)3 – растворяется осадок |
| Zn 2+ | OH — | Zn(OH)2 – растворяется осадок |
| NH4 + | OH — [HgI4] 2- , OH — | NH3 – запах [Hg2N*H2O]I – красный осадок |
| Ag + | OH — NH3*H2O | Ag2O [Ag(NH3)2]OH – реактивТолленса |
| CO3 2- | H + | CO2— газ |
| SiO3 2- | H + | H2SiO3 — осадок |
| CH3COO — | H + | Запах |
| Cl — | Ag + | AgCl – белый творожистый осадок |
| SO4 2- | Ba 2+ | BaSO4 – белый |
| Pb 2+ | I — | PbI2 – желтый осадок |
| NO3 — | Cu, H2SO4 | NO2— бурый газ |
«Ч» — чистый (содержание вещества более 98%)
«Ч.Д.А.» — чистый для анализа (содержание вещества выше или значительно ниже 98%)
«Х.Ч.» — химически чистый (содержание вещества более 99%)
«О.С.Ч.» — особо чистый (содержащиеся примеси присутствуют в незначительном количестве, не сказывающемся на специфических свойствах вещества).
«ТЕХ.» — технический (низкая классификация реактива, содержание вещества выше 70%)
Измерения количеств веществ:
ω=mраств. вещ-ва/mраствора * 100% — массоваядоля
N=nрас-ля/∑n — мольная доля растворителя (растворенного вещества)
С=nраств. вещ-ва/Vраствора — молярная концентрация (молярность)
См=nраств. вещ-ва/mраствора — моляльная концентрация (моляльность)
Сн=nэквивалента/Vраствора — нормальная концентрация (нормальность)
2. Растворы, классификация, химический состав, составляющие, приготовление.
Ответ:Раствор – гомогенная смесь, состоящая из частиц растворенного вещества, растворителя и продуктов взаимодействия.
1. По агрегатному состоянию:
А) Твердые (сплавы)
В) Газообразные (воздух)
2. По количеству растворенного вещества:
А) Ненасыщенный (еще можно растворять вещество)
Б) Насыщенный (вещество не растворяется)
В) Перенасыщенный (при данных условиях содержится больше растворенного вещества, чем в насыщенном)
Раствор — однофазная система переменного, или гетерогенного, состава, состоящая из двух или более компонентов.
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает.
Правила приготовления растворов:
1. Использовать только чистые растворители (дистиллированная вода)
2. Посуда должна быть чистой
3. При растворении кислот следует приливать кислоту в воду.
4. При попадании кислоты на кожу нужно промыть пораженное место большим количеством воды.
5. При растворении щелочей следует добавлять щелочь небольшими порциями в воду.

6. При попадании щелочей на кожу обработать пораженный участок слабоконцентрированным раствором уксусной, борной или лимонной кислот.
Способы выражения химического состава растворов, расчеты. Растворимость. Факторы, влияющие на растворимость.
Состав раствора (и, в частности, содержание в нем растворенного вещества) может выражаться разными способами – как с помощью безразмерных единиц (долей и процентов), так и через размерные величины – концентрации. В химической практике наиболее употребительны величины: массовая доля, молярная доля, молярная концентрация, моляльная концентрация, нормальная концентрация.
Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
4. Стехиометрия химических взаимодействий. Атомно-молекулярное учение (Дальтон). Химические элементы, символы. Химические формулы. Современное содержание стехиометрических законов.
Стехиометрия — раздел химии о соотношениях реагентов в химических реакциях.Позволяет теоретически вычислять необходимые массы и объёмы реагентов.
Отношения количеств реагентов, равные отношениям коэффициентов в стехиометрическом уравнении реакции, называются стехиометрическими. Если вещества реагируют в соотношении 1:1, то их соответственные количества называют эквимолярными.
Основные положениятеории Дальтона:
1. Все вещества состоят из большого числа атомов (простых или сложных).
2. Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы.
3. Атомы различных элементов способны соединяться между собой в определённых соотношениях.
4.Важнейшим свойством атомов является атомный вес.
Символы химических элементов используются как сокращения для названия элементов. В качестве символа обычно берут начальную букву названия элемента и в случае необходимости добавляют следующую или одну из следующих. Обычно это начальные буквы латинских названий элементов: Cu — медь (cuprum), Ag — серебро(argentum), Fe — железо (ferrum), Au — золото (aurum), Hg — ртуть (hydrargirum). Такая система химических символов была предложена в 1811 г. шведским химиком Я. Берцелиусом.
Цифрами меньшего размера возле символа элемента обозначаются: слева вверху — атомная масса, слева внизу — порядковый номер, справа вверху — заряд иона, справа внизу — число атомов в молекуле:
| атомная масса | заряд иона |
| Символ элемента | |
| порядковый номер | число атомов в молекуле |
Химическая формула — условное обозначение химического состава и структуры веществ с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п.). Химические формулы являются составной частью языка химии, на их основе составляются схемы и уравнения химических реакций, а также химическая классификация и номенклатура веществ.
Химическая формула может обозначать или отражать:
· 1 молекулу или 1 моль вещества;
· качественный состав (из каких химических элементов состоит вещество);
· количественный состав (сколько атомов каждого элемента содержит реальная или условная молекула вещества).
Современные законы стехиометрии:
*Масса реагирующих веществ равна массе продуктов реакции.
* Химическое соединение, имеющее молекулярное строение, независимо от метода получения характеризуется постоянным составом.
* Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
* В молекулярных соединениях массы составляющих их элементов относятся между собой как их эквиваленты.
* При равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов, как небольшие целые числа.
Источник