2.5 Классификация кишечного шва, принципы и техника наложения. Характеристика, патоморфология и требования к кишечному шву
Кишечный шов — собирательное понятие, подразумевающее любые швы, накладываемые на брюшную часть пищевода, желудок, тонкую и толстую кишки.
В стенке пищеварительной трубки обычно различают 4 оболочки:
В практической хирургии существует футлярный принцип строения стенок пищеварительного канала, с учетом которого выделяют:
— наружный футляр, состоящий из серозной и мышечной оболочек;
— внутренний футляр, образованный слизистой и подслизистой оболочками.
Внутренний и наружный футляры подвижны относительно друг друга.
1. При рассечении стенки пищевода в наибольшей степени сокраща-ется внутренний футляр, поэтому стенку пищевода следует прокалывать косо латерально от серозной оболочки к слизистой.
2. При повреждении стенки желудка в наибольшей степени в стороны от разреза смещается наружный футляр, поэтому сквозь стенку желудка игла также должна проводиться в косом направлении, но косо медиально от серозной к слизистой оболочке.
3. Оба футляра тонкой и толстой кишок сочетанно расходятся при-близительно в равной степени, поэтому толщу их стенок следует проши-вать строго перпендикулярно.
Основные требования, предъявляемые к кишечному шву
1. Герметичность — на основе точной адаптации серозных поверх-ностей сшиваемых участков. Соединенные поверхности серозной оболоч-ки через 12–14 ч прочно склеиваются между собой, а через 24–48 ч сероз-ные слои прочно срастаются.
2. Гемостатичность — за счет прошивания сосудов подслизистого слоя.
3. Прочность — за счет включения в шов подслизистой оболочки.
4. Стерильность — в шов не захватывается слизистая оболочка.
5. Адаптационность — четкая адаптация одноименных слоев.
Для непрерывного шва нужно использовать рассасывающийся мате-риал независимо от того, в качестве наружного или внутреннего ряда он накладывается.
По глубине захвата ткани:
По особенностям выполнения:
По способу выполнения:
Техника выполнения основных швов
Шов Ламбера. Серозно-мышечный узловой шов: на расстоянии 1 см от края раны иглу с нитью проводят через серозный и мышечный слои и выкалы-вают на серозной поверхности у края раны. С противоположной стороны раны вкол начинают у края раны, затем иглу проводят через серозно-мышечный слой и выкалывают в 1 см от места вкола, причем слизистая в шов не захватывается.
Серозно-мышечный узловой шов, состоящий из 4-х стежков, наложен-ных одной нитью. Первый стежок выполняют на 1-й стороне кишки; 2-й сте-жок — на 2-й стороне кишки на одной линии с 1-м стежком; 3-й стежок — на 1-й стороне кишки параллельно 1-му стежку в том же направлении; 4-й сте-жок — на 2-й стороне кишки на одной линии с 3-м стежком параллельно 2-му стежку в том же направлении.
Кисетный шов (шов Дуайена). Шов накладывают против часовой стрел-ки из нескольких серозно-мышечных стежков длиной до 5 мм с малым рас-стоянием между стежками. Стежки располагают по окружности вокруг вооб-ражаемого центра. Первый вкол и последний выкол располагают поблизости один от другого. При затягивании шва центр окружности погружают в него.
Шов Шмидена. Непрерывный кишечный шов через все слои, каждый вкол которого начинают со слизистой оболочки: слизистая оболочка — се-розная оболочка на одной стороне, слизистая оболочка — серозная обо-лочка на 2-й стороне.
Шов Мультановского. Непрерывный обвивной кишечный шов через все слои, наиболее часто применяемый для наложения 1-го ряда швов: се-розная оболочка — слизистая оболочка на одной стороне кишки, слизистая оболочка — серозная оболочка — на 2-й стороне кишки.
Шов Пирогова-Матешука. Кишечный шов без захвата слизистой обо-лочки, узел которого завязывают в просвете кишки.
Источник
Способы выполнения кишечных швов
По ходу различных гинекологических операций нередко возникает необходимость в срочном производстве тех или иных общехирургических вмешательств. Необходимость в этом может возникнуть в случае диагностической ошибки, в результате которой вместо предполагавшегося гинекологического заболевания при ревизии органов таза и брюшной полости обнаружено хирургическое, например острый аппендицит. Наличие паралитической непроходимости (на почве перитонита) во время гинекологической операции или после нее вынуждает выполнить тот или иной вид энтеростомии.
Тесные топографоанатомические взаимоотношения между внутренними половыми органами, с одной стороны, и кишечником и мочевыводящими путями — с другой, в некоторых случаях ведут к случайным повреждениям этих органов во время гинекологических операций, что вынуждает хирурга-гинеколога к вмешательству на кишечнике или мочевыводящих путях.
При повреждении тонкой кишки без вскрытия ее просвета необходимо по возможности извлечь поврежденную петлю кишки из брюшной полости, обложить ее салфетками и заперитонизировать поврежденный участок кишки серо-серозными (серозно-мышечными) швами с частичным захватыванием мышечной (но не слизистой!) оболочки. Швы лучше накладывать узловатые, тонким шелком.
При повреждении тонкой кишки со вскрытием просвета необходимо прикрыть (завернуть) поврежденную петлю кишки салфеткой, извлечь ее (если это возможно) из брюшной полости, загрязненную салфетку удалить и обложить чистыми. Небольшую колотую рану достаточно ушить кисетным, восьмиобразным или Z-образным серозно-мышечным швом, а при завязывании такого шва место повреждения погрузить пинцетом в просвет кишки. Раны больших размеров ушивают двухрядным швом в поперечном к длиннику кишки направлении, чтобы не сузить ее просвет. Для этого сначала по краям раны накладывают швы-держалки (лучше серозно-мышечные, несколько отступя от краев раны в поперечном направлении). При необходимости края раны экономно иссекают. Затем накладывают первый ряд непрерывного вворачивающего кетгутового шва через все слои стенки кишки. Смена салфеток, перчаток и инструментов. Второй ряд — узловатые шелковые серозно-мышечные швы. Проверка проходимости кишки.
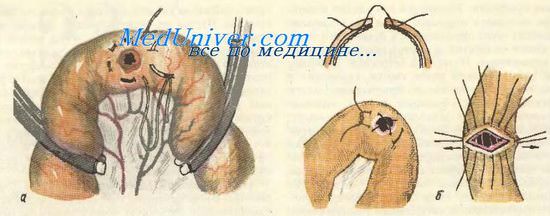
Резекция кишки производится при значительном или множественном ее повреждении, в тех случаях, когда невозможно ограничиться простым наложением шва, а также при распространении патологического процесса (опухолевого, воспалительного), требующего удаления определенной части кишки. В первом случае (повреждение) резекцию кишки необходимо производить, как только ранение замечено; во втором случае (опухоль, воспалительный процесс) резекцию кишки выполняют в. конце операции, на заключительном ее этапе.
Существуют различные технические приемы рассечения брыжейки и наложения анастомоза. Восстановление непрерывности кишечника производится наложением межкишечного анастомоза по одному из следующих способов: конец в конец, бок в бок и конец в бок. Чаще всего применяется анастомоз конец в конец, являющийся наиболее физиологичным и более простым по технике его выполнения.
Техника резекции тонкой кишки. Петля кишки, подлежащая резекции, выводится в рану и изолируется марлевыми салфетками. Устанавливают границы резекции в пределах здоровых тканей и приступают к отделению резецируемого участка кишки от брыжейки. Для этого при резекции небольшого участка кишки сосудистые зажимы накладывают на брыжейку поэтапно вблизи стенки кишки; брыжейку рассекают между зажимами и перевязывают шелком. При более обширной резекции кишки необходимо клиновидное иссечение брыжейки. Технически это удобно выполнить, используя марлевые держалки; последние проводят через проделанные в брыжейке у стенки кишки отверстия, в местах предполагаемого ее пересечения. Натягивая марлевые держалки при расправленной петле кишки, рассекают в виде клина сначала только брюшинный листок брыжейки; затем обнажают сосуды, которые пересекают между зажимами и перевязывают; необходимо строго следить за сохранением кровоснабжения остающихся участков кишки. Для этого полезно перед пересечением крупного сосуда временно пережать его. Содержимое кишки пальцами осторожно вытесняют в соседние петли; отступя 10—15 см от места предполагаемого пересечения, на остающиеся участки кишки накладывают мягкие эластические кишечные жомы, а на удаляемый участок — прямые раздавливающие жомы или большие зажимы Ко-хера.
При наложении анастомоза конец в конец раздавливающие зажимы лучше накладывать косо, как это изображено на рисунке, чтобы после рассечения кишки по инструменту на остающемся участке имел место «недостаток» кишечной стенки со свободного (противобрыжеечного) края его. Этим достигается, во-первых, лучшее кровоснабжение стенки кишки в области будущего анастомоза, во-вторых, большая ширина просвета дает меньшую возможность возникновения рубцового сужения анастомоза.
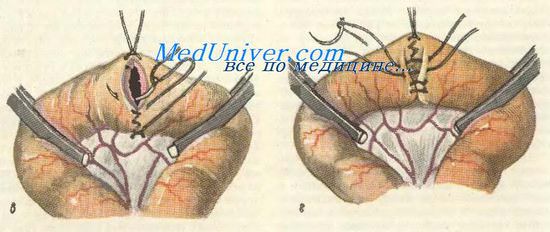
Тонким шелком накладывают серозно-мышечные швы-держалки по свободному и брыжеечному краям • остающихся участков кишки и косо пересекают кишку между раздавливающими зажимами и держалками, ближе к инструменту; препарат удаляют. Осушают просветы кишки и связывают швы-держалки между собой. Затем накладывают или узловатый шелковый серо-серозный, или непрерывный кет-гутовый шов через все слои стенок кишки, причем всегда обычно начинают с задних губ анастомоза. Далее кетгутовым швом переходят на передние губы Стенки передних губ анастомоза прокалывают или в той же последовательности, что и задние (изнутри — кнаружи, снаружи — внутрь), или используя вворачивающий (скорняжный) шов Шмидена (изнутри — кнаружи, изнутри — кнаружи). Концы нитей связывают и отсекают. Этот ряд швов должен быть механически герметичным (особенно следят за герметичностью в углах, т, е. при переходе с задних губ на передние). Вместе с тем он не должен нарушать кровоснабжения кишечной стенки в области анастомоза. Чтобы не сузить просвет кишки, на брыжеечном и свободном краях его, а иногда и между ними, рекомендуется сделать узел-захлестку. После смены инструментов, салфеток и перчаток приступают к наложению второго ряда (этажа) узловатых серозно-мышечных швов тонким шелком на переднюю и заднюю полуокружности. Снимаются мягкие зажимы и ушивается отверстие в брыжейке; это лучше делать с обеих сторон, захватывая в шов только брюшинные листки. Проверяется проходимость анастомоза.
При наложении анастомоза бок в бок после перевязки и рассечения брыжейки раздавливают кишечную стенку зажимом (например, Кохера) и в пережатом месте перевязывают крепким кетгутом. Отступя примерно на 1—1,5 см в сторону остающейся петли кишки с каждой стороны, накладывают по кисетному серозно-мышечному шву тонким шелком. Производят резекцию, а культи приводящей и отводящей петли после смазывания их йодом погружают в кисетный шов.
После надежного ушивания обеих культей и смены салфеток, инструментов и перчаток содержимое приводящего и отводящего концов кишки перемещают и отграничивают мягкими эластическими кишечными жомами. Концы кишки прикладывают друг к другу изоперистальтически и, отступя от каждой культи на 2—3 см, на протяжении 8 см соединяют их узловатыми шелковыми швами (серозно-мышечны-ми — первый чистый шов); на расстоянии 0,75 см по обе стороны от наложенных швов вскрывают просвет обеих кишечных петель таким образом, чтобы разрез не доходил примерно на 1 см до конца линии серозно-мышечных швов. Непрерывным кетгутовым обвивным швом, проникающим через все слои кишечной стенки, сшивают внутренние края получившихся отверстий или задние губы (первый грязный шов). Шов начинают соединением углов обоих отверстий и, завязав узел, оставляют начало нитки необрезанным и достаточно длинным (на рис. не показано). После ушивания этих губ шов закрепляют узлом и накладывают вворачивающий шов Шмидена на наружные края отверстия или передние губы (второй грязный шов). Дойдя до начала этого шва, конец кетгутовой нити двойным узлом связывают с ее началом.
На этом инфицированный (грязный) этап операции заканчивается, после чего производится повторная смена инструментов, салфетоки перчаток. Сняв с кишечных петель кишечные жомы, по другую сторону анастомоза шелком накладывают второй ряд узловатых серозно-мышечных швов (второй чистый шов). Швы накладывают отступя на 0,75 см от второго грязного шва. Обе культи во избежание их втягивания фиксируют несколькими швами к стенке кишки. Отверстие в брыжейке ушивается и проверяется проходимость анастомоза.
Источник
Проблема состоятельности кишечного шва
В.А. ГОРСКИЙ¹, М.А. АГАПОВ¹, А.Е. КЛИМОВ², С.С. АНДРЕЕВ²
¹Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, 117997, г. Москва, ул. Островитянова, д. 1
²Российский университет дружбы народов, 117198, г. Москва, ул. Миклухо-Маклая, д. 6
Горский Виктор Александрович — доктор медицинских наук, профессор, и.о. заведующего кафедрой хирургии медико-биологического факультета, тел. +7-903-218-81-81, e-mail: gorviks@yandex.ru 1
Агапов Михаил Андреевич — доктор медицинских наук, доцент кафедры хирургии медико-биологического факультета, тел. +7-916-365-79-20, e-mail: getinfo911@mail.ru 1
Климов Алексей Евгеньевич — доктор медицинских наук, профессор, заведующий кафедрой факультетской хирургии, тел. +7-916-622-06-51, e-mail: klimov.pfu@ mail.ru 2
Андреев Сергей Сергеевич — ассистент кафедры факультетской хирургии, тел. +7-903-530-30-77, e-mail: asmxav@yandex.ru 2
В статье представлены экспериментальные и клинические результаты исследования метода укрепления кишечных швов фибрин-коллагеновой субстанцией. Показано, что субстанция позволяет усилить механическую прочность и ускорить репаративные процессы области анастомозов, профилактируя их несостоятельность. Применение данного метода в клинике оправдано при перитоните и кишечной непроходимости.
Ключевые слова: кишечный шов, несостоятельность, фибрин-коллагеновая субстанция (ФКС).
V.A. GORSKIY 1 , M.A. AGAPOV 1 , A.E. KLIMOV 2 , S.S. ANDREEV 2
1 Russian National Research Medical University named after N.I. Pirogov, 1 Ostrovityanov St., Moscow, Russian Federation, 117997
2 Peoples’ Friendship University of Russia, 6 Mikluho-Maklay St., Moscow, Russian Federation, 117198
The problem of consistency of intestinal suture
Gorskiy V.A. — D. Med. Sc., Professor, Deputy Head of the Department of Surgery of Medicobiologic Faculty, tel. +7-903-218-81-81, e-mail: gorviks@yandex.ru 1
Agapov M.A. — Assistant at the Department of Surgery, tel. +7-916-365-79-20, e-mail: getinfo911@mail.ru 1
Klimov A.E. — D. Med. Sc., Professor, Head of the Department of Faculty Surgery, tel. +7-916-622-06-51, e-mail: klimov.pfu@ mail.ru 2
Andreev S.S. — Assistant of the Department of Faculty Surgery, tel. +7-903-530-30-77, e-mail: asmxav@yandex.ru 2
The article presents the results of experimental and clinical research of the method of strengthening the intestinal sutures with fibrin-collagen substance. It is demonstrated that the substance allows enhancing mechanical strength and accelerating the repair processes of the area of anastomoses when making a prophylaxis of their disability. Use of this method in clinic is justified in case of peritonitis and intestinal obstruction.
Key words: intestinal suture, insolvency, fibrin-collagen substance (FCS).
Одной из актуальных проблем абдоминальной хирургии является проблема профилактики и оперативного лечения больных с несостоятельностью кишечных швов. Данное осложнение наблюдается в 2-3,5% случаев при операциях на желудке и двенадцатиперстной кишке (ДПК), в 3-9% при операциях на тонкой и в 5-25% случаев при операциях на толстой кишке 2. Вероятность несостоятельности увеличивается при формировании анастомозов в условиях измененной кишечной стенки при перитоните и кишечной непроходимости. Высокий процент несостоятельности швов после вмешательств на толстой кишке связывают с анатомо-физиологическими особенностями строения, характером и вирулентностью населяющей ее микрофлоры. Следует признать, что создание оптимальных условий для заживления кишечных швов является основным резервом улучшения результатов при хирургическом вмешательстве на органах желудочно-кишечного тракта [5, 6].
Целостность хирургических швов зависит от ряда причин как со стороны анастомозируемых органов, так и от внеорганных изменений. Можно выделить 3 группы причин, влияющих на нарушение целостности хирургических швов:
1) состояние и патоморфологические процессы, происходящие в ушиваемых или анастомозируемых органах;
2) неблагоприятные факторы, при которых эти швы накладываются, или неблагоприятные факторы, возникающие в послеоперационном периоде;
3) технические особенности наложения швов.
Первая группа причин, безусловно, является определяющей, т.к. жизнеспособность стенки органа в первую очередь влияет на состоятельность швов кишки и анастомозов. К ним относятся: активное воспаление тканей; технические погрешности в виде чрезмерной мобилизации стенки органа и грубого наложения швов; внутристеночное и общее нарушение кровообращения; повышение внутрикишечного давления; гипопротеинемия; локальное инфицирование.
В экспериментальных работах [7], посвященных изучению заживления анастомозов, была показана важная роль коллагена при формировании соустья. Так, в первые дни после хирургического вмешательства происходит массивный лизис коллагена в зоне анастомоза, а процессы его синтеза угнетены. Поэтому «коллагеновое равновесие» имеет решающее значение для сохранения целостности и герметичности кишечного шва. Инфицирование же зоны шва приводит к существенному усилению процесса лизиса коллагена и несостоятельности.
Считается, что в зоне анастомоза происходят два диаметрально противоположных процесса. Первый, определяемый механической прочностью шва и имеющий максимум в момент наложения, зависит в большей мере от рядности наложенных швов. В последующие сутки механическая прочность и герметичность неуклонно падают, достигая максимума снижения этих свойств на 4–7-е сутки. Этот вид прочности шва достигает максимума к 10–12-м суткам. Второй процесс — это биологическая прочность шва, которая и определяется процессами коллагеногенеза. Лизис коллагена достигает максимума также к 4–7-м суткам. Сочетание этих двух факторов и таит в себе угрозу несостоятельности шва.
Еще одним немаловажным фактором, снижающим прочность желудочных и кишечных соустий, является инфицирование самой зоны анастомозируемых тканей [5, 8, 9]. Инфицирование возникает в результате контакта шовных каналов и шовного материала (лигатурное инфицирование) с просветом органа и его содержимым, что обуславливает проникновение микрофлоры в толщу сшитых тканей с последующим развитием в них воспалительных и некротических процессов. В зоне наложенного анастомоза на ранних сроках, всегда имеются благоприятные условия для развития микрофлоры — наличие ишемии, питательная среда в виде остатков крови, изменение рН, окислительно-восстановительных потенциалов. Поэтому инфицирование зоны анастомоза является закономерным процессом и зависит от вида кишечного шва и концентрации микробов в просвете органа.
Нельзя сбрасывать со счета и проблему шовного материала. При лигатурном шве по шовным каналам происходит просачивание кишечного содержимого, и проникновение инфекции в толщу соустья с возможным образованием микроабсцессов. Данные, полученные в клинике академика В.К. Гостищева (2002), позволили выявить воспалительную реакцию тканей на шовные лигатуры независимо от вида и характера материала [5]. Вокруг нитей выявляли участки некроза, лейкоцитарную инфильтрацию, кровоизлияния. Лигатуры, даже из рассасываемого материала, через 2-3 недели изолировались по типу инородных тел. Авторы выявили закономерность, что такой процесс происходит всегда и с любым типом шовного материала в условиях асептического воспаления. Однако эти условия во многом способствуют увеличению возможности появления гнойно-некротических процессов. Так, в присутствии лигатуры вирулентность микрофлоры усиливается в 1000 раз и более.
На основании экспериментальных исследований А.А. Запорожца [10, 11] введено понятие «биологическая герметичность» кишечного шва. Было доказано, что в первые дни после операции на желудке и кишечнике брюшная полость инфицируется миллионами кишечных микробов, проникающих в нее из просвета оперированных органов через физически герметичный шов. По данным автора микробная проницаемость кишечного шва достигает максимума на 2–3-и сутки после операции, и чем она значительней, тем чаще возникает послеоперационный перитонит.
Временная биологическая проницаемость соустий может привести к образованию порочного круга. Проницаемость хирургического шва для микрофлоры приводит к инфицированию брюшной полости и развитию перитонита. В свою очередь парез кишечника, который сопровождает перитонит, также способствует развитию несостоятельности швов.
Перитонит, существующий в брюшной полости в момент наложения кишечного шва, в значительной мере влияет на заживление стенки органа. При этом избыточное образование биологически активных веществ ведет к стойкому нарушению микроциркуляции в стенке кишки, а присоединившееся угнетение моторно-эвакуаторной функции желудочно-кишечного тракта с перенаполнением его просвета жидким и газообразным содержимым усугубляет нарушение кровообращения в кишечной стенке. Все это происходит на фоне дестабилизации реологических свойств крови, инфицированных, воспалительно-измененных тканей, что создает неблагоприятные условия для заживления ушитой раны стенки полого органа и ведет к деструкции слизистой и подслизистого слоя.
Технические особенности наложения шва волнуют хирургов не одно столетие. Написано колоссальное количество трудов, посвященное различным типам хирургического шва, их особенностям, преимуществам и недостаткам. Этот вопрос столь многопланов и неоднозначен, а его обсуждение не входит в рамки статьи.
С нашей точки зрения, существенному уменьшению несостоятельности кишечного шва могут способствовать применение прецизионной техники и дополнительное укрепление его биологическими материалами. Технические аспекты наложения кишечного шва мы не рассматриваем в данном сообщении, а считаем необходимым сконцентрировать внимание на методиках дополнительного укрепления швов и анастомозов.
Проблема биологической не герметичности кишечных швов и возникновение осложнений заставило хирургов разрабатывать различные методики по укреплению линии соединения сшиваемых органов. Для этой цели используется большой сальник, лоскут париетальной брюшины, аутодермальный имплантат и консервированные аллотрансплантаты, твердая мозговая оболочка, а также различные полимерные пленки и биологические клеи [12, 13].
Большой сальник, обладая хорошо развитой системой кровеносных сосудов и высокими репаративными способностями, оказался очень удобным для защиты соустий полых органов от несостоятельности. Ряд авторов используют как изолированный или неизолированный сальник, так и различные его комбинации с другими биологическими и синтетическими материалами. Однако анализ экспериментальных и клинических данных показывает, что сальник не только не препятствует возникновению недостаточности швов, а может подвергаться в последующем полной дегенерации и замещаться грубой волокнистой соединительной тканью, что чревато стенозированием соустья 14. Другие биологические методы не нашли широкого применения из-за сложности, а иногда и опасности выполнения.
В 70–80-е годы прошлого столетия широко использовались цианокрилатные клеи. Первоначально благоприятные отзывы были отмечены в эксперименте при резекциях желудка и тонкой кишки, когда подкрепляли однорядно наложенные швы цианокрилатом или заменяли ручной шов клеевым. Однако в последнем случае наблюдался местный некроз на 2–3-и сутки, а выраженная воспалительная реакция ослабевала лишь к концу 1-й недели. Высокий риск несостоятельности клеевого соединения не позволил экспериментаторам внедрить метод в клиническую практику. Проведенные гистоморфологические исследования показали, что подкрепление внутреннего ряда швов цианокрилатным клеем не только не приводит к усилению герметичности анастомоза, но даже ослабляет его при сравнении с контрольным шовным анастомозом из-за инфильтрации и очагового некроза слизистой оболочки [17].
Другой клеевой субстанцией, используемой для герметизации кишечного шва, является биологический адгезив на основе фибрина. В его состав входит фибриноген, тромбин, ингибитор фибринолиза апротинин и ионы кальция. При нанесении смеси на раневую поверхность образуется фибриновая пленка, которая быстро уплотняется.
Хорошие результаты получены в клинике при формировании однорядных ручных и механических толстокишечных анастомозов с укреплением линии швов фибриновым клеем. При этом отмечено, что гистосовместимость адгезива положительно влияет на скорость репаративных процессов, позволяет уменьшить количество швов соустья, снижая тем самым угрозу ишемии.
Наряду с хорошей адгезией были выявлены существенные недостатки фибринового клея. В первую очередь, это большая трудоемкость приготовления действующего раствора непосредственно перед наложением. Длительность приготовления делает пригодными его лишь для плановой ситуации. Каждый субстрат двухкомпонентного клея должен накладываться один за другим или оба компонента перед аппликацией перемешиваются, что усложняет применение таких субстанций в лапароскопической хирургии. Кроме того, в месте нанесения клея отмечается возникновение спаечного процесса. К общему недостатку клеевых композиций, выпускаемых в виде многокомпонентных жидкостей, является их быстрая полимеризация, затрудняющая применение и усложняющая оперативную технику [18].
Вышеуказанных недостатков лишена комбинированная фибрин-коллагеновая субстанция (ФКС) «ТахоКомб», состоящая из коллагена, фибриногена, тромбина [19]. При контакте с раневой поверхностью содержащиеся в покрывающем коллаген слое факторы свертывания высвобождаются, и тромбин превращает фибриноген в фибрин, который обеспечивает гемостатический и адгезивный эффект. Коллагеновая пластина при этом служит хорошим защитным слоем, не пропускающим жидкость и воздух.
В клинике ФКС с успехом используется для достижения гемостаза при хирургических вмешательствах на паренхиматозных органах. Помимо гемостатического эффекта ФКС обладает хорошей адгезией к ткани, что делает его весьма перспективным для укрепления кишечного шва.
Нами впервые было проведено экспериментальное исследование по укреплению кишечных швов препаратом ФКС (1996-2002), результаты которого внедрены в клиническую практику [20, 21]. Настоящая статья резюмирует результаты многолетней поисковой работы. При этом, учитывая практическую направленность издания, мы облекли изложение в более простую и понятную читателям форму, избежав многочисленных научных выкладок.
Материал и метод
Пластические свойства ФКС по укреплению швов и анастомозов исследовали в остром и хроническом эксперименте на 54 беспородных собаках. Швы накладывали на предварительно выполненные раны желудка, тонкой и толстой кишки без и в условиях экспериментального перитонита.
Сравнительную механическую прочность анастомозов исследовали в остром и хроническом эксперименте методом определения давления разрыва анастомоза. В опытной группе линию кишечных швов циркулярно укрывали пластиной ФКС шириной 2 см, предварительно смоченной в физиологическом растворе. Давления разрыва анастомоза изучали через 5, 10, 30 и 60 минут после аппликации препарата, сравнивая показания с контрольными тонкокишечными анастомозами. В хроническом эксперименте механическую прочность межкишечного анастомоза изучали на 1-е, 3-и, 7-е и 14-е сутки после операции.
Микробную обсемененность укрепленных и контрольных анастомозов исследовали в 1-е и 3-и сутки послеоперационного периода методом отпечатков.
Особенности заживления укрепленных соустий изучали в хроническом эксперименте. Визуальный контроль и взятие материала для морфологического исследования осуществляли на 1-е, 3-и, 7-е, 14-е и 30-е сутки после наложения анастомозов.
В клинике ФКС был использован для укрепления кишечных швов при высоком риске их несостоятельности у 182 больных. При этом препарат наносится в один слой. Конфигурация пластины должна моделировать линию шва с захождением краев препарата на серозный покров не менее чем на 2 см. Перед аппликацией препарат необходимо смочить, кратковременно (1-2 сек.) поместив в раствор антибиотика широкого спектра действия, который предполагается использовать в послеоперационном периоде парентерально. Фиксация осуществляется смоченным в том же растворе марлевым тампоном в течение 5 минут. Удалять тампон необходимо с осторожностью, обязательно от края к центру, придерживая соответствующий край инструментом.
При аппликации препарата на анастомозы следует соблюдать следующие условия: анастомозы, наложенные конец в конец или конец в бок укрываются полностью с захватом части брыжейки кишки на 2 см; при наложении боковых соустий укрепляется не только передняя и задняя губа анастомоза, но в обязательном порядке и ушитая культя приводящей петли, т.к. она, как правило, является слабым местом анастомоза; культю отводящей петли можно не укреплять; аппликацию препарата необходимо проводить в последнюю очередь перед зашиванием раны передней брюшной стенки. В противном случае во время проведения санации брюшной полости пластина препарата может быть случайно сдвинута или оторвана при манипуляциях.
Результаты
В результате эксперимента выяснили, что ФКС увеличивает механическую прочность швов в 1,5-3 раза, снижая микробную обсемененность зоны дополнительно закрытого анастомоза в 16 раз. Кроме того был установлен выраженный эффект стимуляции репаративных процессов — нанесение ФКС способствовало более быстрой регенерации кишечной стенки. Так, эпителизация зоны опытных анастомозов начиналось уже к 3-м суткам, а появление железистого аппарата в слизистой оболочке наблюдалось к 7-м суткам, тогда как у контрольных животных эти процессы происходили в значительно более поздние сроки.
В клинике пластические свойства биполимера ФКС использовали в прогностически неблагоприятных условиях при традиционных и лапароскопических операциях у 182 больных. При перфоративной гастродуоденальной язве у 49 больных, при наличии выраженного перифокального воспаления вокруг зоны перфорации, при традиционной и лапароскопической операции производили однорядное ушивание перфоративного отверстия с нанесением поверх шва биополимера ФКС. Осложнений не наблюдали. При эндоскопическом контроле грубых деформаций в зоне ушивания не было. Язвенные дефекты при проведении противоязвенной терапии заживали быстрее (к 14-м суткам), что, вероятно, было связано с активацией местных репаративных процессов.
В 17 случаях технически тяжелых резекций желудка у больных со стенозом привратника и атипичным укрытием культи ДПК при применении ФКС, импрегнированной антибактериальным препаратом, нам удалось избежать несостоятельности шва.
Одним из вариантов является также профилактика желчеистечения при операциях на билиарном тракте путем нанесения ФКС на швы холедоха, билиодигестивные соустья. Эффективность методики подтверждена у 45 больных. В настоящее исследование включены 14 больных, которым проводили укрепление терминолатеральных билиодигестивных соустий. Несостоятельности анастомозов и подтекания желчи не наблюдали.
Укрепление швов и анастомозов при операциях на тонкой и толстой кишке при перитоните и кишечной непроходимости проведено у 99 пациентов. В этой группе преобладали больные, которым были выполнены резекция (42 пациента) и ушивание дефектов (12 пациентов) тонкой кишки. При этом несостоятельность шва отмечена у 1 больного при лапароскопическом ушивании раны тонкой кишки.
Ререзекцию несостоятельных анастомозов с наложением повторных межкишечных соустий в условиях распространенного перитонита произвели у 6 пациентов. Осложнений не было.
Правостороннюю гемиколэктомию (20 больных) с наложением илеотрансверзоанастомоза и укреплением ФКС выполняли по поводу опухолей правой половины ободочной кишки, осложненных перфорацией с распространенным перитонитом либо кишечной непроходимостью. В 1 случае поводом для проведения подобной операции послужило острое нарушение мезентериального кровообращения с развитием некроза участка тонкой и правой половины ободочной кишки.
Ушивание дефектов толстой кишки произвели у 6 больных. У 1 пациента выполнена резекция купола слепой кишки по поводу перфорации в зоне основания червеобразного отростка и выраженного тифлита. У 2 больных — субтотальная колэктомия при обтурирующих опухолях сигмовидной кишки с кишечной непроходимостью. При операциях на толстой кишке все укрепленные швы и анастомозы оказались состоятельны.
Попытки укрепления несостоятельных швов и анастомозов предприняты нами в 9 случаях. Во всех наблюдениях они носили вынужденный характер вследствие невозможности экстраперитонизации кишечных петель с несостоятельным анастомозом. В 7 случаях аппликации биополимера ФКС на ушитые дефекты межкишечных соустий повторной несостоятельности не произошло. В 1 случае укрепления повторных швов на несостоятельной культе ДПК образовался дуоденальный свищ, который довольно быстро закрылся самостоятельно. Эти клинические наблюдения, безусловно, не могут расцениваться как попытка внедрения новой лечебной тактики при несостоятельности хирургического шва. Однако использование методики укрепления биополимером несостоятельного соустья в отдельных экстраординарных ситуациях, при невозможности выполнения других вмешательств, в ряде случаев оправдано.
Таким образом, экспериментальные исследования показали, что ФКС не только усиливает механическую прочность, но и ускоряет репаративные процессы за счет стимуляции ангиогенеза, тем самым предотвращая несостоятельность швов кишки и анастомозов. Применение ФКС в пластических целях обосновано в сложных, нетипичных ситуациях. Наиболее целесообразным является использование препарата в неблагоприятных условиях — перитонит, кишечная непроходимость, выраженные воспалительно-инфильтративные изменения органов и тканей. В подобных случаях аппликацией ФКС можно предупредить развитие несостоятельности кишечных швов и снизить риск оперативного вмешательства.
1. Бабаджанов Б.Д., Тешаев О.Р., Бекетов Г.И. Новые подходы к лечению послеоперационных перитонитов // Вестник хирургии. — 2002. — № 4. — С. 25-28.
2. Гостищев В.К., Дибиров М.Д., Хачатрян Н.Н., Евсеев М.А., Омелькоский В.В. Новые возможности профилактики послеоперационных осложнений в абдоминальной хирургии // Хирургия. — 2011. — № 10. — С. 56-60.
3. Biondo S., Pares D., Creisltr E. et al. Anastomotic dehiscence after resection and primary anastomosis in left-sided colonic emergenies // Dis Colon Rectum. — 2005. — Vol. 48. — 2272-2280.
4. Branagan G., Finnis D. Prognosis after anastomotic leak in colorectal surgery // Dis Colon Rectum. — 2005. — Vol. 48. — 1021-1076.
5. Егоров В.И., Турусов Р.А., Счастливцев И.В., Баранов А.О. Кишечные анастомозы. Физико-механические аспекты. — М.: Видар-М, 2002. — 190 с.
6. Мрих О.В. Профилактика и лечение несостоятельности кишечных анастомозов с использованием биоэксплантатов: автореф. дис. … канд. мед. наук. — Уфа, 2000. — 22 с.
7. Hesp W., Hendriks T., Schillngs P. et al. Histological features of wound repair: a comparison between experimental ileal and colonic anastomoses // Br. J. Exp. Path. — 1985. — Vol. 66. — P. 511- 518.
8. Жебровский В.В. Осложнения в хирургии живота. — М.: МИА, 2006. — 445 с.
9. Нартайлаков М.А. Клинико-экспериментальное обоснование целесообразности применения шовно-клеевого способа в хирургии кишечника: автореф. дис. … канд. мед наук. — Казань, 1989. — 95 с.
10. Запорожец А.А. Роль биологической негерметичности кишечного шва в развитии послеоперационного перитонита // Тезисы докладов объединенного пленума научных обществ хирургов и травматологов-ортопедов Белоруссии. — Минск, 1976. — С. 41-42.
11. Шотт А.В., Запорожец А.А., Клинцевич В.Ю. Кишечный шов. — Минск: Беларусь, 1983. — 160 с.
12. Кутуков В.В. Оперативные способы профилактики несостоятельности швов на органах желудочно-кишечного тракта: автореф. дис. … д-ра мед. наук. — М., 2001. — 38 с.
13. Мохов Е.М., Бредихин Е.И. Укрепление толстокишечных анастомозов демукоризованным трансплантатом тонкой кишки // Вестник хирургии. — 1990. — № 6. — С. 115-117.
14. Дамбаев Г.Ц., Соловьев М.И. Пластика перфоративных отверстий желудка и двенадцатиперстной кишки (экспериментальное исследование) // Хирургия. — 1995. — № 2. — С. 51-53.
15. Jones S.A., Steman R.A. Management of chronic infected perforation by the serosal patch technic // Amer. J. Surg. — 1969. — Vol. 5. — P. 731-734.
16. Kimura H. et al. Strangulation ileus resulting from encasement of a loop of the small intestine by the great omentum caused by abnormal adhesion // J. of Gastroenterology. — 1996. — Vol. 31, No. 5. — Р. 711-716.
17. Истомин Н.П., Ратов В.Г. Шовно-клеевое цианокрилатное соединение (критический опыт) // Сборник научн. работ «Проблемы неотложной хирургии». — М., 1998. — С. 33.
18. Parker J.S., Brown D., Hill P.F. Fibrinogen-impregnated collagen as a combined hemostatic agent and antibiotic delivery system in a porcine model of splenic trauma // Eur J Surg. — 1999. — Vol. 165. — Р. 609-614.
19. Carbon R.T. et al. Tissue management with fleece-bound sealing: materials, science, and clinical implementation // Materials of the 6th World Congress of Trauma, Shock, Inflammation and Sepsis. — 2004, 2-6 March.
20. Горский В.А. Использование фибрин-коллагеновых пластин в абдоминальной хирургии // Вестник хирургии. — 2001. — № 2. — С. 77-81.
21. Горский В.А., Шуркалин Б.К., Леоненко И.В. Применение Тахокомба в абдоминальной хирургии. — М.: Атмосфера, 2003. — 168 с.
1. Babadzhanov B.D., Teshaev O.R., Beketov G.I. New approaches to treatment of postoperative peritonitis. Vestnik khirurgii, 2002, no. 4, pp. 25-28 (in Russ.).
2. Gostishchev V.K., Dibirov M.D., Khachatryan N.N., Evseev M.A., Omel’koskiy V.V. New possibilities for prevention of postoperative complications in abdominal surgery. Khirurgiya, 2011, no. 10, pp. 56-60 (in Russ.).
3. Biondo S., Pares D., Creisltr E. et al. Anastomotic dehiscence after resection and primary anastomosis in left-sided colonic emergenies. Dis Colon Rectum, 2005, vol. 48, pp. 2272-2280.
4. Branagan G., Finnis D. Prognosis after anastomotic leak in colorectal surgery. Dis Colon Rectum, 2005, vol. 48, pp. 1021-1076.
5. Egorov V.I., Turusov R.A., Schastlivtsev I.V., Baranov A.O. Kishechnye anastomozy. Fiziko-mekhanicheskie aspekty [Intestinal anastomoses. Physical and mechanical aspects]. Moscow: Vidar-M, 2002. 190 p.
6. Mrikh O.V. Profilaktika i lechenie nesostoyatel’nosti kishechnykh anastomozov s ispol’zovaniem bioeksplantatov: avtoref. dis. … kand. med. nauk [Prevention and treatment of insolvency intestinal anastomoses using bioeksplantatov. Synopsis of dis. PhD med. sci]. Ufa, 2000. 22 p.
7. Hesp W., Hendriks T., Schillngs P. et al. Histological features of wound repair: a comparison between experimental ileal and colonic anastomoses. Br. J. Exp. Path., 1985, vol. 66, pp. 511- 518.
8. Zhebrovskiy V.V. Oslozhneniya v khirurgii zhivota [Complications in surgery of the abdomen]. Moscow: MIA, 2006. 445 p.
9. Nartaylakov M.A. Kliniko-eksperimental’noe obosnovanie tselesoobraznosti primeneniya shovno-kleevogo sposoba v khirurgii kishechnika: avtoref. dis. … kand. med nauk [Clinical and experimental rationale for the use of suture-adhesive method bowel surgery. Synopsis of dis. PhD med. sci]. Kazan, 1989. 95 p.
10. Zaporozhets A.A. Rol’ biologicheskoy negermetichnosti kishechnogo shva v razvitii posleoperatsionnogo peritonita [The role of biological leaking intestinal suture in the development of postoperative peritonitis]. Tezisy dokladov ob»edinennogo plenuma nauchnykh obshchestv khirurgov i travmatologov-ortopedov Belorussii. Minsk, 1976. Pp. 41-42.
11. Shott A.V., Zaporozhets A.A., Klintsevich V.Yu. Kishechnyy shov [Intestinal suture]. Minsk: Belarus, 1983. 160 p.
12. Kutukov V.V. Operativnye sposoby profilaktiki nesostoyatel’nosti shvov na organakh zheludochno-kishechnogo trakta: avtoref. dis. … d-ra med. nauk [Operational methods for preventing insolvency seams on the organs of the gastrointestinal tract. Synopsis of dis. Dr med. sci]. Moscow, 2001. 38 p.
13. Mokhov E.M., Bredikhin E.I. Strengthening of colonic anastomoses demukorizovannym small intestine transplant. Vestnik khirurgii, 1990, no. 6, pp. 115-117 (in Russ.).
14. Dambaev G.Ts., Solov’ev M.I. Plastic perforated holes of the stomach and duodenum (experimental study). Khirurgiya, 1995, no. 2, pp. 51-53 (in Russ.).
15. Jones S.A., Steman R.A. Management of chronic infected perforation by the serosal patch technic. Amer. J. Surg., 1969, vol. 5, pp. 731-734.
16. Kimura H. et al. Strangulation ileus resulting from encasement of a loop of the small intestine by the great omentum caused by abnormal adhesion. J. of Gastroenterology, 1996, vol. 31, no. 5, rr. 711-716.
Источник




