Vuz-24.ru
Материалы в помощь студентам и научным работникам
Задание с ответами: химия. ЕГЭ — 2018
Из предложенного перечня внешних воздействий выберите два воздействия, которые приводят к увеличению скорости реакции крекинга октана
2) добавление катализатора
3) добавление
4) повышение давления
5) увеличение объёма реакционного сосуда
Запишите в поле ответа номера выбранных внешних воздействий.
Сведения для решения
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — тех, которые находятся в разных фазах, например: жидкие и твердые, твердые и газообразные), при увеличении давления (для газообразных реагентов). Также скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющих реакцию, но не входящих в состав продуктов реакции.
Для указанного агрегатного состояния реагента добавление катализатора и увеличение давления способствует увеличению скорости реакции.
Правильный ответ: 24.
Правильный ответ: 24|42
Источник
Пояснение
Гомогенный реакции практически всегда идут быстрее гетерогенных.
23. B 19 № 3913. Скорость реакции разложения 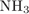
1) добавлении
2) повышении давления
4) увеличении объёма реакционного сосуда
Пояснение.
Это газофазная реакция, поэтому повышение давления увеличивает концентрацию исходных веществ, а значит и ускоряет реакцию.
24. B 19 № 3955. Скорость реакции крекинга октана 
2) добавлении
3) повышении давления
4) увеличении объёма реакционного сосуда
Пояснение.
Это газофазная реакция, поэтому повышение давления увеличивает концентрацию исходных веществ, а значит и ускоряет реакцию.
Источник
Способы увеличить скорость крекинга октана
Из предложенного перечня выберите все способа увеличить скорость синтеза аммиака из простых веществ.
1) использование катализатора
2) увеличение объёма реактора
3) добавление аммиака
4) увеличение общего давления
5) понижение температуры
Запишите в поле ответа номера выбранных способов.
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости химической реакции
.
1) повышение температуры
2) добавление иодоводорода
3) понижение давления
4) повышение концентрации иода
5) увеличение объема реакционного сосуда
Запишите в поле ответа номера выбранных внешних воздействий.
Из предложенного перечня выберите все способа уменьшить скорость реакции разложения пероксида водорода в водном растворе.
1) разбавление раствора
2) охлаждение раствора
3) уменьшение давления над раствором
4) добавление катализатора
5) добавление пероксида водорода
Запишите в поле ответа номера выбранных способов.
Из предложенного перечня выберите все факторы, от которых зависит скорость реакции порошка железа с раствором сульфата меди.
1) кислотность среды
3) давление над раствором
4) концентрация ионов меди
5) степень измельчения порошка
Запишите номера выбранных ответов.
Из предложенного перечня выберите все способы уменьшить скорость разложения аммиака на простые вещества в газовой фазе.
1) уменьшение общего давления
2) добавление катализатора разложения
3) удаление водорода из реакционной смеси
4) понижение температуры
5) увеличение концентрации азота
Запишите номера выбранных ответов в порядке возрастания.
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости реакции азота с бором.
1) уменьшение температуры
2) уменьшение концентрации азота
3) увеличение объема реакционного сосуда
4) увеличение температуры
5) увеличение давления
Запишите в поле ответа номера выбранных внешних воздействий.
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к уменьшению скорости реакции азота с водородом.
1) понижение температуры
2) понижение давления
3) увеличение концентрации азота
4) использование катализатора
5) повышение давления в системе
Запишите в поле ответа номера выбранных внешних воздействий.
Из предложенного перечня выберите все вещества, на скорость реакции между которыми оказывает влияние давление.
2) раствор серной кислоты
3) оксид кальция
5) соляная кислота
Запишите номера выбранных ответов.
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости реакции
1) охлаждение системы
2) снижение давления
3) удаление аммиака
4) нагревание системы
5) добавление водорода
Запишите в поле ответа номера выбранных внешних воздействий.
Из предложенного перечня выберите все способы увеличения скорости реакции между твёрдым хлоридом натрия и серной кислотой.
1) увеличение общего давления
2) нагревание реакционного сосуда
3) добавление воды
4) увеличение концентрации кислоты
5) измельчение хлорида натрия
Запишите номера выбранных ответов в порядке возрастания.
Источник
Способы увеличить скорость крекинга октана
Равновесие сместится вправо при
2) добавлении
3) уменьшении объема реакционного сосуда
4) добавлении катализатора
По принципу Ле Шателье — если на систему, находящуюся в состоянии химического равновесия, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в равновесие в системе сдвинется в сторону, уменьшающую воздействие.
При всех указанных воздействиях кроме уменьшении объема реакционного сосуда и добавления катализатора равновесие сдвинется влево.
Добавление катализатора не смещает равновесие.
Наша учительница утверждает, что на смещение равновесия влияет и катализатор. Приводила именно этот пример. (Хотя в учебнике и дополнительной литературе везде пишется, что катализаторы только ускоряют наступление равновесия). Не могли бы Вы развеять мои сомнения? Заранее спасибо.
Попробуйте показать учебник учительнице.
УМЕНЬШЕНИЕ ОБЪЕМА ПРИВОДИТ СМЕЩЕНИЕ В СТОРОНУ БОЛЬШЕГО ЧИСЛА КОЭФ, У ГАЗОВ».
Нет — уменьшение объема увеличивает давление.
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости реакции крекинга октана
2) добавление катализатора
3) добавление
4) повышение давления
5) увеличение объёма реакционного сосуда
Запишите в поле ответа номера выбранных внешних воздействий.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — тех, которые находятся в разных фазах, например: жидкие и твердые, твердые и газообразные), при увеличении давления (для газообразных реагентов). Также скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющих реакцию, но не входящих в состав продуктов реакции.
Для указанного агрегатного состояния реагента добавление катализатора и увеличение давления способствует увеличению скорости реакции.
Из предложенного перечня выберите все способы увеличить скорость реакции между этиленом и парами воды.
1) добавление этанола
2) увеличение концентрации воды
3) понижение температуры
4) добавление катализатора
5) уменьшение общего давления
Запишите в поле ответа номера выбранных способов в порядке возрастания.
1. Добавление этанола — повышение концентрации продуктов — нет влияния на скорость реакции;
2. Увеличение концентрации воды — повышение концентрации реагентов — повышение скорости реакции;
3. Понижение температуры — понижение скорости реакции;
4. Добавление катализатора — повышение скорости реакции;
5. Уменьшение объёма реактора — понижение концентрации газообразных реагентов — понижение скорости реакции.
Из предложенного перечня выберите все способа уменьшить скорость разложения серного ангидрида на сернистый газ и кислород в газовой фазе.
1) добавление катализатора разложения
2) уменьшение общего давления
3) добавление кислорода
4) удаление сернистого газа из реакционной смеси
5) понижение температуры
Запишите номера выбранных ответов в порядке возрастания.
1. Добавление катализатора увеличит скорость реакции;
2. уменьшение общего давления приведёт к понижению концентрации реагентов и, как следствие, уменьшению скорости реакции;
3. добавление кислорода практически не повлияет на скорость реакции;
4. удаление сернистого газа практически не повлияет на скорость реакции;
5. понижение температуры приведёт к уменьшению скорости реакции.
Из предложенного перечня выберите все способы уменьшить скорость разложения аммиака на простые вещества при высокой температуре.
1) добавление катализатора — железа
2) уменьшение общего давления
3) добавление аммиака
4) уменьшение объёма реактора
5) понижение температуры
Запишите номера выбранных ответов в порядке возрастания.
1. Добавление катализатора увеличит скорость реакции;
2. уменьшение давления приведёт к понижению концентрации газообразного реагента, следовательно, понизит скорость реакции;
3. добавление аммиака (реагента) повысит его концентрацию и увеличит скорость реакции;
4. уменьшение объёма реактора приведёт к повышению концентрации аммиака (реагента) и увеличит скорость реакции;
5. понижение температуры уменьшит скорость реакции.
Установите соответствие между способом воздействия на равновесную систему, в которой протекает реакция:
и направлением смещения химического равновесия при этом воздействии: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СПОСОБ ВОЗДЕЙСТВИЯ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Принцип Ле Шателье: если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
А — 1. Охлаждение сместит равновесие в сторону экзотермической, то есть прямой, реакции.
Б — 2. 5 моль газообразных реагентов вступают в реакцию и образуют только 4 моль газообразных продуктов, следовательно равновесие сместится в сторону реагентов при уменьшении давления.
В — 3. При добавлении катализатора равновесие не смещается.
Г — 1. Кислород является реагентом, а добавление реагентов смещает реакцию вправо.
Равновесие в реакции С2Н4(г) + Н2O(г) = С2Н5ОН(г) + Q сместится в сторону продукта при
1) увеличении общего давления
3) добавлении этанола
4) добавлении катализатора
По принципу Ле Шателье — если на систему, находящуюся в состоянии химического равновесия, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в равновесие в системе сдвинется в сторону, уменьшающую воздействие.
Увеличении общего давления сместит равновесие в сторону продуктов. Добавление катализатора не вызывает смещения равновесия.
Остальные варианты — в сторону реагентов.
Установите соответствие между способом воздействия на равновесную систему, в которой протекает реакция:
и направлением смещения химического равновесия при этом воздействии: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СПОСОБ ВОЗДЕЙСТВИЯ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
Принцип Ле Шателье: если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
А — 3. Равновесие практически не смещается, поскольку слева и справа одинаковое количество моль газа.
Б — 1. Смещается в направлении прямой реакции, т. к. прямая реакция является эндотермической.
В — 2. Смещается в направлении обратной реакции, поскольку в продуктах присутствует оксид азота(II).
Г — 3. При добавлении катализатора равновесие не смещается.
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости реакции
1) увеличение концентрации кислорода
2) понижение температуры
3) увеличение концентрации углекислого газа
4) понижение давления
5) добавление катализатора
Запишите в поле ответа номера выбранных внешних воздействий.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — тех, которые находятся в разных фазах, например: жидкие и твердые, твердые и газообразные), при увеличении давления (для газообразных реагентов). Также скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющих реакцию, но не входящих в состав продуктов реакции.
Для указанных агрегатных состояний реагентов добавление катализатора и увеличение концентрации реагента способствует увеличению скорости реакции.
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости реакции
1) понижение температуры
2) добавление катализатора
3) увеличение концентрации углекислого газа
4) повышение давления
5) понижение давления
Запишите в поле ответа номера выбранных внешних воздействий.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — тех, которые находятся в разных фазах, например: жидкие и твердые, твердые и газообразные), при увеличении давления (для газообразных реагентов). Также скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющих реакцию, но не входящих в состав продуктов реакции.
Для указанных агрегатных состояний реагентов добавление катализатора и увеличение давления способствует увеличению скорости реакции.
увеличение давления не влияет, так как нет изменения объёма (из 5 моль получается 5 моль)
Вы путаете условие для принципа Ле-Шателье, который используется для обратимых реакций, чтобы понять как повлияет изменение условий на ход реакции (прямая или обратная), но в данном случае реакция необратимая, увеличение давления ведет к более частому столкновению реагирующих частиц газа, поэтому скорость процесса увеличивается.
Из предложенного перечня внешних воздействий выберите все воздействия, которые приводят к увеличению скорости реакции
1) нагревание системы
2) охлаждение системы
3) снижение давления
4) удаление дибромэтана
5) добавление катализатора
Запишите в поле ответа номера выбранных внешних воздействий.
Скорость химической реакции зависит от природы реагирующих веществ.
Скорость реакции увеличивается при увеличении температуры, увеличении концентрации исходных веществ (для газообразных и растворенных реагентов), увеличении площади соприкосновения реагентов (для гетерогенных реагентов — тех, которые находятся в разных фазах, например: жидкие и твердые, твердые и газообразные), при увеличении давления (для газообразных реагентов). Также скорость реакции увеличивается под влиянием катализаторов — веществ, ускоряющих реакцию, но не входящих в состав продуктов реакции.
Для указанных агрегатных состояний реагентов увеличение температуры и добавление катализатора способствует ускорению химической реакции.
Установите соответствие между способом воздействия на равновесную систему
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
По правилу Ле-Шателье, равновесие смещается в сторону реакции ослабляющей внешнее воздействие. Катализатор не влияет на смещение равновесия.
А) увеличение концентрации водорода приводит к смещению равновесия в сторону обратной реакции (расходование водорода)
Б) добавление катализатора не влияет на смещение равновесия
В) понижение температуры приводит к смещению равновесия в сторону обратной реакции (экзотермической реакции)
Г) повышение давления приводит к смещению равновесия в сторону обратной реакции (меньшего числа газообразных частиц)
Установите соответствие между способом воздействия на равновесную систему
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
Запишите в ответ цифры, расположив их в порядке, соответствующим буквам:
Это экзотермическая реакция в которой происходит уменьшение количества газообразных веществ, поэтому:
А) уменьшение температуры приведет к смещению химического равновесия в сторону прямой реакции (1).
Б) уменьшение концентрации углекислого газа приведет к смещению химического равновесия в сторону обратной реакции (2).
В) уменьшение давления приведет к смещению химического равновесия в сторону обратной реакции (2).
Г) добавление катализатора влияет лишь на скорость реакций, а не на состояние химического равновесия, поэтому практически не смещается (3).
Давление влияет только на газовую систему.Разве не так?
На реакции с участием газообразных веществ, хотя бы одного.
Из предложенного перечня выберите все способы уменьшить скорость разложения аммиака на простые вещества в газовой фазе.
1) уменьшение общего давления
2) добавление катализатора разложения
3) удаление водорода из реакционной смеси
4) понижение температуры
5) увеличение концентрации азота
Запишите номера выбранных ответов в порядке возрастания.
1. Уменьшение общего давление приведёт к понижению концентрации реагента, и как следствие, приведёт к понижению скорости реакции;
2. добавление катализатора повысит скорость реакции;
3. удаление водорода практически не повлияет на скорость реакции;
4. понижение температуры понизит скорость реакции;
5. увеличение концентрации азота практически не повлияет на скорость реакции.
Химическое равновесие в реакции смещается в сторону образования продукта реакции при
1) понижении давления
2) повышении температуры
3) добавлении катализатора
4) добавлении водорода
Принцип Ле Шателье — если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Понижение давление (внешнее воздействие) приведет к усилению процессов увеличивающих давление, значит, равновесие сместится в сторону большего количества газообразных частиц (которые и создают давление), т.е. в сторону реагентов.
При повышении температуры (внешнее воздействие) система будет стремиться понизить температуру, значит, усиливается процесс поглощающий тепло. равновесие сместится в сторону эндотермической реакции, т.е. в сторону реагентов.
Катализатор не влияет на смещение равновесия
Добавление водорода (внешнее воздействие) приведет к усилению процессов расходующих водород, т.е. равновесие сместится в сторону продукта реакции
Источник








