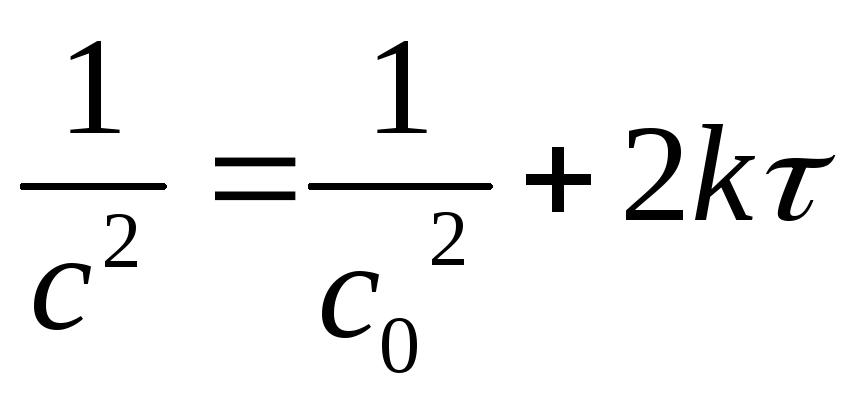- 3. Предложите способы увеличения выхода продуктов данной химической реакции.
- 2. Определите количество вещества (моль/л), израсходованного за указанное время t при температуре т2 , если начальная концентрация реагентов одинакова и равна с0 .
- Предложите способы увеличения выхода продуктов данной химической реакции.
- Образец выполнения ТР №2 (Термодинамика), страница 2
- Описание файла
- Онлайн просмотр документа «Образец выполнения ТР №2 (Термодинамика)»
- Текст 2 страницы из документа «Образец выполнения ТР №2 (Термодинамика)»
3. Предложите способы увеличения выхода продуктов данной химической реакции.
Для увеличения выхода продуктов данной химической реакции необходимо смещение химического равновесия в сторону продуктов реакции. Применим принцип Ле-Шателье.
1) увеличить температуру системы, т.к. процесс эндотермический
2) увеличить концентрацию (парциальное давление) исходного газа СО2 — дополнительный ввод газа;
снижать концентрацию (парциальное давление) продукта реакции СО – отводить газ из сферы реакции;
3) понизить общее давление в системе, т.к. прямая реакция идет с увеличением числа молей газообразных веществ.
ЗАДАЧА 4. Химическая кинетика.
Для заданной химической реакции nА + mВ ® AnBm
5 . 10 -5 л 2 ×моль -2 ×с -1
2 . 10 -1 л 2 ×моль -2 ×с -1
1. Рассчитайте энергию активации по значениям констант скорости реакции k1 и k2 при температурах Т1 и Т2 , соответственно. Дайте определение и предложите способы изменения энергии активации.
Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса:
где R = 8,31 Дж/(моль×К) – универсальная газовая постоянная.
Для заданной химической реакции:
ln(2 . 10 -1 / 5 . 10 -5 ) = Еакт . (400 — 330 ) / 8,31 . 400 . 330, решаем уравнение и получаем: Еакт =130 кДж/моль.
Энергия активации – энергия, необходимая для перехода реагирующих частиц в состояние активированного комплекса. Энергию активации можно уменьшить с помощью катализатора.
2. Определите количество вещества (моль/л), израсходованного за указанное время t при температуре т2 , если начальная концентрация реагентов одинакова и равна с0 .
По размерности константы скорости химической реакции,
[ k ] = [л 2 ×моль -2 ×с -1 ] , определяем порядок химической реакции: n=3.
Изменение концентрации исходных веществ по времени при одинаковой начальной концентрации исходных веществ для реакции третьего порядка рассчитывается по уравнению:
где с – текущая концентрация веществ в момент времени τ,
с0 – начальная концентрация веществ, k – константа скорости,
Рассчитаем текущую концентрацию исходных веществ с в момент времени τ =30мин =1800 сек при температуре 400 К,
k2= 2 . 10 -1 л 2 ×моль -2 ×с -1 :

решаем уравнение и получаем: с = 0,035 моль/л.
Количество вещества (моль/л), израсходованного за 30 минут при температуре 400 К:
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
Предложите способы увеличения выхода продуктов данной химической реакции.
Для увеличения выхода продуктов данной химической реакции необходимо смещение химического равновесия в сторону продуктов реакции. Применим принцип Ле-Шателье.
1) увеличить температуру системы, т.к. процесс эндотермический
(∆r H 0 Т > 0), в соответствии с изобарой Вант-Гоффа:
2) увеличить концентрацию (парциальное давление) исходного газа СО2 — дополнительный ввод газа;
снижать концентрацию (парциальное давление) продукта реакции СО – отводить газ из сферы реакции;
3) понизить общее давление в системе, т.к. прямая реакция идет с увеличением числа молей газообразных веществ.
ЗАДАЧА 4. Химическая кинетика.
Для заданной химической реакции nА + mВ ® AnBm
| Т1, К | Т2, К | k1 | k2 | t , мин | С0 , моль/л |
| 5 . 10 -5 л 2 ×моль -2 ×с -1 | 2 . 10 -1 л 2 ×моль -2 ×с -1 | 0,1 |
1. Рассчитайте энергию активации по значениям констант скорости реакции k1 и k2 при температурах Т1 и Т2 , соответственно. Дайте определение и предложите способы изменения энергии активации.
Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса:
где R = 8,31 Дж/(моль×К) – универсальная газовая постоянная.
Для заданной химической реакции:
ln(2 . 10 -1 /5 . 10 -5 )=Еакт . (400 — 330 ) / 8,31 . 400 . 330, решаем уравнение и получаем: Еакт =130 кДж/моль.
Энергия активации – энергия, необходимая для перехода реагирующих частиц в состояние активированного комплекса. Энергию активации можно уменьшить с помощью катализатора.
2. Определите количество вещества (моль/л), израсходованного за указанное время t при температуре Т2 , если начальная концентрация реагентов одинакова и равна С0 .
По размерности константы скорости химической реакции,
[ k ] = [л 2 ×моль -2 ×с -1 ] , определяем порядок химической реакции: n=3.
Изменение концентрации исходных веществ по времени при одинаковой начальной концентрации исходных веществ для реакции третьего порядка рассчитывается по уравнению:
где с – текущая концентрация веществ в момент времени τ,
с0 – начальная концентрация веществ, k – константа скорости,
Рассчитаем текущую концентрацию исходных веществ с в момент времени τ =30мин =1800 сек при температуре 400 К,
k2= 2 . 10 -1 л 2 ×моль -2 ×с -1 :

решаем уравнение и получаем: с = 0,035 моль/л.
Количество вещества (моль/л), израсходованного за 30 минут при температуре 400 К:
Рассчитайте период полупревращения для вашей реакции при температуре
Т2 . Определите, от каких факторов зависит период полупревращения для вашей реакции.
Рассчитаем период полупревращения τ1/2 для реакции 3-го порядка при температуре 400 К.

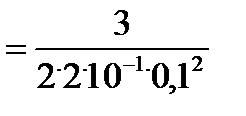
Для реакции 3-го порядка период полупревращения зависит от температуры, природы и концентрации реагентов.
ПРИЛОЖЕНИЕ
Таблица. Термодинамические характеристики некоторых веществ
| вещество | ∆Н 0 298, кДж/моль | DG 0 298, кДж/моль | S 0 298 , Дж/моль . К | с 0 р, 298 Дж/моль . К |
| Cd | 51,76 | |||
| CdCl2 | -256,1 | -342,6 | 115,3 | |
| Co | 30,04 | 24,6 | ||
| CoO | -239 | — | 52,7 | 78,6 |
| CoCl2 | -310 | -267 | 109,6 | — |
| Cu | 33,3 | 24,51 | ||
| CuO | -165,3 | -127 | 42,64 | 44,78 |
| CuCl2 | -205,9 | -166,1 | — | |
| СО2 (г) | -393,51 | -394,38 | 213,68 | 37,41 |
| Cr | 23,76 | 23,35 | ||
| CrCl3 | -554,8 | 122,9 | 91,8 | |
| Сl2 (г) | 222,96 | 33,93 | ||
| Fe | 27,15 | 24,98 | ||
| FeO | -263,7 | -244,3 | 58,79 | 49,92 |
| Fe2O3 | -821,32 | -741,5 | 89,96 | 48,12 |
| FeS | -100,5 | -100,9 | 60,33 | |
| FeCl2 | -341 | -301,7 | 120,1 | |
| H2O (г) | -241,82 | -228,61 | 188,7 | 33,61 |
| Н2О (ж) | -285,84 | -237,2 | 70,08 | 89,33 |
| H2S (г) | -20,17 | -33,01 | 205,6 | 33,44 |
| Ni | 29,86 | 26,05 | ||
| NiO | -239,7 | -216,5 | 38,07 | 44,27 |
| NiS | -94,1 | — | 52,99 | |
| Mo | 28,58 | 23,75 | ||
| MoO2 | -589,3 | 46,51 | 55,91 | |
| O2 (г) | 205,04 | 29,37 | ||
| Pb | 64,9 | 26,82 | ||
| PbO2 | -276,6 | -219 | 76,44 | 62,89 |
| SO2 (г) | -296,9 | -300,4 | 248,1 | 39,87 |
| W | 32,76 | 24,8 | ||
| WO3 | -841,3 | — | 81,6 | 79,7 |
| V2O5 | -1557 | — | — | |
| V2O3 | -1219 | — | — | |
| Zn | 41,59 | 25,48 | ||
| ZnS | -201 | -239,8 | 57,7 | 46,02 |
| ZnO | -349 | -318,2 | 43,5 | 40,25 |
Таблица. Термодинамические характеристики некоторых веществ и ионов
Источник
Образец выполнения ТР №2 (Термодинамика), страница 2
Описание файла
Документ из архива «Образец выполнения ТР №2 (Термодинамика)», который расположен в категории «разное». Всё это находится в предмете «химия» из первого семестра, которые можно найти в файловом архиве МЭИ (ТУ). Не смотря на прямую связь этого архива с МЭИ (ТУ), его также можно найти и в других разделах. .
Онлайн просмотр документа «Образец выполнения ТР №2 (Термодинамика)»
Текст 2 страницы из документа «Образец выполнения ТР №2 (Термодинамика)»
= 2 . (29,14)–8,54–37,41 =12,33 Дж/К.
Рассчитаем энергию Гиббса химической реакции при стандартном состоянии и заданных температурах 298 К, 500 К, 800 К, 1000 К с учетом зависимости ∆r H 0 Т и ∆r S 0 Т от температуры, считая постоянной величину удельной теплоемкости веществ ср , по формуле:
∆r G 0 500 =120,15+12,33 . 10 -3 . (500-298) — 500 . 12,33 . 10 -3 . ln (500/298)=
∆r G 0 800 =120,15+12,33 . 10 -3 . (800-298) — 800 . 12,33 . 10 -3 . ln (800/298)=
∆r G 0 1000 =120,15+12,33 . 10 -3 . (1000-298) — 1000 . 12,33 . 10 -3 . ln (1000/298) =
Термодинамическое условие химического равновесия: ∆rGT = 0.
Энергия Гиббса химической реакции при стандартном состоянии
Рассчитав величину ∆r G 0 T реакции , рассчитаем константу равновесия Кр по формуле:
где R=8,31 Дж/моль . К — универсальная газовая постоянная.
При увеличении температуры увеличивается константа равновесия, что объясняется эндотермическим тепловым эффектом данной реакции
( 

2. Выберите любую температуру из области самопроизвольного протекания реакции в прямом направлении. При этой температуре рассчитайте равновесные концентрации газообразных реагентов, если их исходные концентрации были равны, соответственно, ( см. п.3. табл. к задачам 1,2).
При Т=1000 К реакция протекает самопроизвольно в прямом направлении, т.к. ∆r G 0 1000 = — 3,16 кДж . атм/моль . К — универсальная газовая постоянная;
∆ν = 2-1= 1 (изменение числа молей газообразных веществ в ходе реакции).
Таблица материального баланса:
Изменение концентраций,Δс, моль/л
Подставляем равновесные концентрации газообразных реагентов в выражение для Kс и решаем алгебраическое уравнение относительно х :
Кс = 
ССО равн = 2 . 0,0387 = 0,0774моль/л
ССО2равн = 0,5 — 0,0387 = 0,4613 моль/л.
3. Предложите способы увеличения выхода продуктов данной химической реакции.
Для увеличения выхода продуктов данной химической реакции необходимо смещение химического равновесия в сторону продуктов реакции. Применим принцип Ле-Шателье.
1) увеличить температуру системы, т.к. процесс эндотермический
2) увеличить концентрацию (парциальное давление) исходного газа СО2 — дополнительный ввод газа;
снижать концентрацию (парциальное давление) продукта реакции СО – отводить газ из сферы реакции;
3) понизить общее давление в системе, т.к. прямая реакция идет с увеличением числа молей газообразных веществ.
ЗАДАЧА 4. Химическая кинетика.
Для заданной химической реакции nА + mВ ® AnBm
5 . 10 -5 л 2 ×моль -2 ×с -1
2 . 10 -1 л 2 ×моль -2 ×с -1
1. Рассчитайте энергию активации по значениям констант скорости реакции k1 и k2 при температурах Т1 и Т2 , соответственно. Дайте определение и предложите способы изменения энергии активации.
Зависимость константы скорости реакции от температуры определяется уравнением Аррениуса:

где R = 8,31 Дж/(моль×К) – универсальная газовая постоянная.
Для заданной химической реакции:
ln(2 . 10 -1 / 5 . 10 -5 ) = Еакт . (400 — 330 ) / 8,31 . 400 . 330, решаем уравнение и получаем: Еакт =130 кДж/моль.
Энергия активации – энергия, необходимая для перехода реагирующих частиц в состояние активированного комплекса. Энергию активации можно уменьшить с помощью катализатора.
2. Определите количество вещества (моль/л), израсходованного за указанное время t при температуре Т2 , если начальная концентрация реагентов одинакова и равна С0 .
По размерности константы скорости химической реакции,
[ k ] = [л 2 ×моль -2 ×с -1 ] , определяем порядок химической реакции: n=3.
Изменение концентрации исходных веществ по времени при одинаковой начальной концентрации исходных веществ для реакции третьего порядка рассчитывается по уравнению:

где с – текущая концентрация веществ в момент времени τ,
с0 – начальная концентрация веществ, k – константа скорости,
Рассчитаем текущую концентрацию исходных веществ с в момент времени τ =30мин =1800 сек при температуре 400 К,
k2= 2 . 10 -1 л 2 ×моль -2 ×с -1 :

решаем уравнение и получаем: с = 0,035 моль/л.
Количество вещества (моль/л), израсходованного за 30 минут при температуре 400 К:
3. Рассчитайте период полупревращения для вашей реакции при температуре
Т2 . Определите, от каких факторов зависит период полупревращения для вашей реакции.
Рассчитаем период полупревращения τ1/2 для реакции 3-го порядка при температуре 400 К.
Для реакции 3-го порядка период полупревращения зависит от температуры, природы и концентрации реагентов.
Источник