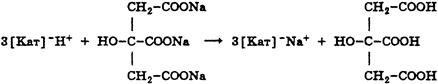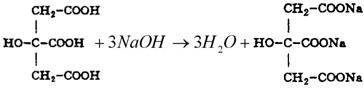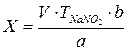Установление титра рабочего раствора
Лекция №2 Количественный анализ.
Понятие о титре
1. Титрование — определение количества вещества или точной концентрации раствора (титра) объемно-аналитическим путем.
В основе титрометрических определениц лежит положение о том, что объемы растворов, реагирующих между собой, обратно пропорциональны концентрациям этих растворов.
Для определения концентрации 1-го из реагирующих веществ, необходимо знать объемы реагирующих веществ, точную концентрацию другого раствора и установить момент, когда эти 2 вещества прореагируют в эквивалентных количествах.
В основе титрования лежат химические реакции, которые должны удоволетворять ряду требований:
· Реакция должна проходить количественно по определенному уравнению без побочных реакций, т.е. прибавляемый реактив должен расходоваться исключительно на реакцию с определенным веществом.
· Окончание реакции должно точно фиксироваться, чтобы количество реактива было эквивалентно количеству определяемого вещества. На эквивалентности реагирующих веществ основано вычисление результатов анализа.
· Реакция должна протекать с достаточной скоростью и быть практически необратимой.
Методы титрометрического анализа
В зависимости от того, какая реакция лежит в основе титрования, различают:
1.кислотно-основные методы, в основании которых лежит реакция нейтрализации. Этим методом определяют количество кислот, оснований и некоторых солей.
Нейтрализационное титрование применяется в клинике для определения кислотности желудочного сока, в санитарно-гигиенических лабораториях применяются для определения карбонатной жесткости воды, кислотности молочных продуктов, квашенной капусты и безалкогольных напитков.
2.Методы окислительно-востановительные (оксидиметрии). Основана на реакциях окислительного восстановления. При помощи растворов окислителей определяют содержание восстановителей и наоборот. (перманганатометрия, йодометрия, нитритометрия)
3.Методы осаждения и комплексообразования, основанные на осаждении ионов в виде труднорастворимых соединений и на связывании ионов в малодиссоциирующий комплекс. (аргентометрия, меркурометрия, комплексонометрия)
При титровании взаимодействуют 2 раствора: 1)рабочий раствор – тот раствор которым проводят титрование его концентрация известна; 2)титруемый раствор, концентрация которого неизвестна.
Работа с пипетками
Для отмеривания титруемого раствора применяют пипетку Мора или градуированную пипетку.
Пипетки д.б. идеально чистыми, перед набором раствора пипетку ополаскивают этим раствором. Жидкость в пипетку набирают с помощью груши. Уровень жидкости в пипетке определяется по нижнему мениску на уровне глаза. Выливая из пипетки жидкость из кончика пипетки не выдувают.
Работа с бюретками
Объем рабочего раствора, которым проводится титрование, измеряется бюреткой. Чаще применяется бюретка объемом 25мл и 50мл.
Бюретки д.б. тщательно вымыты и отрегулированы. Перед заполнением бюретку промывают раствором, которым будут в нее наливать. Кончик бюретки д.б. полностью заполнен, без пузырьков воздуха.
Уровень светлых растворов определяют по нижнему миниску на уровне глаз, а темных – по верхнему.
После каждого титрования рабочий раствор в бюретку доливают до «0».
После титрования остатки раствора сливают, бюретку тщательно промывают, сушат.
Индикаторы
Важным условием титрования является установление точки эквивалентности, т.е. момента, когда заканчивается реакция между рабочим раствором и титруемым растворами. Для определения этого момента применяют индикаторы. Действие их состоит в том, что при наступлении конца титрования индикаторы меняют цвет раствора, т.к. изменилась ph среды.
Если в конечной точке изменение окраски индикатора трудно улавливается человеческим глазом, рекомендуется применение раствора свидетеля.
Случаи когда индикаторы не применяются:
ü При оксидиметрии (перманганатом), т.к. рабочий раствор сам окрашен.
ü При осаждении рабочего раствора с титруемым образуют устойчивый осадок (AgNO3 +HCl) Точку эквивалентности находят по прекращению образования осадка.
ü Для некоторых реакций применяют специфические индикаторы – в-ва, реагирующие с изменением окраски с одним из участников титрования (например крахмал в йодометрии)
Индикаторы могут быть:
—внутренними, когда индикатор добавляют в титруемый раствор перед титрованием.
—внешними, когда по мере титрования титруемый раствор капают на фильтровальную бумагу и капают туда же индикатор.
Техника титрования
1.Размер колбы или стакана, в котором проводиться титрование, д.б. таким, чтобы объем жидкости в конце титрования не превышал ½ его объема.
2.В колбу помещают титруемый раствор и добавляют индикатор 2-3 капли
3.Бюретку заполняют рабочим раствором до «0». От других отметок нельзя титровать, т.к. шкала бюреток может быть неравномерной.
4.Колбу держат в правой руке и вращательными движениями перемешивают раствор.
5.Левой рукой открывают и закрывают кран бюретки, выпуская жидкость
6.Раствор из бюретки прибавляют до тех пор, пока не появиться устойчивое изменение окраски титруемого раствора, т.е. пока не установиться точка конца титрования
7.Результат титрования записывают до второго десятичного знака.
8.Для точности исследования необходимо проводить 3 параллельных титрования. При расчете определяют среднее арифметическое всех трех результатов.
9.Все результаты титрования записываются в рабочий журнал.
Установление титра рабочего раствора
Рабочий раствор тот, который расходовался для титрования. Необходимо точно знать его точную концентрацию (титр).
Для приготовления рабочего раствора существуют 2 метода:
1.Растворы с приготовленным титром — растворяют точную навеску и получается раствор с приготовленным титром
2.Растворы с установленным титром — раствор готовят примерно нужной концентрации, а точную концентрацию определяют титрованиями, получается раствор с установленным титром.
С течением времени титр меняется и его надо периодически проверять через 1-2 недели.
При установке титра рабочего раствора необходимо помнить об 1-ом из основных правил титрометрического анализа: титры рабочих растворов нужно устанавливать в таких же условиях, в каких будут выполняться анализы.
ДВА способа установки титра.
1.По навеске – это более точный способ. На аналитических весах будут три навески исходного вещества. Аккуратно переносят их в колбу, растворяют в воде и титруют рабочим раствором.
2.По точному раствору – берется определенный объем исходного раствора, приготовленного из фиксанала. По результатам титрования устанавливают нормальную концентрацию рабочего раствора, поправочный коэффициент и титр. Затем этот раствор можно использовать для работы.
Расчеты при титровании
1. Вычисление точной N -ой концентрации:
Нормальность подсчитывается до 4-го десятичного знака
Пример: определить N-ую концентрацию HCl, если на титрование пошло 10,0 мл раствора HCl пошло: а)10,25мл б)10,27мл в)10,25 мл 0,1Н NaOH. Vcp=10,26мл
2. Для вычисления точной N-ой концентрации часто применяют поправочный коэффициент К. Это величина, на которую умножают предполагаемую N-ую концентрацию рабочего раствора, чтобы получить точную концентрацию раствора.
Например, предполагали, что концентрация титруемого раствора будет 0,1n, а при титровании определена концентрация = 0,0945н
N-концентрация определенная экспериментально
N0 – предполагаемая концентрация
Если рабочий раствор приготовлен из фиксанала, то К=1
Вычисление титра
Концентрацию рабочего раствора часто выражают в виде титра по определенному веществу.
Титр— это количество г определяемого вещества, соответствует 1мл рабочего раствора.
Для расчетов применяется формула:
где: х-рабочий раствор, у-определяемое в-во
Например, дан рабочий раствор AgNO3 c N=0.1020n ЭCl=35.45
Следовательно, титр AgNO3 по Cl равен
Столько г Cl соответствует 1мл AgNO3
4. Вычисление массы определяемого вещества
где: Ру-масса определяемого вещества
Vх – объем определяемого вещества
Например, какое количество Cl содержалось в титруемом хлориде, если на титрование пошло 8,2 мл AgNO3?
Оксидиметрия
1. Понятие Оксидиметри. Особенности
В основе Оксидиметрии лежат окислительно-востановительные реакции. Эти реакции протекают сложнее, чем ионообменные реакции, например нейтрализации.
Основные особенности окислительно-востановительных реакций:
I. Реакции часто протекают в несколько стадий, причем каждая из них протекает с различной скоростью.
II. Возможно разное направление реакции при одних и тех же веществах, в процессе нередко образовываются вещества, изменяющие ход самой реакции
III. Скорость реакций окисления-востановления ниже скорости ионообменных реакций и требуются особые условия для успешного проведения
Особые условия проведения окислительно-востановительных реакций:
a. Повышение температуры
b. Повышение концентрации реагирующих веществ
c. Измерение pH метра
d. Применение катализатора
С помощью этой методики определяют содержание Са 2+ в крови. В санитарно-гигиеническом анализе этим методом определяют так называемую окисляемость воды, т.е. количество KMnO4(перманганат калия), необходимое для окисления органических веществ в сточных водах. В фармакологии метод используют для определения концентрации Н2О2(пероксид водорода) в лекарственных препаратах.
В перманганатометрии рабочим раствором является KMnO4, который является сильным окислителем, особенно в кислой среде.
В зависимости от среды при восстановлении KMnO4 получаются различные конечные продукты. В кислой среде ионы MnO4 — восстанавливаются до бесцветных ионов Mn 2+ : MnO4 + 5e — +8H →Mn 2+ +4H2O
В слабокислой, нейтральной и щелочной среде ионы MnO4 — +2H2O+3e — →MnO2↓+4OH —
Образование темного осадка затрудняет определение конца реакции, поэтому титрование проводят в кислой среде. Для подкисления применяют только H2SO4, т.к. HClвступает в окислительно-восстановительную реакцию с KMnO4.
Ионы MnO4 — придают раствору KMnO4 малиновую окраску. В процессе титрования раствор обесцвечивается. В момент, когда в растворе не останется восстановителя, от прибавления первой капли KMnO4 титруемая смесь приобретает розовую окраску. Таким образом, точка Эквивалентности фиксируется при помощи самого же рабочего раствора и индикатор в этом методе не применяется.
Реакция идет при нагревании. Катализатором здесь являются ионы Mn 2+ , которые образуются в процессе титрования. Раствор KMnO4 готовят приблизительно нужной концентрации, а титр устанавливают.
Исходным веществом для установления титра KMnO4 служит Щавелевая кислота (Н2С2О4 *2Н2О)
При титровании протекает следующая реакция:
Перманганатометрию чаще всего применяют для анализа солей Fe(II), Ca 2+ , щавелевой кислоты, Cu(I), H2O2
Другие виды оксидиметрии
v Метод оксидиметрии используется для определения сахара в крови, свободного хлора в воде и активного хлора в хлоридной извести. При анализе фармацевтических препаратов этот метод применяется для определения концентрации свободного йода(количества йодидов и тиосульфата Na)
v Метод броматометрии — применяется для анализа соединений мышьяка, белого стрептоцида и других лекарственных препаратов
v Метод нитрометрии – использую для анализа стрептоцида, сульфадимедина, новокаина и др.
Дата добавления: 2021-06-02 ; просмотров: 233 ; Мы поможем в написании вашей работы!
Источник
Расчеты при титровании



Концентрацию индивидуального лекарственного вещества рассчитывают в процентах. Концентрацию ингредиента в смеси или его содержание рассчитывают в тех единицах, в каких данный ингредиент выписан в прописи.
1. При прямом титровании концентрацию индивидуального лекарственного вещества или ингредиентов смеси в процентах (в жидких лекарственных формах, мазях, порошках) рассчитывают но формуле:
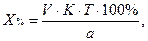
где 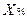
V – объем титрованного раствора, мл;
К – коэффициент поправки на титрованный раствор;
Т – титр по определяемому веществу (титриметрический фактор пересчета);
а – масса (г) или объем (мл) анализируемого лекарственного вещества или масса (объем) лекарственной смеси.
Содержание ингредиентов лекарственной смеси в граммах (в жидких лекарственных формах, порошках, мазях) рассчитывают по формулам:
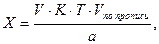
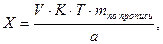
где X – масса определяемого лекарственного вещества, г;
V – объем титрованного раствора, мл;
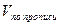
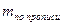
а – объем (мл) или масса (г) лекарственной формы, отобранные для анализа;
К – поправочный коэффициент.
Если при анализе порошка или жидкой лекарственной формы предварительно делали разведение и для титрования использовали часть полученного разведения (А), то концентрацию определяемого вещества в процентах рассчитывают по формуле;
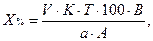
где В – объем мерной колбы, мл;
А – объем разведенного раствора, отобранный для титрования (аликвотная доля), мл. Остальные обозначения – см. формулу (3).
При необходимости выразить содержание анализируемого вещества в граммах в числитель вместо цифры 100 подставляют величину общей массы ( 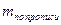
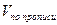
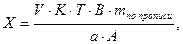
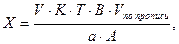
2. При обратном титровании (или титровании по избытку) концентрацию ингредиентов в процентах (в жидких лекарственных формах, мазях, порошках) рассчитывают по формуле;
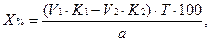
где 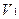
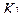
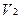
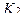
Содержание ингредиентов в граммах (в жидких лекарственных формах, порошках, мазях) рассчитывают по формулам:
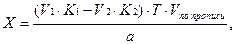
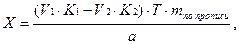
где 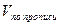
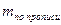
В экспресс-анализе иногда проводят контрольный (холостой) опыт при прямом и обратном способах титрования. Контрольный опыт в случае прямого титрования проводят при:
— алкалиметрическом титровании веществ в мазях (контрольный опыт проводится с мазевой основой, обладающей собственной кислотностью);
— алкалиметрическом титровании с использованием растворителей, обладающих кислотными свойствами (спирт, ацетон);
— комплексонометрическом титровании в малых количествах солей 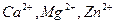
— нитритометрическом определении малых количеств лекарственных веществ 0,02 М раствором натрия нитрита с использованием внутренних индикаторов.
В приведенных примерах концентрацию определяемого вещества в процентах и в граммах вычисляют с учетом контрольного опыта по формулам:
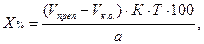
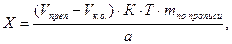
где 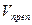
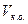

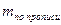
При прямом ацидиметрическом титровании некоторых лекарственных веществ контрольный опыт проводится с целью сравнения перехода окраски индикатора в точке эквивалентности в анализируемом и контрольном растворах. В этом случае количество титрованного раствора, израсходованное на титрование в контрольном опыте, при расчетах не учитывается.
В экспресс-анализе проводить контрольный опыт в случае обратного титрования необходимо при:
— йодометрическом определении некоторых лекарственных веществ;
— броматометрическом определении препаратов группы фенолов;
— при йодхлорметрическом определении метилурацила, этакридина лактата;
— перманганатометрическом определении натрия нитрита.
Концентрацию определяемого вещества в процентах и в граммах вычисляют с учетом контрольного опыта по формулам:
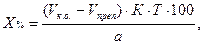
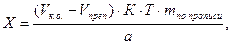
где 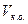
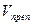
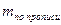
Кроме того, контрольный опыт ставят, если необходимо отфильтровать осадок и титровать избыток раствора в аликвотной части фильтрата. В этом случае расчет ведут по формулам:
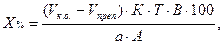
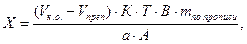
где В – объем мерной колбы, мл;
А – объем фильтрата, взятого на титрование, мл. Остальные обозначения – см. формулы (12) и (13).
3. При косвенном (заместительном) титровании расчет ведут, как при прямом титровании, но титриметрический фактор пересчета определяют не по титруемому заместителю, а по определяемому веществу. Например, при пропускании через катионитную колонку натрия цитрата образуется эквивалентное количество лимонной кислоты, которую титруют стандартным раствором натрия гидроксида. При расчете титр определяют по натрия цитрату, а не по лимонной кислоте.
f = 1/3, Mf (цитрата) = 86 г/моль.
В расчетную формулу титра по определяемому веществу подставляют молярную массу эквивалента натрия цитрата и концентрацию натрия гидроксида.
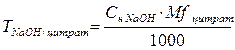
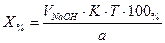
4. При определении по разности лекарственные вещества титруют суммарно общим для них методом, а затем один из компонентов анализируют другим методом, при котором второй компонент не мешает определению. Вычисление по разности включает несколько вариантов в зависимости от типа протекающих реакций.
Если при титровании разными методами М (1/z) анализируемых веществ не меняются, то объем титрованного раствора (V1), пошедший на титрование вещества, определяемого по разности, рассчитывают по алгебраической разности между объемом, затраченным на титрование суммы веществ (Vc), и объемам другого титрованного раствора (V2), израсходованного на титрование второго вещества:
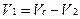
Такой расчет справедлив, если при титровании использовали одинаковые массы (объемы) лекарственной смеси и одинаковые концентрации титрованных растворов.
Соответственно содержание ингредиентов рассчитывают по формуле:
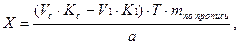
где 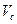
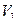
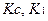
Т – титр по определяемому веществу;
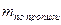
a — точная навеска (г) или объем (мл) лекарственной формы, взятых для анализа.
Например, в лекарственной смеси состава:
Кальция хлорида 0,5
Калия йодида 2,0
Калия бромида 3,0
Воды очищенной до 100,0
Кальция хлорид и калия йодид можно определить каждый раздельно. Для определения калия бромида титруют сумму галогенидов и содержание калия бромида рассчитывают по разности, пользуясь формулой:
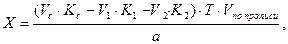
где 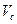
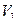
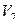
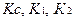
Т – титр по определяемому веществу;
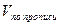
a — точный объем лекарственной формы, взятой для анализа, мл.
Если на определение одного ингредиента и на суммарное определение компонентов смеси взяты разные массы, то для расчета содержания второго ингредиента их необходимо привести к одной массе. Например, анализируется микстура состава:
Кальция хлорида 3,0
Калия бромида 2,0
Воды очищенной до 100,0
На суммарное титрование галогенидов взят объем а1, определение же кальция хлорида проводили в объеме а. Количество калия бромида (Х) вычисляют по формуле:
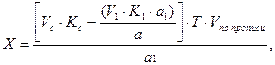
Для суммарного раздельного определения ингредиентов лекарственной смеси часто используют разные методы, при которых молярная масса эквивалентов препаратов различны. Например, анализируется микстура состава:
Натрия гидрокарбоната 2,0
Воды очищенной до 100,0
Гексаметилентетрамин определяют методом йодхлорометрии: Мf = M ∙ 1/4.
Сумму гексаметилентетрамина и натрия гидрокарбоната титруют 0,1 моль/л раствором хлористоводородной кислоты. При титровании кислотой молярная масса эквивалента гексаметилентетрамина равна молекулярной массе. В таких случаях при расчете содержания препарата, определяемого суммарно, необходимо приведение к одному эквиваленту. Так, расчет количества натрия гидрокарбоната в данной смеси проводят по формуле:
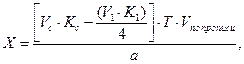
где 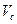
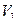
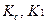
Т – титр по определяемому веществу;
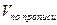
a — точный объем лекарственной формы, взятой для анализа, мл.
Если раздельное и суммарное титрование ингредиентов проводится в разных массах и одновременно при различии молярных масс эквивалентов, то при расчете компонента, определявшегося суммарно, необходимо приведение к одному эквиваленту и к одной массе. В приведенной выше прописи гексаметилентетрамин определяют методом йодхлорометрии в 1 мл микстуры, а суммарное титрование компонентов смеси проводят в 5 мл.
В этом случае содержание натрия гидрокарбоната (Х) рассчитывают по формуле:
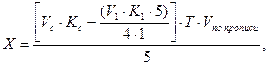
где 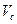
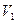
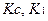
Т – титр по определяемому веществу;
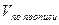
a — точный объем (5 мл) лекарственной формы, взятой для анализа.
5. Реверсионное титрование.
Данный метод предусматривает титрование стандартного раствора (титрованного раствора) анализируемым раствором. Расчет производят общепринятым способом: в знаменатель ставят количество жидкой лекарственной формы, пошедшее на титрование, а в числитель — объем титрованного раствора.
Например, при экспресс-анализе нежелательно определять натрия нитрит фармакопейным методом. Прямое же титрование в кислой среде дает заниженные результаты, так как из натрия нитрита образуется легко разрушающаяся азотистая кислота. В данном случае лучше взять точный объем титрованного раствора калия перманганата (V), прибавить к нему серную кислоту и по каплям титровать анализируемой микстурой (а) до обесцвечивания раствора.
Вопросы для самоконтроля:
1. Какие растворы называются титрованными? Укажите их назначение.
2. Каковы способы выражения концентрации титрованных растворов?
3. Каковы наиболее употребительные концентрации титрованных растворов?
4. Приведите определение молярности, титра, титра по определяемому веществу.
5. Как рассчитывается титр по определяемому веществу? Где используется эта величина? Поясните смысл определения титра по определяемому веществу на конкретных примерах из ФС: натрия хлорида и др. Выведите расчетную формулу для определения массовой доли вещества в граммах, процентах.
6. Что такое контрольный опыт и почему при установке титра проводят контрольный опыт?
7. Назовите два способа определения концентрации титрованного раствора.
8. Выведите расчетную формулу для определения концентрации титрованного раствора по первому способу – по точной массе (навеске) химически чистого вещества, используя данные 5 вопроса.
9. Выведите расчетную формулу для определения концентрации титрованного раствора по второму способу – по титрованному раствору известной концентрации. Какой закон лежит в основе этой формулы?
10. Как вычисляют поправочный коэффициент к молярности (К) для приготовленных титрованных растворов? Каково его назначение?
11. Как поступают в случае отклонения поправочного коэффициента более чем 0,98 – 1,02?
12. Как поступают в случае укрепления титрованного раствора?
13. Как поступают в случае разбавления титрованного раствора?
14. Что такое фактор эквивалентности и молярная масса эквивалента вещества? Как рассчитываются эти величины в реакциях различного типа?
15. Каковы условия хранения титрованных растворов? Напишите уравнения реакции, объясняющие помутнение титрованного раствора натрия тиосульфата при хранении.
16. По какой формуле рассчитывают концентрацию вещества в процентах при прямом способе титрования?
17. По какой формуле рассчитывают концентрацию вещества в процентах при обратном способе титрования?
18. Что такое заместительное титрование, приведите примеры.
Источник