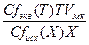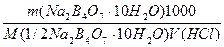Способы установления нормальной концентрации рабочих растворов
Титрованные растворы готовят так же, как и приблизительные растворы, а концентрация их определяется титрованием. Процесс определения концентрации растворов путем титрования называют установкой титра или установкой концентрации растворов.
Установление концентрации растворов можно производить двумя основными методами: методом пипетирования и методом титрования навесок.
При установлении концентрации раствора методом пипетирования этим раствором проводят титрование отмеренного пипеткой определенного объема раствора другого (исходного) вещества, концентрация которого известна. Иногда пипеткой отмеривают определенный объем исследуемого раствора, а титрование проводят раствором исходного вещества.
При использовании метода пипетирования нормальные концентрации исследуемого и исходного растворов должны быть примерно одинаковыми.
Объем пипетки для отмеривания растворов должен быть в 1,5—2 раза меньше объема бюретки. Так, если используют бюретку емкостью 50 мл, то применяют пипетку емкостью 25 мл. При применении бюреток емкостью 25 мл берут пипетки объемом 10 мл или 15 мл. Таким путем достигают наибольшей точности определения концентрации.
На одно титрование нельзя расходовать объем раствора, превышающий объем бюретки, так как это может привести к снижению точности результатов анализа. Чаще всего используют бюретки емкостью 50 мл. В отдельных случаях применяют микробюретки. Бюретки, пипетки и мерные колбы, которыми пользуются при установлении концентрации растворов, должны быть предварительно проверены на точность калибрования. Для бюреток также должен быть установлен объем капли.
Установление концентрации раствора методом титрования навесок заключается в том, что навески исходного вещества, полученные взвешиванием этого вещества на аналитических весах, растворяют в произвольных объемах дистиллированной воды в конических колбах для титрования, и полученные растворы титруют исследуемым (устанавливаемым) раствором.
Метод титрования навесок является более точным, чем метод пипетирования, но требует больше времени.
Масса навески исходного вещества должна быть такой, чтобы на титрование ее был израсходован объем исследуемого раствора, равный 1/2—2/3 объема бюретки, из которой производится титрование. Нужно иметь в виду, что результат определения будет тем точнее, чем больше масса навески при одинаковой абсолютной точности взвешивания, но на титрование не должен быть израсходован объем раствора, превышающий объем бюретки.
Иногда, если в лаборатории производят массовые анализы по определению какого-либо вещества, концентрацию титрованного раствора выражают титром по определяемому веществу, который показывает количество определяемого вещества в граммах, эквивалентное 1 мл раствора, применяемого для титрования.
Титр рабочего раствора по определяемому веществу может быть рассчитан по формуле (г/мл):
где Tр.р — нормальная концентрация рабочего раствора;
Эо.в — эквивалент определяемого вещества.
После точного установления концентрации раствора ее выписывают на этикетку, наклеенную на склянке с раствором, с указанием даты установления концентрации.
На склянках с титрованными растворами следует иметь наклеенные этикетки из плотной бумаги, на которых тушью пишут название раствора и размерность концентрации, а простым карандашом записывают величину концентрации и дату ее установления или проверки. Для точных растворов величина концентрации должна быть выражена с точностью до четырех значащих цифр. Например, нормальную концентрацию титрованных или стандартных растворов выражают: 0,1000 н.; 0,09123 н.; 0,5030 н. Концентрацию приблизительных растворов выражают обычно двумя значащими цифрами, например: 0,10 н.; 0,50%; 25 г/л.
Титрованные растворы при стоянии могут изменять концентрацию, поэтому ее необходимо периодически проверять. Для растворов щелочей, окислителей и восстановителей проверка концентрации производится не реже одного раза в три месяца. Для особо ответственных анализов проверка концентрации проводится чаще, обычно перед каждой новой серией анализов.
Источник
Способы выражения концентрации рабочего раствора



Рабочий раствор – раствор вещества, вступающего в реакцию с определяемым веществом, имеющий точно известную концентрацию.
Рабочее вещество – вещество, из которого приготовлен рабочий раствор.
Титр по рабочему веществу (Тр.в.), или просто титр, — количество граммов рабочего вещества, содержащегося в 1 мл рабочего раствора.
Титр по определяемому веществу (Тр.в./о.в.) — количество граммов определяемого вещества, эквивалентное количеству рабочего вещества, содержащегося в 1 мл рабочего раствора, т.е. оттитровываемое одним миллилитром его.
Нормальность – количество грамм-эквивалентов рабочего вещества, содержащееся в 1 л (или миллиграмм-эквивалентов в 1 мл) данного рабочего раствора.
Поправочный коэффициент (К), или поправка, — число, показывающее, во сколько раз нормальность данного рабочего раствора больше одной из следующих точных концентраций: 0,1; 0,2; 0,5; 0,01; 0,02; 0,05; …н., или какую часть от них она составляет.
При изучении тем «Окислительно-восстановительное титрование», «Комплексонометрическое титрование», «Кислотно-основное титрование» необходимо усвоить сущность методов данного вида титрования, запомнить рабочие растворы и установочные вещества, индикаторы метода и изучить практическое применение метода.
Пример 1. Рассчитать массу навески Na2B4О7·10Н2О, необходимой для приготовления раствора в мерной колбе емкостью 200 мл, который будет использован для стандартизации ранее приготовленного
0,1 М раствора HCl.
Решение:
В случае приготовления раствора разбавлением
Таким образом, для приготовления раствора в объеме VMKмерной колбы необходимо взять следующий объем, мл, исходного раствора, концентрацию которого хотят определить:
Vисх =
Пример 2. Рассчитать объем раствора трилона Б с концентрацией
0,1М, необходимый для приготовления раствора в мерной колбе емкостью 250,0 мл, если его стандартизация будет проводиться по 0,02516М раствору сульфата магния.
Решение.
VNa 
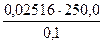
Пример 3. Рассчитать молярную и нормальную концентрации, а также титр, титр по соляной кислоте и поправочный коэффициент раствора буры, приготовленного:
а) растворением навески Na2B4О7·10Н2О массой 4,8950 г в мерной колбе емкостью 250,0 мл:
С (Na2B4О7·10Н2О) = 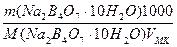
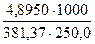
С(1/2Na2B4О7·10Н2О) = 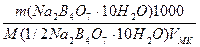
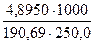
Т (Na2B4О7·10Н2О) = 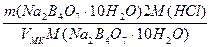
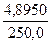
T(Na2B4О7·10H2O/HCl) = 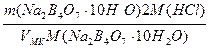
= 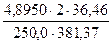
б) разбавлением 50 мл 0,55М раствора Na2B4О7·10H2O в мерной колбе емкостью 250,0 мл:
С (Na2B4О7·10Н2О) = 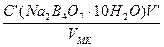
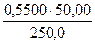
С(1/2Na2B4О7·10Н2О) = 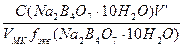
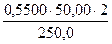
в) растворением стандарт-титра (фиксанала), содержащего 0,1 мольэквивалента в мерной колбе емкостью 500,0 мл:
С(Na2B4О7·10Н2О) = 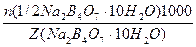
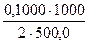
С(1/2Na2B4О7·10Н2О) = 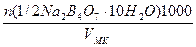
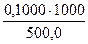
= 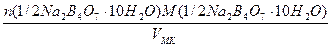
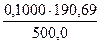
= 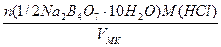
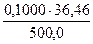
Пример 4. На титрование навесок декагидрата тетрабората натрия массой0,2106; 0,3313 и 0,1863 г было затрачено соответственно 10,55; 16,58 и 9,36 мл приготовленного раствора хлороводородной кислоты. Чему равна молярная концентрация раствора кислоты?
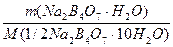
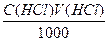
С(HCl) =
Подставляя значение масс и объемов, получаем значения концентраций, по которым вычисляем молярную концентрацию раствора кислоты:
С1 = 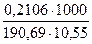
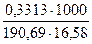
С3 = 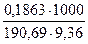
C(HCl)cp = (0,1047 + 0,1048 + 0,1044)/3 = 0,1046М.
Пример 5. На титрование трех объемов раствора гидроксида натрия с концентрацией 0,1053М, отобранных пипеткой емкостью 10,01 мл, затрачено соответственно 12,58; 12,52 и 12,63 мл стандартизируемого раствора хлорной кислоты. Чему равны молярная концентрация и титр раствора кислоты?
Находим среднее значение объема затраченного раствора кислоты и рассчитываем по нему ее молярную концентрацию:
V(HClO4) = (12,58 +12,52 + 12,63)/3 = 12,55 мл,
С(НСlO4) = (12,55·0,1053)/10,01 = 0,1323М,
T(HClO4) = 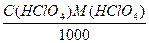
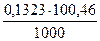
Вопросы для самоконтроля:
1. Дайте определение терминов «титрование», «титрант», «титруемое вещество», «индикатор», «точка эквивалентности», «конечная точка».
2. Объясните, в чем заключается сущность титриметрического метода анализа с визуальным фиксированием конечной точки титрования.
3. Изложите требования, которые должны удовлетворять реакциям, лежащим в основе титриметрического определения. Дайте объяснения необходимости выполнения каждого требования к реакциям титрования.

4. Объясните, что такое титрант, и каким требованиям он должен удовлетворять.
5. Изложите способы, которыми можно приготовить стандартные растворы и сущность каждого из них.
6. Дайте определение понятия «индикатор» и укажите основные характеристики индикаторов.
7. Объясните, что такое интервал перехода и показатель титрования индикатора, и укажите, какова связь между этими характеристиками.
8. Объясните в чем заключается сущность метода кислотно-основного титрования.
9. Назовите кислотно-основные индикаторы.
10. Опишите ход приготовления стандартных растворов кислот и щелочей.
11. Перечислите установочные вещества метода кислотно-основного титрования.
12. Изложите сущность метода комплексонометрии.
13. Назовите способы обнаружения конечной точки титрования в методе комплексонометрического титрования.
14. Перечислите требования, которым должны соответствовать металлохромные индикаторы.
15. Назовите важнейшие комплексоны, применяемые в комплексонометрическом титровании.
16. Укажите характерные особенности комплексов ЭДТА с металлами.
17. Изложите сущность методов окислительно-восстановительного титрования.
18. Изложите сущность определения восстановителей и окислителей методом иодометрии.
19. Определите случаи использования методов прямого и косвенного титрования.
20. Охарактеризуйте стандартные растворы, установочные вещества и индикаторы метода иодометрии.
Источник