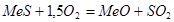Лекция 12. Механизм и кинетика окисления сульфидов
Окисление сульфидов кислородом воздуха – необратимая экзотермическая реакция:
Термодинамически процесс сдвинут в сторону окисления для большинства сульфидов. Однако, при низких температурах реакция окисления не протекает. При нагревании сульфида скорость окисления увеличивается и с достижением определенной температуры скорость реакции становится настолько большой, что выделяющегося тепла достаточно не только для восполнения потерь тепла в окружающую среду, но и для повышения температуры окисляющегося сульфида, что еще больше ускоряет реакцию окисления. Та температура, при достижении которой процесс окисления может протекать самопроизвольно без подвода тепла извне, называется температурой воспламенения сульфида. Эта температура зависит от рода сульфида и размеров его зерен, причем у высших сульфидов с большей упругостью диссоциации она ниже, чем у низших сульфидов с малой упругостью диссоциации.
Скорость окисления сульфида в зависимости от температуры может лимитироваться или кинетическими или диффузионными факторами. При низких температурах скорость окисления лимитируется кинетическими факторами, т.е. скоростью самого химического акта, при высоких температурах скорость окисления лимитируется диффузией кислорода воздуха через корку твердых продуктов реакции, покрывающую еще неизменившийся сульфид в центральном участке зерна. Реакция течет на границе раздела двух фаз – сульфида металла и твердого продукта реакции – окисла металла, через слой которого внутрь диффундирует кислород, а навстречу ему сернистый газ. По мере окисления сульфида скорость продвижения фронта реакции замедляется, так как условия подвода кислорода и отвода сернистого газа через постепенно утолщающуюся корку окислов ухудшаются. Время, необходимое для полного окисления зерна сульфида, возрастает с увеличением размера зерна.
Повышение температуры сверх определенного предела во многих случаях понижает скорость окисления, если при повышении температуры происходит уплотнение спекания корки окислов, затрудняющее диффузию. При окислении сульфида железа повышение температуры выше 900 ºС замедляет окисление, так как выше 900 ºС происходит значительно уплотнение корки окислов железа.
Диффузионные стадии включают внешнюю и внутреннюю диффузию окислителя из газового потока к поверхности реакции и газообразных продуктов реакции в обратном направлении.
Кристаллохимические стадии процесса окисления включают все стадии, характерные для реакций автокаталитического типа:– стадию зарождения новой фазы – наиболее медленную стадию; автокаталитическую стадию, когда скорость процесса возрастает по мере развития фронта реакции; и стадию усреднённого фронта, когда скорость реакции уменьшается в связи с сокращением фронта реакции. Каталитическое воздействие поверхности раздела фаз на скорость реакции окисления может быть объяснено ускорением процесса хемосорбции кислорода поверхностью сульфида. Это подтверждается тем, что при применении в качестве окислителя атомарного кислорода (озона, пиролюзита – MnO2) окисление сульфида протекает с большей скоростью, чем окисление кислородом. Под действием селитры – NaNO3 окисление происходит со взрывом. Известно, что при разложении MnO2 и NaNO3 образуется атомарный кислород, так что стадия атомизации кислорода при окислении твёрдыми окислителями и озоном отсутствует. Это позволяет предположить, что атомизация кислорода является одной из тормозящих процесс стадий.
Автогенные процессы.Автогенными называют процессы, которые осуществляются полностью за счет внутренних энергетических ресурсов без затрат посторонних источников тепловой энергии — углеродистого топлива или электрического тока. При переработке сульфидного сырья, обладающего достаточно высокой теплотворной способностью, автогенность плавки осуществляется за счет теплоты экзотермических реакций 2FeS + ЗО2 + SiO2 = 2FeO-SiO2 + 2SO2 — 1030290 кДж.
Окисления сульфидов цветных металлов (ZnS, PbS) протекает с выделением тепла. Возможно также получение теплоты от переокисления оксида Fe(II) до магнетита:
Сульфидные концентраты цветных металлов можно рассматривать как низкокалорийное топливо. При сжигании 1 кг свинцового концентрата выделяется 25 кДж теплоты, а при сжигании 1 кг условного топлива 33 кДж.
Преимущества автогенного процесса по сравнению с отражательной плавкой медных концентратов значительные. При отражательной плавке на плавление затрачивается 20 % углеродистого топлива от массы шихты, а десульфуризация составляет всего 5 -30 %. Отходящие газы, получающиеся в отражательной печи при сжигании углеродсодержащего топлива, разбавляет отходящие газы настолько, что концентрация SO2 в них снижается до 0,5—1,5%. Переработка таких газов экономически невыгодна. Поэтому пока еще во всем мире такие газы выбрасываются в атмосферу. Это наносит ущерб и экономике, и экологии.
Сущность всех процессов автогенной плавки сульфидных материалов — сжигание сульфидов железа и цветных металлов и окисление FeO до Fe3O4.
Существуют три основных способа осуществления автогенных плавок.
Плавка во взвешенном состоянии. Высушенный до содержания влаги 0,5—1,0 % флотационный концентрат вдувается в печь. Процессы горения сульфидов в факеле завершаются за десятые доли секунды. Образовавшиеся в факеле капли сульфидно-оксидного расплава падают на поверхность расплава шлака, где продолжаются дальнейшие физико-химические взаимодействия.
В настоящее время в мире работают около 40 печей финской фирмы «Оутокумпу», осуществляющих такой процесс (рисунок 11). Печь имеет плавильную камеру, отстойную зону и аптейк с котлом-утилизатором.
В процессе сжигания сульфидов во взвешенном состоянии каждая частица сульфидного концентрата размером несколько микрон подвергается интенсивному окислению кислородом дутья. При этом происходит переокисление оксидов Fe(II) до магнетита. Это приводит к обогащению шлака медью. Выходящие из печей шлаки содержат от 0,8 до 1,5 % Си и нуждаются в дальнейшем обеднении.
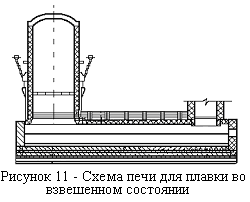
В Казахстане был создан новый оригинальный агрегат, названный КиВЦЭТом (рисунок 12). Плавят материал в факеле печи на кислородном дутье. Доработку шлаков проводят в электроотстойнике. Содержание меди в выпускаемых шлаках находится на уровне отвальных шлаков (0,5—0,6 %).
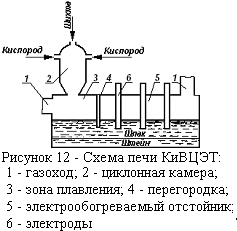
Особое место среди автогенных процессов занимает плавка в жидкой ванне — процесс Ванюкова (ПВ). Этот процесс внедрен на Норильском и Балхашском горно-металлургических комбинатах. Принцип плавки в том, что перерабатываемое сырье непрерывно загружается на поверхность барботируемого окислительным газом расплава, где осуществляются химические превращения и генерируется тепло. Полученные расплавы (шлак, штейн или черновой металл) расслаиваются в подфурменной зоне и раздельно непрерывно выпускаются из печи через сифоны. Шлак, отделенный от штейна, может подергаться перед выпуском обеднению в восстановительной зоне, для чего печь разделена поперечной водоохлаждаемой перегородкой.
Удельная производительность печей может достигать 80 т/м 2 ·сут. за счет интенсивного перемешивания расплавов, позволяющего снимать диффузионные затруднения при растворении тугоплавких компонентов шихты.
Содержание магнетита в шлаке 4—6 %.
В печах ПВ плавка осуществляется в шлаково-штейновой эмульсии. В печи можно выделить характерные области, отличающиеся физико-химическими условиями. Первая — зона факела, создаваемая за счет кислородсодержащего дутья, подаваемого через боковые фурмы. В этой зоне в газовой фазе присутствует свободный кислород. Объем окислительной зоны
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Студалл.Орг (0.006 сек.)
Источник
Лекция 6, 7. Кинетика и механизм глубокого окисления сульфидов железа, цинка и меди при высоких температурах.
1. Окисление сульфидов металлов
2. Поведение железа в зоне окисления
3. Зона окисления никель-кобальтовых месторождений.
4.Зона окисления молибденовых и медных месторождений.
5. Зона окисления оловорудных и ртутных месторождений.
В общем виде окисление сульфидов кислородом газовой фазы может быть выражено следующими основными уравнениями:
О конечном результате окисления сульфидов можно судить по убыли энергии Гиббса реакций.
Сульфиды металлов могут окисляться в зависимости от температуры по различным схемам: при низких температурах – до сульфатов, при температурах обжига (700–800 О С) – до оксидов. При более высоких температурах окисление сульфидов может приводить также к образованию металла.
Термическая нестойкость сложных сульфидов приводит к тому, что в условиях окислительной атмосферы процессы окисления сводятся в основном к окислению простых сульфидов в соответствии с реакцией (1).
Оценка вероятности и преимущественно окисления тех или иных сульфидов может быть сделана на основе данных термодинамического анализа реакций окисления.
В ходе плавки устанавливается следующий порядок окисления сульфидов: сначала будут окисляться сульфиды железа, цинка и кобальта, а затем сульфиды свинца, никеля и меди. Такой порядок окисления справедлив для отдельных сульфидов и в основном сохраняется как при окислении твердых, так и расплавленных сульфидов.
Указанный порядок окисления сохраняется и при совместном окислении, хотя это не исключает полного окисления сульфидов всех металлов. Для развития зоны окисления сульфидных и других эндогенных месторождений имеют значение климат, геоморфологические условия, состав руд и свойства вмещающих пород. Наиболее интенсивно сульфидные руды окисляются в условиях влажного тропического климата, менее интенсивно – в умеренном климате, очень слабо – в сухих пустынных и высокогорных полярных областях. В условиях сглаженного рельефа окисление происходит интенсивнее, чем при резком расчлененном рельефе. Состав руд и боковых пород, их проницаемость для поверхностных вод, структура месторождений и условия залегания рудных тел – важные факторы развития зоны окисления. Трещиноватые и пористые руды окисляются более интенсивно. Наличие в окисляющихся рудах пирита приводит к образованию серной кислоты, которая способствует разрушению других сульфидов. Расположение рудных тел в зонах контактов различных пород облегчает развитие процессов окисления; наоборот, залегание рудного тела под водонепроницаемыми породами, препятствующими доступу вод к рудному телу, может затруднить развитие зоны окисления.
Основные агенты окисления рудных месторождений – поверхностная вода, кислород, углекислота, серная кислота. При этом главное действие на руду оказывает не столько сама вода, сколько растворенные в ней свободный кислород и кислоты.
Вследствие просачивания поверхностных вод, изменения их химического состава и постепенного развития процессов окисления и выщелачивания строение зоны окисления на всю ее глубину оказывается неоднородным. В области циркуляции поверхностных вод выделяются три зоны: просачивания, активного водообмена и застойных вод. Зоне просачивания соответствует измененная часть рудных тел, зоне застойных вод – неизмененная часть рудных тел, в зоне водообмена в телах неизмененных полезных ископаемых обычно встречаются измененные участки, а также скопления вторичною переотложенною материала (см. рис. 1).
В зоне окисления выделяются четыре подзоны: поверхностный слой, подзона окисленных руд, подзона окисленных выщелоченных руд и подзона богатых окисленных руд. Нижняя граница зоны окисления обычно неровная и часто не совпадает с уровнем грунтовых вод в связи с его колебаниями. В зоне окисления вес сульфиды неустойчивы и превращаются в сульфаты. При этом растворимые сульфаты выносятся. Ниже зоны окисления образуется зона вторичного обогащения или цементации.
Рис. 1. Схема соотношения измененной части рудного тела и зон циркуляции приповерхностных вод среди пород равной проницаемости (разрез поперек речной долины).
Гидродинамические зоны: 1 – просачивания (аэрации). 2 – водообмена, 3 – застойных вод.
Рудные зоны: А окисления, Б – вторичного обогащения, В – первичных руд. Подзоны: а – окисленных руд. б – выщелоченных руд, в – богатых окисленных руд.
Некоторые металлы (медь, серебро, уран) выносятся из зоны окисления руд и переотлагаются в зоне цементации. Формирование этой зоны связано с недостатком в ней кислорода, в связи, с чем создаются восстановительные условия и из сульфатных растворов при отсутствии свободного кислорода выпадают такие минералы, как халькозин, ковеллин. аргентит, регенерированные урановые черни и другие. Образующиеся вторичные сульфиды и другие минералы обогащают данную зону и как бы «цементируют» первичные образования. Поэтому эта зона и называется зоной цементации. Глубина распространения зоны вторичного обобщения значительна и на некоторых месторождениях достигает 400 500 м от поверхности. Зона вторичного обогащения имеет важное промышленное значение на штокверковых медно-порфировых месторождениях.
Зона окисления сульфидных залежей развивается постепенно, в несколько стадий. В начальной стадии первичные минералы только начинают изменяться. Новообразований бывает – мало и они представлены главным образом сульфатами, частично оксидами и гидроксидами. На средней стадии окисления вторичные минералы преобладают над первичными, но в рудах сохраняются наиболее устойчивые сульфиды.
В окисленном материале преобладают оксиды, карбонаты, силикаты. На конечной стадии все сульфиды (кроме киновари) исчезают, а количество сульфатов становится незначительным. Весь материал зоны окисления сложен конечными продуктами разложения.
В окисленных рудах возникают псевдоморфные текстуры (массивные, пятнистые, полосчатые, вкрапленные, прожилковые), каркасные (ящичные, губчатые), остаточные (землистые, шлаковидные, брекчиевые), переотложенные (колломорфные, корковые, полосчатые, натечные, рыхлые). В поверхностной зоне над сульфидными залежами возникают отрицательные формы рельефа. Детальное изучение окисленных руд (остаточных первичных минералов, каркасных текстур и др.) необходимо для оценки оруденения, скрытого на глубине.
Поведение железа в зоне окисления. В сульфидных рудах основными минералами железа являются пирит, марказит, пирротин. Окисление пирита и марказита происходит по следующей схеме:
В дальнейшем сульфат Fe 3+ в слабокислых или нейтральных растворах гидролизуется, переходит в гидроксид железа в виде гелей и дает начало образованию гидроксидов железа:
В. В. Щербина приводит для железа такую последовательность минеральных превращений:
пирит → мелантерит → фибросферрит → ярозит → лимонит (2 Fe 2 О3 × 3 H 2 O ).
В результате окисления верхние части колчеданных залежей превращаются в железные шляпы.
Образующийся при окислении пирита сульфат Fe 3+ в свою очередь оказывает воздействие на пирит, что приводит к выделению серы:
За счет окисления серы образуется серная кислота или SO2. Пирротин является наиболее легко разлагаемым сульфидом FeS + 2 O 2 = FeSO 4 плюс небольшое количество свободной серной кислоты. Закисный сульфат железа FeSO4 в дальнейшем претерпевает изменение до Fe2(SO4)3, а последний, гидролизуясь, дает гидроксид железа и серную кислоту, т. е. процесс протекает аналогично окислению пирита.
В некоторых условиях пирротин подвергается дисульфидизации, т. е. замещается мельниковитом, марказитом, реже пиритом. Этот процесс происходит в том случае, когда при окислении пирротина образуется достаточное количество H2S.
Окисление халькопирита и борнита протекает аналогично пириту.
При окислении арсенопирита образуется скородит:
Карбонаты железа в зоне окисления легко разрушаются. Окисление сидерита происходит по следующей реакции:
В результате окисления сидеритовых рудных залежей образуются настоящие железные шляпы.
Гематит в зоне окисления, как правило, устойчив. Но при наличии в рудах обильного окисляющегося пирита гематит может превращаться в гидроксиды железа.
Магнетит также устойчив в зоне окисления. Однако нередко наблюдается его мартитизация (замещение гематитом), а при наличии пирита он превращается в гидроксиды.
Таким образом, превращение минералов железа в зоне окисления можно представить в следующем виде: железосодержащий сульфид (или другой минерал) → FeSO 4 → Fe 2 ( SO 4 )3 → Fe ( OH )3 → лимонит.
Сульфаты железа легко растворимы в воде и выносятся из зоны окисления. Часть железа может мигрировать также в виде гидрозоля Fe(OH)3. При определенных условиях может осуществляться почти полный вынос железа из зоны окисления. Однако очень часто железо в значительных количествах сохраняется в зоне окисления в виде гидроксидов, ярозита, скородита и других минералов.
Зона окисления никель-кобальтовых месторождений. Наиболее распространенными первичными минералами никеля и кобальта являются сульфиды (пентландит (Ni, Fe)9S8, миллерит NiS, линнеит Со3S4, карролит Cu(Co,Ni)2S4 и др.), сульфоарсениды (кобальтин CoAsS, гла-укодот (Со, Fe)AsS, герсдорфит NiAsS) и арсениды (никелин NiAs, шмальтин (Со, Ni)As3-2, хлоантит (Ni. Co)As3-2, саффлорит (Co. Fe)As2, раммельсбергит NiAs2 и др.).
Вес перечисленные минералы в зоне гипергенеза неустойчивы и разрушаются. При окислении судьфидов образуются сульфаты (NiSO, CoSO, FeSO, CuSO), которые хорошо растворимы, что в определенных условиях может привести к полному выносу металлов при сохранеии лишь небольших количеств гидроксидов железа. Однако следует заметить, что зона окисления месторождения кобальтоносных медистых песчаников Центральной Африки богата сферокобальтитом СоСО3 и асболаном k МпО * МпО2 m СоО п H2О, которые имеют промышленное значение.
Более сложным является окисление сульфоарсенидных и арсенидных руд никеля и кобальта. В результате окисления возникают разнообразные вторичные минералы. Наиболее распространенными являются арсенаты никеля (аннабергит Ni3(AsO4)2 8H2O) и кобальта эритрин Со3(AsO4)2*8Н2O). Минералогия окисленных Ni-Co-арсенидных руд детально изучена на месторождении Хову-Аксы (Тува), где установлена следующая последовательность образования гипергенных минералов: сульфаты → арсенаты → карбонаты → гидроксицы. Главными минералами, в которых фиксируется кобальт, являются эритрин, гетерогенит 2СоО3 n Н2О и асболан. Реже встречаются сферокобальтит, биберит CoSO4 * 7Н2O, розелит Ca2Co[AsO4]2 * 2Н2О.
Таким образом, при окислений сульфидных руд никель и кобальт могут мигрировать и рассеиваться, а при окислении арсенидных руд они остаются в зоне окисления преимущественно в виде арсенатов и некоторых других минералов.
Зона окисления молибденовых месторождений. Главный промышленный минерал – молибденит – в зоне окисления разлагается и замещается молибдитом и повеллитом. Молибдит образуется при разложении молибденита в кислой среде, в результате взаимодействия появляющихся при этом сульфатов железа и молибдена:
В условиях карбонатной среды вместо молибдита образуется повеллит:
Если в окисляющихся рудах содержится свинец, то может образоваться вульфенит:
Таким образом, при окислении молибденитовых руд молибден фиксируется во вторичных минералах. Однако описаны случаи выщелачивания и миграции молибдена из зоны окисления, которые возможны в условиях кислой среды, при отсутствии осадителей (карбонатных пород и вод), при длительном развитии процессов окисления. Такие условия имеют место в Центральном Казахстане.
Зона окисления вольфрамовых месторождений. Промышленные минералы – вольфрамит (Fe, Mn)W04, гюбнерит (Мп. Fe)WO4, фербериг FeWO4 и шеелит CaWO4. Все перечисленные минералы в зоне типергенеза устойчивы, перемещаются механическим путем и могут накапливаться в россыпях. Лишь при длительном окислении эти минералы разрушаются и покрываются коричневато-желтыми налетами тунгстита WO, × n H2O и ферритунгстита Fc2O3WO36H2O.
Зона окисления медных месторождений. Первичные сульфиды меди, обычно сопровождающиеся сульфидами железа, в зоне окисления неустойчивы, разлагаются, и возникает хорошо выраженная зола окисленных руд, особенно на медно – колчеданных и штокверковых месторождениях. Окисление халькопирита происходит по следующей схеме:
После образования сульфата окиси железа процесс окисления халькопирита ускоряется, причем часто образуется и самородная сера:
Иногда окисление халькопирита протекает с образованием серной кислоты и сернистого ангидрида.
Сульфат меди хорошо растворим в воде, и медь мигрирует из зоны окисления. Однако при взаимодействии сульфата меди с жильными минералами руд и вмещающими породами образуются малахит, азурит, хризоколла и многие другие гипергенные минералы зоны окисления. И все же значительная часть меди выносится в зону водообмена, где из раствора выпадают вторичные сульфиды (халькозин, ковеллин, борнит) и возникает зона вторичного обогащения. Образование вторичных сульфидов в зоне цементации происходит по схеме:
Таким образом, в верхних частях меднорудных залежей возникает классическая вертикальная зональность. У поверхности располагается подзона окисленных руд. Ниже находится подзона выщелоченных руд, еще ниже – зона вторичного сульфидного обогащения, а затем первичные руды.
Зона вторичного обогащения особенно ценная в промышленном отношении оказывается на штокверковых медно-порфировых месторождениях (см. рис. 2). Содержание меди в рудах зоны вторичного обогащения в 2 – 3 раза (и более) выше, чем в бедной прожилково-вкрапленной первичной руде. Глубина распространения руд зоны обогащения на месторождениях этого типа достигает 400 – 450м и более.
Хорошо проявлена зона вторичного сульфидного обогащения и на медноколчеданных месторождениях. Так, на месторождениях Урала верхняя часть зоны окисления выражена гидроксидами железа (железная шляпа). Ниже следует подзона ярозита, затем подзона выщелачивания (баритовая и пиритовая сыпучка) небольшой мощности, под которой располагается зона вторичного сульфидного обогащения, а еще ниже первичные сульфидные руды. В зоне гиперкинеза медь обладает высокой миграционной способностью, образуются хорошо выраженные зоны окисления и вторичного сульфидного обогащения.
Рис. 2. Геологический разрез месторождения Коунрад:
1 – окисленные и выщелоченные руды; 2 – промышленные руды зоны вторичного сульфидного обогащения; 3 – непромышленные первичные (гидротермальные) руды
Зона окисления свинцово-цинковых месторождений. Основным минералом свинца является галенит PbS . В рудах часто, но в небольших количествах встречаются сульфосоли свинца. Главным минералом цинка является сфалерит ZnS. Оба указанных минерала в зоне гппергенеза неустойчивы и достаточно легко окисляются. При окислении галенита образуется англезит ( PbS + O 2 = PbSO 4 ), который обладает весьма малой растворимостью. Но в условиях карбонатной среды англезит неустойчив и замещается церусситом:
Общая цепь изменения сводится к следующему: галенит → англезит → церуссит. Церуссит весьма устойчив и дает значительные скопления. Он может замещаться также пироморфитом Р b 5 С1[Р04]3, ванадинитом Р b5С1[V04]3 и другими минералами. Кроме того, в зоне окисления свинцовых месторождений встречаются плюмбоярозит PbFe 6,(OH )12[SO4]4, вульфенит Рb МоО4,. миметезит PbCl[AsO4]3, бедантит PbFe 3 ( OH )6[ SO4][ AsO4] и другие гипергенные минералы.
Таким образом, свинец в зоне окисления является малоподвижным элементом. Однако при наличии кислых растворов, характерных для начальных и средних стадий окисления колчеданно-полиметаллических руд, свинец может мигрировать и переотлагаться в виде церуссита и плюмбоярозита.
Окисление сфалерита происходит по схеме:
Сульфат цинка обладает большой растворимостью и, в отличие or англезита, легко выносится. Высокая миграционная способность цинка приводит к его выносу из зоны окисления и рассеиванию, что резко отличает цинк от свинца, с которым он теснейшим образом связан в зоне первичных сульфидных руд. Особенно интенсивно выносится цинк из силикатной среды. В условиях же карбонатной среды сульфат цинка взаимодействует с карбонатами и образуется смитсонит:
Скопления смитсонита часто образуются вне контуров первичною рудною тела, нередко в лежачем боку (рис. 44). Кроме смитсонита в зоне окисления полиметаллических руд образуются каламин.
Рис. 3. Разрез, иллюстрирующий соотношение окисленных свинцовых и цинковых руд месторождения Турлан (Южный Казахстан):
1 – известняк; 2 – брекчия оседания; 3 – окисленные свинцовые рулы; 4 – окисленные цинковые рулы
Зона окисления оловорудных месторождений. Главным промышленным минералом олова является касситерит SnO2. Меньшее значение имеет станнин Cu2FeSnS4 и совсем небольшое другие сульфостаннаты: тиллит PbSnS2, франкеит Pb5Sn3Sb2S11, цилиндрит Pb3Sn4Sb2S14 и др. В зоне гипергенеза касситерит – один из самых устойчивых минералов, накапливается в россыпях, которые являются главным источником получения олова в зарубежных странах.
Сульфостаннаты в зоне окисления неустойчивы. Процесс окисления станнина можно представить в такой схеме:
Образующаяся при этом метаоловянная кислота дает коллоидный раствор, быстро коагулирующий. Возникающий гель Н28п0з при последующей дегидратации дает супергенный касситерит.
В касситерит-сульфидных рудах Н. К. Маршуковой и А. Б. Павловским выявлены и описаны такие гипергенные минералы олова, как гидростаннаты с формулой MeSn(OH)6, где Me может быть представлен двухвалентным железом, цинком, кальцием, медью и минералами группы варламовитов с широкими вариациями в их составе железа, олова и воды. Указанные гипергенные минералы олова развиваются непосредственно по станцину, что свидетельствует о слабой миграции олова в гипергенном процессе.
Зона окисления сурьмяных месторождений
Главный минерал сурьмы – антимонит, который в поверхностных условиях окисляется с образованием сульфата сурьмы: Sb2 S3 +6 O 2 = Sb 2 (SO4)3. Сульфат сурьмы весьма неустойчив и гидролизуется с образованием оксидов сурьмы сервантита Sb2O4, стибиоконита Sb2O4*H2O и в меньшей мере – валентинита Sb 2 O 4, кермезита Sb 2 S 2 O и других, дающих нередко тонкие смеси, псевдоморфно замещающие антимонит.
При окислении буланжерита Pb5Sb4S11 и тетраэдрита Cu3SbS3 образуются вторичные минералы свинца, меди и оксиды сурьмы первичные сульфидные руды.
Таким образом, в зоне гипергенеза сурьма является почти не мигрирующим элементом, так как образующиеся при окислении антимонита и других минералов вторичные оксиды и гидроксиды сурьмы обладают ничтожной растворимостью.
Зона окисления ртутных месторождений
Гланый минерал ртути – киноварь HgS – устойчив в условиях зоны окисления, перемещается механическим путем и встречается в шлихах на значительном удалении от коренных источников. При длительном окислении киноварь слабо растворяется с образованием сульфата HgS04 или хлорида HgCl2. которые неустойчивы и быстро восстанавливаются с образованием самородной ртути. Реже в зоне окисления ртутных месторождений появляется каломель HgCl и кубическая модификация киновари – метациннабарит.
Таким образом, миграция ртути в зоне гипергенеза осуществляется в основном механическим путем в виде киновари.
Поведение золота в зоне окисления золото-сульфидных месторождений. Золото в первичных рудах является самородным видимым, субмикроскопическим (невидимым), рассеянным в сульфидах, а также представлено теллуридами. В зоне гипергенеза самородное видимое золото является химически стойким, перемещается механическим путем и накапливается в россыпях. Теллуриды золота легко разлагаются, причем золото выпадает в виде тонкодисперсного коричневого порошка. Субмикроскопическое золото, освобождающееся из разлагающихся сульфидов, может растворяться (коллоидные или истинные растворы золота в виде хлоридов и сульфатов) и мигрировать как в зоне окисления, так и за ее пределы. Изучение золоторудных месторождений Урала и других районов, проведенное М. И. Альбовым, показало наличие в этих месторождениях вторичной зональности в распределении золота по вертикали. В кварц-сульфидных жилах на Урале установлен пояс вторичного золотого обогащения на глубине 20 – 150 м от поверхности. Образование этого пояса М. Н. Альбов объясняет переносом тонкодисперсного золота вниз по трещинкам рудных жил нисходящими водами.
В. М. Крейтером, В. В. Аристовым, И. С. Волынским и другими изучено поведение золота в зоне окисления медноколчеданных месторождений Урала и Центрального Казахстана.
Распределение золота в зоне окисления Майкаинского золотоколчеданно-полимсталлического месторождения представлено на рис. 4.
Высокие содержания золота в окисленных рудах возникли в связи с его растворением, миграцией в сульфатной форме и персотложением в самородном виде. Наличие самородного гипергенного золота в буром железняке, ярозите и в сыпучке подтверждается детальным микроскопическим изучением окисленных руд.
Рис. 4. Содержание золота и серебра
(в усл. сд.) в зоне окисления месторождения Майкаин (Казахстан):
1 – глины; 2 – бурые железняки; 3 – ярозиты; 4 – кварц-баритовая сыпучка с ярозитом; 5 – кварц-баритовая сыпучка с серой; 6 колчеданная сыпучка; 7 – первичные колчеданные руды
Поведение серебра в зоне окисления сульфидных месторождений. Среди гипогенных минералов серебра наиболее распространенными являются серебро самородное, аргентит Ag2S, прустит Ag3AsS3, пираргирит Ag3SbS3, теллуриды.
В зоне гипергенеза самородное серебро химически устойчиво и переносится механическим путем в россыпи. Аргентит и другие сернистые соединения серебра разлагаются с образованием Ag2S04. Этот сульфат растворим в воде и серебро мигрирует. В результате реакции Ag 2 SO4 + 2 FeSO4= = 2A g + Fe2(SO4)3, в зоне окисления образуется серебро самородное. Кроме того, в окисленных рудах часто встречаются кераргирит AgCl и другие минералы.
Миграция растворимого сульфата серебра приводит к появлению зоны вторичного обогащения, в которой отлагается вторичный аргентит:
Глубина распространения зоны вторичного обогащения серебром на некоторых полиметаллических месторождениях может достигать нескольких сот метров.
Контрольные вопросы:
1. Объяснить процесс окисления сульфидов металлов
2. Показать поведение железа в зоне окисления
3. Объяснить зону окисления никель-кобальтовых месторождений.
4. Объяснить зону окисления молибденовых и медных месторождений.
5. Объяснить зону окисления оловорудных и ртутных месторождений.
Лекция 8. Физико–химические свойства шлако-штейновых систем. (свойства жидких шлаков и штейнов. Равновесие в системе шлак-штейн –газовая фаза)
1. Состав металлургических штейнов.
2. Равновесие в системе шлак-штейн
Штейном называется сплав сульфидов тяжелых цветных металлов (меди, никеля, свинца, цинка и др.) с сульфидом железа, в котором растворены примеси. Штейны являются промежуточными металлсодержащими продуктами, получение которых характерно для пирометаллургии меди, никеля и частично свинца.
В практике цветной металлургии получают медные, медноникелевые, никелевые и полиметаллические штейны (табл. 1). Они образуются в жидком состоянии и практически не смешиваются с жидкими шлаками, что позволяет отделять их друг от друга путем отстаивания. Для успешного разделения штейнов и шлаков необходимо, чтобы разность их плотностей составляла не менее
Таблица 1 — Состав штейнов
Вид штейна Содержание, %
| Cu | Ni | Pb | Zn | Fe | S | |||
| Медный | 10. 60 | До 0,5 | До 1 | 1. 6 | 30. | ..50 | 23.. | .26 |
| Медно-никелевый | 5. 10 | 5. 13 | — | — | 40. | ..60 | 24.. | .27 |
| Никелевый | 0,1. 0,3 | 12. 20 | — | — | 55. | ..60 | 15.. | .22 |
| Полиметаллический | 10. 30 | — | 10. 20 | 5. 10 | 20. | ..40 | 13.. | .22 |
т/м 3 . Чем больше эта разность, тем быстрее идет отстаивание. Так, если шлак имеет плотность около 3000 кг/м 3 , то плотность штейна должна быть не менее 4000 кг/м 3 .
Основными компонентами медных штейнов являются сульфиды меди и железа (Cu2S и FeS). В медно-никелевых штейнах преобладают Ni3S2 Cu2SnFeS.
Характерными особенностями медных и медно-никелевых штейнов являются примерное постоянство в них содержания серы (23 . . . 27 %) и обязательное присутствие кислорода в форме растворенных оксидов железа (Fe3O4). При выполнении металлургических расчетов содержание серы в таких штейнах принимают равным 25 % (правило проф. Мостовича). Концентрация кислорода уменьшается с увеличением в штейнах содержания основного металла (Cu или Ni + Cu), т.е. чем беднее штейн (чем больше в нем железа), тем больше будет содержаться в нем кислорода. Расчетный состав медных штейнов следующий, %:
Медные и медно-никелевые штейны являются хорошими растворителями (коллекторами) всех благородных металлов. Кроме того, они обязательно содержат селен и теллур и ряд других примесей (мышьяк, сурьму, висмут, кадмий и др.).
В никелевых штейнах содержание серы переменно. Оно зависит от количества образовавшегося при плавке ферроникеля (сплава металлического железа с никелем). Чем большей будет металлизация штейна, тем ниже содержание в нем серы. Кислорода в никелевых штейнах практически нет.
Штейновые расплавы отличаются очень небольшой вязкостью. При температурах плавки (1200. 1300 °С) их вязкость составляет не более 5 • 10 3 Па * с. Вязкость штейнов снижается при увеличении температуры, а также содержания серы и железа. Очень бедные штейны настолько жидкотекучи, что легко проникают в мельчайшие поры и трещины футеровки.
Плотность расплавленных штейнов возрастает при увеличении содержания меди и никеля от 4000 до 5700кг/мэ. При высокой металлизации штейнов их плотность может достигать больших значений (до 7 т/м3).
Плотность шлака является функцией плотности его компонентов, важнейшие из которых имеют следующую плотность при комнатной температуре (г/см 3 ):
На плотность шлака наибольшее влияние оказывают тяжелые компоненты FeO, Fe2O3 и MnO.
Свойство вязкости, противоположное жидкотекучести, является важнейшим физическим свойством жидкого шлака. Активность шлака в большей мере зависит от вязкости, которая в свою очередь является функцией химического состава и температуры шлака.
Величину, обратную вязкости, называют текучестью. Единице динамической вязкости присвоено название пуаз (имеет размерность г/см•сек).Значения вязкости в технических единицах следующие: 1 техн. ед. вязкости = 1 кг•сек/м 2 = 98,1 пз.
С повышением температуры вязкость шлаков уменьшается, а текучесть, наоборот, увеличивается. Ранние шлаки обычно гетерогенны и, следовательно, обладают повышенной вязкостью. Шлаки обладают в 10—150 раз большей вязкостью, чем металл.
1. Объяснить состав металлургических штейнов.
2. Показать равновесие в системе шлак-штейн
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Источник