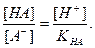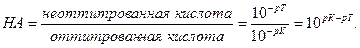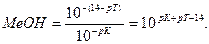Погрешности титрования
Читайте также:
|
 Рис. 13.6. Прибор для определения азота в органических соединениях (по ГФ XI) 1 – парообразователь; 2 – колба Кьельдаля; 3 – воронка для ввода щелочи; 4 – брызгоуловитель; 5 – холодильник; 6 — приёмник Рис. 13.6. Прибор для определения азота в органических соединениях (по ГФ XI) 1 – парообразователь; 2 – колба Кьельдаля; 3 – воронка для ввода щелочи; 4 – брызгоуловитель; 5 – холодильник; 6 — приёмник |
Определение азота в органических соединениях методом Кьельдаля проводят следующим образом (устройство прибора показано на рис. 13.6). Точную навеску анализируемого образца помещают в колбу Кьедьдаля и подвергают минерализации с помощью концентрированной серной кислоты, к которой добавлены K2SO4 и СuSO4, а в некоторых случаях ещё и селен или HgO. В процессе окисления органической части молекулы азот восстанавливается до иона аммония. После окончания минерализации к раствору добавляют NaOH. При этом образуется NH3, который отгоняют и поглощают раствором H3BO3 или стандартным раствором сильной кислоты (H2SO4 или HCl). В первом случае при взаимодействии борной кислоты с аммиаком образуется эквивалентное NH3 количество иона BO2 — , который затем титруют стандартным раствором HCl (титрование заместителя). Во втором случае определяют избыток сильной кислоты, не вступивший в реакцию с NH3, титруя раствор стандартным раствором NaOH (обратное титрование).
Обычный метод Кьельдаля используют для органических соединений, содержащих аминный азот (амины, аминокислоты и т.д.). Для определения азота в нитратах, нитритах, нитросоединениях и т.п. необходимо ещё предварительное восстановление данных азотсодержащих групп до иона аммония или аминогруппы.
Методику, похожую на описанную выше, можно использовать также и для веществ, которые легко гидролизуются с образованием аммиака или аминов. Такие вещества не подвергают минерализации, а сразу проводят их щелочной гидролиз. Например, определение азота в соединении (1) требует обязательной минерализации, а для соединения (2) достаточно щелочного гидролиза.
Ион аммония является достаточно слабой кислотой (pKa = 9,24), поэтому его прямое титриметрическое определение при концентрации в водном растворе, например, 0,1 моль/л, невозможно.
Определение борной кислоты
Борная кислота является слабой одноосновной кислотой (pKa » 9,3). Её кислотные свойства обусловлены реакцией:
Борная кислота является слишком слабой для того, чтобы её можно было с удовлетворительной погрешностью оттитровать щелочью в водном растворе. Однако, она может взаимодействовать с органическими веществами, в состав которых входит a-диольная группа (глицерин, глюкоза, фруктоза, маннит, сорбит и др.), с образованием более сильных комплексных кислот (например, у маннитборной кислоты pKa = 5,3). Последние могут быть оттитрованы раствором щёлочи в присутствии фенолфталеина.
Наиболее часто используемым на практике комплексообразователем при определении борной кислоты является глицерин, хотя по сравнению, например, с маннитом или моносахаридами данное вещество является менее активным комплексообразующим реагентом. Кроме того, глицерин очень вязкий и работать с ним неудобно. Глицерин, используемый в лаборатории, может содержать примеси кислот. Перед применением его необходимо нейтрализовать раствором щёлочи до появления слабо-розового окрашивания фенолфталеина.
Дата добавления: 2015-08-05 ; просмотров: 13 ; Нарушение авторских прав
Источник
Лекция 15. Кислотная и основная индикаторные погрешности титрования
Ключевые слова:показатель титрования индикатора, рН в точке эквивалентности,
кислотная индикаторная погрешность титрования, основная индикаторная
Кислотная погрешность (δHA)вызвана присутствием в растворе недотитрованной слабой кислоты и имеет отрицательное значение. Для вычисления кислотной погрешности составим выражение для константы диссоциации слабой кислоты и преобразуем это выражение:
НА 
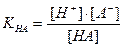
Поскольку НА кислота слабая, концентрация недиссоциированных молекул кислоты — [НА] — практически равна общей концентрации свободной кислоты в растворе. Величина [А − ] равна концентрации полученной соли. В результате нейтрализации 1 моля кислоты образуется 1 моль соли. Следовательно, отношение [НА]/[А − ] можно рассматривать как отношение концентрации неоттитрованной части кислоты к оттитрованной ее части, и оно позволяет оценить величину кислотной ошибки титрования (δНА). Поскольку [Н + ]=10 −р T , а KНА=10 −рК , из приведенного выше уравнения находим
δ
Если титрование необходимо провести так, чтобы индикаторная ошибка титрования не превышала 0,1%, то есть чтобы оставшаяся неоттитрованная кислота составляла не более 0,001 от количества оттитрованной кислоты, нужно, чтобы 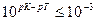
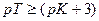
Значит, в тех случаях, когда применение данного индикатора вызывает возникновение кислотной ошибки титрования, он пригоден только при условии, если величина показателя титрования индикатора рТ не менее, чем на 3 единицы, превышает величину показателя диссоциации кислоты рК.
Например, достаточно точно оттитровать уксусную кислоту (рКкисл=4,73) можно только при применении таких индикаторов, показатель титрования которых рТ≥7,73. Значит, ни метиловый оранжевый (рТ≈4), ни метиловый красный (рТ≈5,5), ни лакмус (рТ≈7) не подходят. Наоборот, фенолфталеин (рТ≈9) можно использовать для титрования уксусной кислоты щелочью.
Величина кислотной погрешности в процентах (%) представляет собой молярную долю неоттитрованной кислоты и может быть рассчитана через соотношение
δНА(%) = 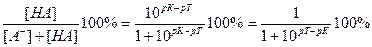
Основная погрешность титрования(δМеОН) вызвана присутствием в растворе недотитрованного слабого основания, как правило, имеет отрицательное значение. Учитывая диссоциацию слабого основания, составим выражение для константы диссоциации и преобразуем его.
МеОН 
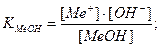
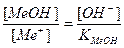
δМеОН = 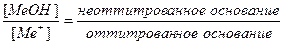
В конце титрования рН = рТ, а рОН =(14−рТ), и [OH — ] = 10 -(14- pT ) . Следовательно: δ
Достаточно точным титрование может быть при условии, если δМеОН-ошибка равна или меньше величины 10 −3 , то есть если 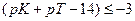
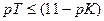
Величина основной погрешности в процентах (δМеОН(%)) представляет собой молярную долю неоттитрованного основания и может быть рассчитана через соотношение
δМеОН(%) = 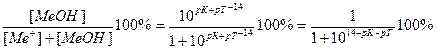
Пример 1. Вычислить ошибку титрования 0,1 н. раствора уксусной кислоты 0,1 н. раствором гидроксида натрия с индикаторами: а) метиловым оранжевым; б) фенолфталеином.
Решение. Для определения типа ошибки вычисляем рН раствора в точке эквивалентности: 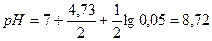
А. Титрование с метиловым оранжевым заканчивается при рН≈4. По окончании титрования в растворе будет присутствовать избыточная уксусная кислота СН3СООН. А так как это кислота слабая, она вызовет δНА-ошибку:
δ 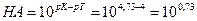
Это значит, что неоттитрованная часть уксусной кислоты относится к оттитрованной ее части, как 5,4 к 1. Другими словами, из 6,4 части первоначально взятой СН3СООН остаются неоттитрованными 5,4 части. Отсюда легко вычислить δНА-ошибку в процентах, составив пропорцию:
5,4 − х% . Следовательно: δНА(%) = 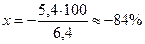
Вывод — титровать уксусную кислоту с метилоранжем нельзя. Тот же вывод можно получить без вычислений, применяя соотношение рТ≥(рК+3). Можно использовать индикаторы, для которых рТ≥ (4,76 + 3) = 7,76. Для метилоранжа это условие не выполняется: рТ≈4 − -ошибка:
δ 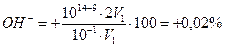
Фенолфталеин можно использовать для титрования уксусной кислоты щелочью.
Пример 2. Чему равна индикаторная ошибка титрования 0,1 н раствора NН4ОН 0,1 н раствором НСl с индикаторами: а) фенолфталеином, б) метиловым оранжевым?
Решение. Для определения типа ошибки вычисляем рН раствора в точке эквивалентности: 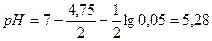
А. Титрование с фенолфталеином заканчивается при рН≈9; в растворе по окончании титрования будет некоторый избыток NН4ОН. Поэтому в данном случае возникает δМеОН-ошибка: δ 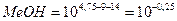
Следовательно, из 1,56 весовых частей первоначально взятого NН4ОН не оттитрованными остаются 0,56 весовой части. Составим и решим пропорцию:
0,56 — х% Следовательно: δМеОН(%) = 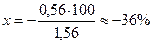
Индикатор фенолфталеин непригоден для титрования гидроксида аммония сильной кислотой. Тот же вывод получаем при применении соотношения для индикаторов: рТ≤(11−pK) = 11 – 4,76 = 6,24.
Тогда как для фенолфталеина рТ≈9 > 6,24.
Б. В случае титрования NН4ОН с метиловым оранжевым титрование заканчивается при рН≈4,0 вместо рН=5,28. В этом случае возникает δН + -ошибка: δ 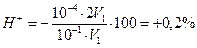
Контрольные вопросы
1.В каком титровании возникает кислотная индикаторная погрешность?
2.В каком титровании возникает основная индикаторная погрешность?
3.Как рассчитывается кислотная индикаторная погрешность?
4.Как рассчитывается основная индикаторная погрешность?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. — М.: Дрофа, 2005. — С. 139 – 140, 149 – 151.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.123 — 125.
Источник


 несовпадение точки эквивалентности и рТ индикатора.
несовпадение точки эквивалентности и рТ индикатора.





 , то
, то