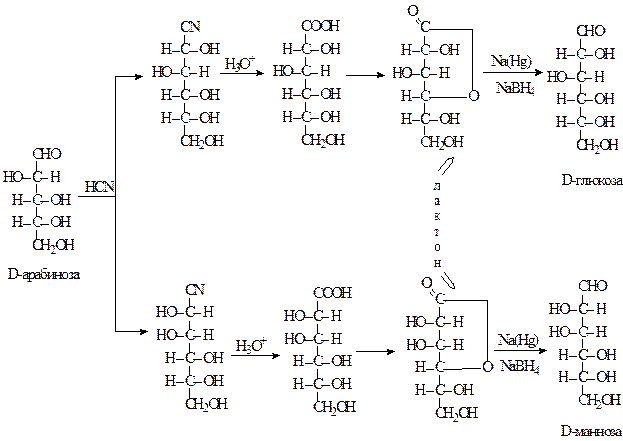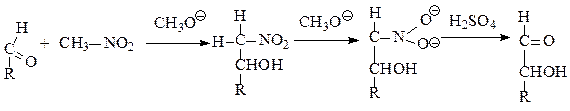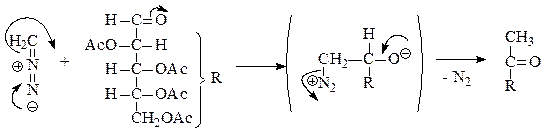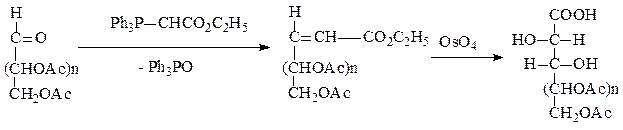Превращения связанные с удлинением углеродной цепи
Синтез по методу Килиани-Фишера: этот синтез применяется для увеличения длинны углеродной цепи альдозы на один атом углерода, в результате чего возникают две диастереомерные альдозы. Уже на первой стадии синтеза образуются изомерные циангидрины, дающие после гидролиза и дегидратации лактоны, которые восстанавливаются до альдоз, содержащих на один атом углерода больше, чем исходный моносахарид. Получение D-глюкозы и D-маннозы из альдопентозы показано на схеме. Смесь диастереомерных продуктов можно разделять на разных стадиях синтеза, но лучше всего это сделать передокончательным восстановлением, так как разделение двух образующихся сахаров бывает сопряжено с некоторыми трудностями [5].
Нитрометановый синтез Совдеиа-Фишера. В сильно щелочной среде (например, NaOCH3 в СН3ОН) нитрометан теряет протон и превращается довольно стойкий карбанион, который легко присоединяется к углероду альдегидной группы сахара. Образующиеся стереоизомеры нитроалкоголя дают в щелочной среде соли ацинитросоединений, которые обычно разделяют фракционной кристаллизацией. Эти соли легко разлагаются серной кислотой (60%-ной) с образованием высшей альдозы.
Если вместо нитрометана взять нитроэтанол, в результате описанных реакций получается 2-кетосахар, содержащий на 2 атома углерода больше, чем исходная альдоза.
Диазометановый метод.Атом углерода в диазометане обладает нуклеофильными свойствами и способен присоединяться к углероду карбонильной группы сахара. Далее от промежуточного продукта присоединения отщепляется азот и образуется дезоксикетоза, содержащая на один атом углерода больше, чем исходный сахар. Реакция может быть продолжена при действии второго эквивалента диазометана.
Реакция Виттига. При действии этоксикарбонилметилентрифенил-фосфорана на производное аль-формы сахара образуется транс-непредельное соединение. При гидроксилировании двойной связи и гидролизе образуется альдоновая кислота высшей альдозы:
Если проводить реакцию в диметилформамиде, то вместо защищенной аль-формы моносахарида можно взять свободный сахар.
Удлинение углеродной цепи у аномерного центра приводит к образованию так называемых «С-гликозидов». Для получения таких соединений можно воспользоваться реактивом Гриньяра, действуя им на галогенозу [1]:
Источник
Способы удлинения углеродной цепи
При синтезе соединения, содержащего большее число атомов углерода, чем исходное вещество, следует воспользоваться реакциями, в которых молекула исходного соединения усложняется на один атом или группу атомов углерода. Решая вопрос о том, сколько атомов углерода можно одновременно вводить в молекулу и какими путями построения углеродной цепи воспользоваться, удобно прибегнуть к методу «фрагментации».
Например, мы хотим синтезировать бутанон-2 (метил-этил кетон) 
синтез в обратном порядке, попытаемся представить себе те фрагменты, т. е. группы атомов углерода, которые могут быть использованы для построения заданной четырехуглеродной цепи с функциональной группой у второго атома углерода. Ниже приводится несколько возможных наборов фрагментов:
Следует учитывать, что функциональная группа в целевом соединении 
Теперь вопрос ставится так: с помощью каких реакций можно связать молекулы, соответствующие этим фрагментам, чтобы получить метилэтилкетон или соединение, легко превращаемое в этот кетон? Здесь нужно использовать знание обычных органических реакций. Применив известные методы получения кетонов для первого набора фрагментов 
Каждая из этих реакций представляет собой взаимодействие этилмагнийгалогенида с соединением, содержащим два атома углерода.
Далее нужно решить, насколько легко можно перейти от исходного вещества (этанола) к любому из названных двууглеродных соединений. Ацетальдегид получают из этанола в одну стадию:
Хлористый ацетил синтезируют в две стадии:
Однако ацетонитрил, необходимый для осуществления реакции 
Итак, выгоднее всего в качестве одного из возможных двууглеродных фрагментов вводить в реакцию уксусный альдегид или хлористый ацетил. Поскольку путь, предусматривающий использование уксусного альдегида, дает лучший выход (в случае хлористого ацетила реакция осложняется побочными процессами), желательно применять альдегид. Оба пути состоят из одинакового числа стадий.
Для второго набора фрагментов 
одноуглеродного фрагмента из этанола потребует по меньшей мере трех стадий, как было показано выше при получении ацетонитрила. Поскольку имеется достаточно удобный трехстадийный путь синтеза целевого соединения по первому варианту 
Те же соображения относятся и к третьему набору фрагментов 
Приняв решение использовать путь 
Реактив Гриньяра готовят из магния и бромистого этила. Последний можно получить следующим образом:
Хлористый этил, который также можно было бы применить для получения реактива Гриньяра, — газ и поэтому неудобен в работе.
И наконец, завершив составление схемы синтеза в обратном порядке с использованием метода фрагментации, напишем общую схему в обычном виде, начиная с исходного вещества.
1. Получение реактива Гриньяра:
2. Получение альдегида:
3. Реакция реактива Гриньяра с альдегидом:
4. Дегидрирование спирта:
Выбранный нами наиболее выгодный путь синтеза бутанона-2 из этанола не является единственно приемлемым. Имеются и другие пути, которые также находят применение.
Схема 1 
Схема 2 
Схема 3
Возможен, хотя практически не используется, и другой путь синтеза на основе варианта
В табл. 1 приведены реакции, обычно используемые для наращивания углеродной цепи молекулы на один или несколько атомов углерода. Перечень этих реакций, конечно, не является исчерпывающим.
Таблица 1 (см. скан) Методы наращивания углеродной цепи
Источник
Способы удлинения углеродной цепи
Способы получения алканов
В промышленности предельные углеводороды получают из нефти фракционированием или крекингом. Перегонка позволяет выделить алканы, изначально присутствующие в нефти, при крекиге происходит разрыв С-С связей, в результате чего образуются углеводороды меньшей молекулярной массы, чем исходные. Низшие гомологи алканов зачастую получают из природного газа. Лабораторные способы можно разделить на три группы:
образование алкана с сохранением углеродного скелета исходной молекулы
1. Гидрирование непредельных углеводородов
2. Восстановление йодалканов
3. Восстановление карбонильных соединений (реакции Кижнера-Вольфа и Клемменсена)
4. Гидролиз (сольволиз) реактивов Гриньяра
Реакции, протекающие с укорочением углеродной цепи
получение алканов с более длинной цепью, чем исходные соединения
1. взаимодействие галогеналканов с металлическим натрием или калием (реакция Вюрца)
2. электролиз солей карбоновых кислот (реакция Кольбе)
3. взимодействие диалкиллитийкупратов или других металлорганических соединений с активными алкилгалогенидами
Источник
Препаративные способы получения алканов
Нефть и природный газ как источники алканов имеют тот недостаток, что алканы выделяются при различных типах переработки в виде смеси. Выделение из таких смесей индивидуальных соединений представляет собой трудную задачу, особенно с ростом числа атомов углерода, так как при этом резко возрастает количество структурных изомеров, а различия в физических свойствах становятся все меньше.
Известные методы разделения, такие, как перегонка, экстракционная кристаллизация с мочевиной (образование клатратов с н-алканами), молекулярные сита (пропускают н-алканы), становятся неэффективными для тяжелых алканов. По этой причине для получения определенных алканов используются синтетические методы.
Препаративные методы получения алканов можно разделить на две большие группы: с сохранением углеродного скелета исходного соединения; с изменением углеродного скелета.
Синтезы с сохранением углеродного скелета
К этим способам относятся методы восстановления любых других классов органических соединений в алканы. Каждый класс требует специфических условий реакции и соответствующего восстановителя, все определяется реакционной способностью восстанавливаемой группы. Так, если алкены и алкины легко гидрируются каталитически (мелкораздробленные никель, платина, палладий), то магнийорганические соединения легко восстанавливаются уже от контакта с водой:
Более подробно реакции восстановления рассмотрены в последующих разделах.
Синтезы с изменением углеродного скелета
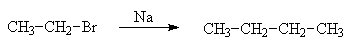
Удлинение углеродной цепи можно осуществить по реакции Вюрца . Открытая Ш. Вюрцем в 1855 г., исследованная П. П. Шорыгиным, она используется для получения высших алканов, так как низшие образуются с низкими выходами.
Взаимодействие алкилгалогенидов с металлическим натрием дает в качестве основного продукта алканы, побочного — алкены, с промежуточным образованием натрийалкила:
Помимо рекомбинации возможны β-распад, диспропорционирование. Исключительно высокая реакционная способность натрийорганических соединений затрудняет исследование механизма этой реакции и контроль процесса, особенно в случае низших алканов.
Препаративное значение реакция Вюрца имеет для получения симметричных алканов.
Реакция Кольбе (1849 г.) также позволяет получать симметричные алканы через промежуточное образование радикалов при электролизе натриевых или калиевых солей карбоновых кислот:
Укорочение углеродной цепи происходит при декарбоксилировании карбоновых кислот (реакция Дюма) . При нагревании солей карбоновых кислот (щелочных или щелочноземельных металлов) с гидроксидами натрия, бария, натронной известью (NaOH + СаО), алкоголятами натрия идет отщепление СО2 с образованием алкана, содержащего на один атом углерода меньше, чем исходная кислота:
CH3COONa + NaOH → CH4 + Na2CO3
Этот удобный препаративный метод получения метана можно осуществлять и в школьной химической лаборатории.
Источник