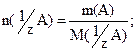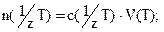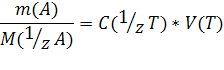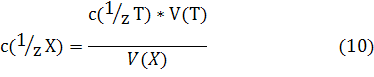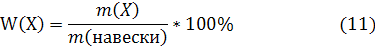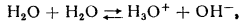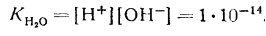III. Методы отдельных навесок и пипетирования
При проведении титрования можно брать либо определенную массу анализируемого вещества, либо точно отмеренный объем анализируемого раствора. В соответствии с этим различают два подхода: метод отдельных навесок и метод пипетирования.
1) В методе отдельных навесок взвешивают на аналитических весах точную навеску m(А) вещества А, количественно переносят ее в колбу для титрования, растворяют, прибавляя в колбу некоторое количество растворителя, и титруют полученный раствор. При этом объем титруемого раствора можно не измерять. n( 1 /zT) = n( 1 /zA) – закон эквивалентов.
Получают:
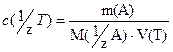
Титрование проводят заданное число раз (
2) В методе пипетирования отбирают с помощью калиброванной пипетки аликвоту — точно измеренный объем V(Х) анализируемого раствора вещества X с неизвестной молярной концентрацией эквивалента с( 1 /zХ) и титруют аликвоту стандартным раствором титранта с молярной концентрацией эквивалента с( 1 /zТ).
Пусть на титрование затрачен объем титранта V(Т).
n( 1 /zX) = n( 1 /zТ) по закону эквивалентов.
Определив концентрацию анализируемого раствора, можно рассчитать массу m(Х) вещества X во всем анализируемом растворе:
где Vк — объем всего анализируемого раствора в мерной колбе (объем
мерной колбы).
Если известна масса от исходной навески, содержащей определяемый компонент X, которая была растворена в мерной колбе при приготовлении анализируемого раствора, можно вычислить массовую долю W(X) определяемого компонента X в исходной анализируемой навеске:
Классификация методов титриметрического анализа.
Наиболее распространенная классификация титриметрических методов основана на различных типах используемых реакций.
1) Кислотно-основное титрование (метод нейтрализации) — титрование, основанное на реакции переноса протонов от одной реагирующей
частицы к другой в растворе. Различают ацидиметрию и алкалиметрию.
Ацидиметрия (ацидиметрическое титрование) — определение веществ титрованием стандартным раствором кислоты.
Алкалиметрия (алкалиметрическое титрование) — определение веществ титрованием стандартным раствором сильного основания.
2) Окислителъно-восстановительное титрование (редоксметрия) -титрование, сопровождаемое переходом одного или большего числа
электронов от иона-донора или молекулы (восстановителя) к акцептору
(окислителю).
3) Осадительное титрование — такое титрование, когда титруемое вещество при взаимодействии с титрантом выделяется из раствора в виде осадка.
4) Комплексиметрическое титрование — титрование вещества раствором такого соединения, которое образует с титруемым веществом слабодиссоциирующий растворимый комплекс.
Разновидностью комплексиметрического титрования является комплексонометрическое титрование (комплексонометрия) — такое титрование, когда титруемое вещество при взаимодействии с титрантом — раствором комплексонов — образует комплексонаты металлов.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Методы отдельных навесок и пипетироваиия



При проведении титрования можно брать либо определенную массу анализируемого вещества, либо точно отмеренный объем анализируемого раствора. В соответствии с этим различают два подхода: метод отдельных навесок и метод пипетирования
В методе отдельных навесоквзвешивают на аналитических весах точную навеску т(А) вещества А, количественно переносят ее в колбу для титрования, растворяют, прибавляя в колбу некоторое количество растворителя, и титруют полученный раствор. При этом объем титруемого раствора можно не измерять.
Пусть на титрование раствора вещества А затрачен объем V(Т) титранта с неизвестной молярной концентрацией эквивалента c (1/zТ). Поскольку А и Т реагируют в эквивалентных соотношениях, то их эквивалентные количества равны п(1/z А) = п(1/z Т). Эти эквивалентные количества можно выразить в виде
n (1/z А) = m(A) /M(1/z A) , п(1/z Т) = с(1/z Т)V(Т),
где М(1/z А) — молярная масса эквивалента вещества А. Левые части этих уравнений равны; значит, равны и правые части:
Отсюда с(1/z Т) = т(А) /М(1/z А)V(Т).
Титрование проводят заданное число раз (обычно от двух до пяти), каждый раз взвешивая новую навеску вещества А.
В методе пипетированияотбирают с помощью калиброванной пипетки аликвоту — точно измеренный объем V(Х) анализируемого раствора вещества X с неизвестной молярной концентрацией эквивалента с(1/z Х) и титруют аликвоту стандартным раствором титранта с молярной концентрацией эквивалента с(1/z Т).
Пусть на титрование затрачен объем титранта V(Т). Тогда, поступая аналогично изложенному выше в при выводе формулы получим
Определив концентрацию анализируемого раствора, можно по формуле рассчитать массу т(Х) вещества X во всем анализируемом растворе:
т(Х) = с(1/z Х )M (1/z Х )V к
где Vк — объем всего анализируемого раствора в мерной колбе (объем мерной колбы).
Если известна масса т исходной навески, содержащей определяемый компонент X, которая была растворена в мерной колбе при приготовлении анализируемого раствора, можно вычислить массовую долю W(Х) определяемого компонента X в исходной анализируемой навеске:
Классификация методов титриметрического анализа
Наиболее распространенная классификация титриметрических методов основана на различных типах используемых реакций.
1) Кислотно-основное титрование (метод нейтрализации)— титрование, основанное на реакции переноса протонов от одной реагирующей частицы к другой в растворе. Различают ацидиметрию и алкалиметрию.
Ацидиметрия (ацидиметрическое титрование)— определение веществ титрованием стандартным раствором кислоты.
Алкалиметрия (алкалиметрическое титрование)— определение веществ титрованием стандартным раствором сильного основания.
2) Окислительно-восстановительное титрование (редоксметрия)— титрование, сопровождаемое переходом одного или большего числа электронов от иона-донора или молекулы (восстановителя) к акцептору(окислителю).
3) Осадительное титрование— такое титрование, когда титруемое вещество при взаимодействии с титрантом выделяется из раствора в виде осадка.
4) Комплексиметрическое титрование— титрование вещества раствором такого соединения, которое образует с титруемым веществом слабодиссоциирующий растворимый комплекс.
Разновидностью комплексиметрического титрования является комплексонометрическое титрование (комтексонометрия) — такое титрование,когда титруемое вещество при -взаимодействии с титрантом —раствором комплексонов — образует комплексонаты металлов.
Виды титрования, применяемые в титриметрическом анализе
В титриметрическом анализе применяют прямое титрование, обратное титрование и косвенное титрование, или титрование по заместителю (заместительное титрование).
Прямое титрование — это такое титрование, когда определяемое вещество непосредственно титруется стандартным раствором титранта или наоборот. Расчет результатов прямого титрования проводится аналогично описанному
выше при характеристике метода пипетирования

где все обозначения соответствуют принятым ранее, причем объем мерной колбы Vк измеряется в литрах, а объем той же мерной колбы Vk — в миллилитрах: Vк’ = 1000 Vк.
Обратное титрование (титрование по остатку) — титрование непрореагировавшего вещества, которое прибавлено в избытке к анализируемому раствору в виде стандартного раствора. К аликвотной доле анализируемого раствора объемом V(Х)n прибавляют в избытке точно известный объем V(Т1) стандартного раствора вещества Т 1 с молярной концентрацией эквивалента с (1/z Т1). Определяемое вещество X реагирует с Т, нацело. Затем непрореагировавший избыток вещества Т, оттитровывают стандартным раствором титранта Т2. Схема реакций при обратном титровании:
X + Т1 = Продукты реакции,
Т1 + Т2 = Продукты реакции,
Расчет концентрации с(1/z Х) определяемого вещества X. Вещество Т1 реагирует с X и Т2, поэтому
здесь все обозначения соответствуют принятым ранее.
Источник
Методы титриметрического анализа
Титриметрический анализ можно проводить двумя методами: методом отдельных навесок и методом пипетирования.
Метод отдельных навесок. На аналитических весах берут 5-6 навесок определяемого вещества А, каждую из которых растворяют в небольшом количестве дистиллированной воды, и полученные растворы титруют раствором титранта. Массу анализируемого вещества для каждой отдельной навески рассчитывают по формуле
Из среднего арифметического всех найденных значений определяют содержание анализируемого вещества и рассчитывают погрешность.
Метод пипетирования (метод аликвот).Метод пипетирования заключается в том, что на титрование отбирают пипеткой только часть анализируемого раствора Va. Навеску анализируемого вещества растворяют в мерной колбе объемом VK. Массу навески рассчитывают таким образом,
чтобы она была в (VK / Va.) раз больше, чем масса определяемого вещества, необходимая на отдельное титрование.
Следовательно, при расчете массы по результатам титрования
По сравнению с методом отдельных навесок в методе пипетирования существуют дополнительные случайные отклонения, возникающие в результате погрешностей измерения объемов пипетки и мерной колбы, в которой готовят стандартный раствор. Кроме того, ошибка при взвешивании определяемого вещества может привести к неверным результатам за счет систематической погрешности. Однако ввиду большей длительности и трудоемкости определения по методу отдельных навесок на практике чаще используют метод пипетирования.
В основе кислотно-основного титрования положена реакция взаимодействия ионов водорода или гидроксония с гидроксид-ионами:
При помощи этого метода определяют кислоты, основания, соли, способных гидролизоваться в водных растворах, а также их смеси, азот, серу в органических соединениях, некоторые органические соединения (формальдегид, спирты и др.).
В качестве титрантов в кислотно-основном титровании применяют в основном растворы сильных кислот (НС1, Н2SО4) и сильных оснований (КОН, NaOH).
В зависимости от природы титранта кислотно-основное титрование включает два основных метода: ацидиметрия и алкалиметрия. В ацидиметрии титрантом служит раствор кислоты, а применяют ее для определения различных оснований. В алкалиметрии титрант — раствор щелочи, а применяется для определения кислот,
Титранты кислотно-основного титрования относятся к титрантам второго типа — стандартизированные или с установленным титром. В качестве исходных веществ для установления титра рабочих растворов кислот используют тетраборат натрия (Na2B4O7*10H2O) или карбонат натрия безводный (Na2CO3), а для установления титра растворов щелочей – щавелевую (Н2С2О4*2Н2О) или янтарную (Н2С4Н4О4) кислоту.
Кислотно-основное титрование не сопровождается внешним эффектом, а лишь изменением рН. Реакция среды в точке эквивалентности определяется природой взаимодействующих кислот и оснований.
В кислотно-основном методе титрования различают три случая титрования:
1. Титрование сильной кислоты сильной щелочью и наоборот:
НСl + NaOH = NaCl + H2O; H + + OH — = H2O
Точка эквивалентности находится в нейтральной среде (рН=7), т.к. образующаяся соль не подвергается гидролизу.
2. Титрование слабой кислоты сильной щелочью:
В точке эквивалентности образуется соль слабой кислоты и сильного основания, которая вступает в реакцию гидролиза:
СH3COONa + HOH ↔ CH3COOH + NaOH
В растворе накапливаются ионы ОН — и точка эквивалентности будет находиться в щелочной среде (рН > 7 ), не совпадая с точкой нейтральности.
3. Титрование слабого основания сильной кислотой:
Образующаяся соль слабого основания и сильной кислоты (NH4Cl) подвергается гидролизу, и в растворе накапливаются ионы Н+, что вызывает смещение точки эквивалентности в кислую среду. Следовательно, и в третьем случае точка эквивалентности не совпадает с точкой нейтральности.
Поскольку кислотно-основное титрование не сопровождается внешним эффектом, например, изменением окраски, для фиксирования точки эквивалентности применяют индикаторы
Согласно протолитической теории к кислотам относятся химические соединения, способные в растворах отдавать протоны, а к основаниям вещества, способные присоединять протоны. Для того чтобы кислота могла отдать протон, необходимо присутствие основания, принимающего этот протон. Отдавая протон, кислота образует сопряженное с ней основание, а основание, принимая протон, образует сопряженную с ним кислоту.
В водных растворах кислот имеет место следующее равновесие:
В воде, которая является кислотой и основанием одновременно и представляет собой слабый электролит устанавливается равновесие
в сокращенном виде
 |
Константа равновесия этой реакции при температуре 25° С равна
 |
В водных растворах масса воды в большинстве случаев очень велика по сравнению с массой растворенного вещества, количество ее в 1 л раствора можно считать постоянным. Тогда выражение для константы равновесия запишется следующим образом:
Из уравнения следует, что ионное произведение является величиной постоянной при постоянной температуре. Эту константу называют ионным произведением воды, которое при температуре 25° С равно
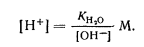 |
 |
Концентрацию водородных ионов обычно используют для характеристики среды. В большинстве расчетов, относящихся к кислотно-основному равновесию, концентрации (и другие величины) удобно выражать в виде отрицательных логарифмов этих величин, обозначаемых знаком „р». Тогда
Источник