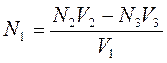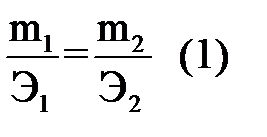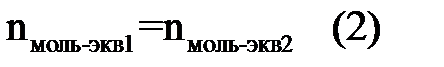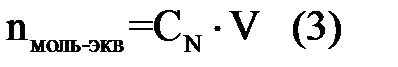Прямое, обратное и титрование по замещению и их примеры.
В титриметрическом анализе применяют прямое титрование, обратное титрование и титрование по заместителю.
Прямое титрование– это такое титрование, когда определяемое вещество непосредственно титруется стандартным раствором титранта или наоборот. Расчет результатов прямого титрования проводится следующим образом.
где n(Х),n(Т) – количество титруемого вещества и тиранта,
с(X), с(Т) – нормальная концентрация титруемого вещества и титранта,
V(X),V(T) – объемы соответственно титруемого вещества и титранта,
М(Х) – молярная масса титруемого вещества Х,
Vk– объем мерной колбы в литрах,
Т(Х) – титр вещества Х.
Примеромпрямого титрования может служить метод определения изменения концентрации магния, используемый в практической части данной работы.
Обратное титрование (титрование по остатку)– титрование непрореагировавшего вещества, которое прибавлено в избытке к анализируемому раствору в виде стандартного раствора.
К аликвотной доле анализируемого раствора объемом V(X) прибавляют в избытке точно известный объемV(T1) стандартного вещества Т1с молярной концентрацией эквивалента с(Т1). Определяемое вещество Х реагирует с Т1нацело. Затем непрореагировавший избыток вещества Т1оттитровывают стандартным раствором тиранта Т2. Схема реакции при обратном титровании выглядит следующим образом.
Х + Т1= Продукты реакции
Т1(избыток) + Т2= Продукты реакции
Расчет концентрации с(Х) определяемого вещества Х :
Вещество Т1реагирует с Х и Т2, поэтому:
где n(Х),n(Т1),n(T2) – количество титруемого вещества, добавленного вещества и тиранта,
с(X), с(Т1),c(T2) – нормальная концентрация титруемого вещества, добавленного вещества и титранта,
V(X),V(T1),V(T2) – объемы соответственно титруемого вещества, добавленного вещества и титранта.
Пример.Определение кальция в карбонате кальция методом обратного титрования.
Пусть требуется определить содержание кальция в анализируемом образце карбоната кальция. Для этого образец растворяют в хлороводородной кислоте (вещество Т1) с точно известным содержанием НСl:
Избыток непрореагирававшей НСlоттитровывают стандартным растворомNaОН (вещество Т2) с известной концентрацией:
В соответствии с законом эквивалентов можно записать:
n(1/2Ca 2+ ) = c(HCl)*V(HСl) — с(NaОН)*V(NaОН).
Зная эквивалентное количество катионов кальция n(1/2Ca 2+ ) , можно рассчитать массу кальцияm(1/2Ca 2+ ) в анализируемом образце:
где М(1/2Ca 2+ ) – молярная массаCa 2+ .
Косвенное титрование (титрование по замещению)– титрование, при котором определяемое вещество не реагирует с титрантом непосредственно, а определяется косвенно в результате использования стехиометрически протекающей реакции с образованием другого вещества, реагирующего с титрантом.
К анализируемому раствору, содержащему определенный компонент Х, прибавляют реагент А в избытке (для обеспечения полноты протекания реакции) по сравнению со стехиометрическим количеством. При этом образуется вещество В – заместитель в количестве, эквивалентном прореагировавшему компоненту Х:
Образовавшийся заместитель В оттитровывают стандартным раствором титранта Т:
По результатам титрования рассчитывают молярную концентрацию эквивалента с(Х), титр Т(Х) и массу m(Х) определяемого компонента Х в анализируемом растворе, исходя из закона эквивалентов:
c(X) = c(T)*V(T) / V(X), T(X) = c(X)*M(X) / 1000,
где n(Х),n(Т),n(B) – количество титруемого вещества, тиранта и заместителя,
с(X), с(Т) – нормальная концентрация титруемого вещества и титранта,
V(X),V(T) – объемы соответственно титруемого вещества и титранта,
М(Х) – молярная масса титруемого вещества Х,
Vk– объем мерной колбы в литрах,
Т(Х) – титр вещества Х,
m(X) – масса титруемого вещества Х.
Таким образом, расчеты результатов анализа в методе косвенного титрования аналогичны таковым при прямом титровании.
Пример. Определение нитратов методом заместительного титрования. Навеску анализируемого нитрата, например нитрата натрия, растворяют в воде и получают раствор объемомVк. к аликвотной части раствора прибавляют металлический цинк в небольшом избытке по сравнению со стехиометрическим количеством и щелочь. При этом протекает реакция
Образовавшийся аммиак отгоняют в приемник со стандартным раствором НСlобъемомV(НСl), где он связывается в катион аммония:
Все величины в правой части последнего уравнения известны, поэтому можно найти концентрацию нитрата натрия. Зная объем Vкисходного анализируемого раствора, рассчитывают массу нитрата натрия в этом растворе:
Источник
Способы титрования



Реакция должна быть практически необратимой, т.е. заканчиваться полным расходованием исходных веществ и иметь большое значение константы равновесия.
При этом не должно образовываться никаких побочных продуктов как вследствие взаимодействия исходных веществ с окружающей средой (например, с кислородом или углекислым газом, содержащимися в воздухе), так и в результате протекания между ними нескольких параллельных реакций.
В реакциях должна точно и быстро фиксироваться точка эквивалентности.
2. Реакция между веществами рабочего и исследуемого растворов должна протекать в строгом стехиометрическом соотношении, соответствующем её химическому уравнению.
4. Реакция должна протекать с достаточной скоростью, т.е. за малый отрезок времени. Наиболее оптимальным в этом случае является время, необходимое для перемешивания одной добавленной капли титранта с объёмом титруемого раствора, т.е. 1-3 секунды.
Если реакция осуществляется медленно, то сложно точно определить наступление точки эквивалентности. При этом также теряется основное достоинство титриметрии – быстрота выполнения анализа и получения результата.
Если химическая реакция не удовлетворяет хотя бы одному из вышеперечисленных требований, она не может быть использована в титриметрическом анализе. Но если ей невозможно найти замену, то такую реакцию пытаются «приспособить» для применения в титриметрии. Например, многие окислительно-восстановительные реакции при обычных условиях протекают медленно, являются обратимыми и многонаправленными, т.е. исходные вещества в них расходуются одновременно по нескольким направлениям. Для устранения данных недостатков изменяют условия проведения реакции. Например, осуществляют её при нагревании или в присутствии катализаторов (это позволяет существенно увеличить скорость реакции), а также в определённой среде: кислой, нейтральной или щелочной (это позволяет устранить обратимость и многонаправленность).
Следует, однако, подчеркнуть, что такое «приспособление» приводит к усложнению метода. Применение его целесообразно идти лишь тогда, когда неизвестна более удобная химическая реакция.
Различают три основных способа титрования: прямое, обратное, косвенное или заместительное.
При прямом титровании используют исследуемый и один рабочий растворы. В процессе определения к определённому точно измеренному объёму одного из них по каплям добавляют второй раствор до наступления точки эквивалентности.
Закон эквивалентов в этом случае может быть математически записан следующим образом:
где V1 и V2 – объёмы израсходованных исследуемого и рабочего растворов, соответственно; N1 и N2— молярные концентрации химических эквивалентов веществ исследуемого и рабочего растворов, соответственно.
Молярную концентрацию химического эквивалента вещества в исследуемом растворе рассчитывают по формуле:
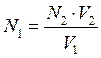
При обратном титровании используют исследуемый и два рабочих раствора, один их которых является вспомогательным, а второй применяют для титрования.
В процессе анализа к определённому точно измеренному объёму исследуемого раствора одномоментно добавляют взятый в избытке фиксированный объём вспомогательного рабочего раствора. В результате протекания химической реакции вещество, присутствующее в исследуемом растворе, расходуется полностью. Не прореагировавший избыток вещества вспомогательного раствора титруется затем вторым рабочим раствором до наступления точки эквивалентности, например:
раствор рабочий раствор
Таким образом, вещество, присутствующее во вспомогательном рабочем растворе, реагирует как с веществом исследуемого раствора, так и с веществом второго рабочего раствора. Закон эквивалентов в этом случае математически может быть записан следующим образом:
где V1, V2, V3 – израсходованные объёмы исследуемого, вспомогательного и второго рабочих растворов, соответственно; N1, N2, N3 – молярные концентрации химических эквивалентов веществ в исследуемом, вспомогательном и во втором рабочих растворах, соответственно.

Молярную концентрацию химического эквивалента рассчитывают по формуле:
Обратное титрование в аналитической практике может называться иначе титрованием по остатку или с двумя титрантами.
Оно используется, если определяемое вещество не реагирует или реагируют медленно с веществом второго рабочего раствора, либо в реакции между ними невозможно определить точку эквивалентности.
При косвенном, или заместительном, титровании также используют исследуемый раствор и два рабочих раствора. В ходе анализа к точно измеренному объёму исследуемого раствора одномоментно добавляют нефиксированный заведомый избыток первого рабочего раствора. В результате протекающей реакции вещество исследуемого раствора полностью расходуется с образованием эквивалентного количества соответствующего продукта реакции, который затем титруется вторым рабочим раствором до наступления точки эквивалентности, например:
исследуемый первый рабочий эквивалентное
раствор раствор кол-во продукта реакции
второй рабочий раствор
Таким образом, мы как бы замещаем определяемое вещество на другое, которое впоследствии и подвергаем анализу.
Так как количество вещества эквивалента образовавшегося продукта и количество вещества эквивалента в исследуемом растворе равны между собой, то молярную концентрацию химического эквивалента вещества в исследуемом растворе рассчитываем по такой же формуле, как и при прямом титровании.
Заместительное титрование применяют, когда непосредственное определение вещества в исследуемом растворе невозможно: отсутствует подходящий титрант, нельзя установить точку эквивалентности и т.п.
Источник
Теоретические основы титриметрического метода анализа
Титриметрический анализ основан на измерении количества реактива, затраченного на реакцию с определяемым веществом, и заключается в точном определении объема раствора химического реагента, необходимого при данном анализе. Точность определения объема раствора достигается с помощью технического приема, называемого титрованием.
Титрование– постепенное прибавление титрованного раствора к исследуемому раствору. Титрованный раствор или стандартный это раствор, с точно известной концентрацией. Такой раствор называется титрантом.
В процессе титрования наступает момент завершения реакции между титрантом и анализируемым веществом, называемый точкой эквивалентности. В данный момент количество реагирующих веществ в смеси становится эквивалентным, что отмечается величиной объёма рабочего раствора, пошедшего на титрование.
Поэтому для расчета количества вещества можно использовать закон эквивалентности, т. е. отношение:
Отношение 
В то же время n можно рассчитать исходя из формулы:
где CN – молярная концентрация эквивалента и тогда:
Подставляя уравнение (3) в уравнение (2) получаем основную формулу расчёта в объёмном анализе, т. е.
Часто C N заменяют на N (нормальность) и в этом случае приведенная формула в упрощённом виде будет выглядеть следующим образом:
Для расчётов часто применяют также величину, называемую титром.
Титр – это количество граммов растворенного вещества в 1мл раствора, обозначаемый буквой Т с индексом справа внизу, указывающим название растворенного рабочего вещества. Например, ТНС1 или ТКMnO4. Титр рассчитывают по следующим формулам:
В некоторых случаях удобно выражать титр не в граммах рабочего вещества, а в граммах определяемого вещества, реагирующего с 1 мл рабочего раствора. Такой титр называют титром по определяемому веществу.
Например, ТKMnO4/Fe = 0,00562 г/мл, это означает, что 1 мл раствора KMnO4 окисляет 0,00562г железа.
В титриметрическом методе анализа применяют в зависимости от задач, три способа титрования: прямое, заместительное и обратное.
Прямое титрование заключается в постепенном добавлении титранта к анализируемому раствору до достижения точки эквивалентности по следующему уравнению: аА + bВ = dD
например: Cl + NaOH → NaCl + H2O
Заместительное (косвенное) титрование заключается в том, что к определённому веществу добавляют специальный реагент, вступающий с ним в реакцию, один из продуктов взаимодействия затем оттитровывается рабочим раствором-титрантом.
Общее уравнение Пример:
A + BZ → AB + Z 2Cu 2+ + 4KI → 2СuI + I2 + 4К +
Обратное титрование заключается в добавлении к анализируемому веществу точно известного избытка титранта (1), остаток которого после реакции оттитровывают с помощью титранта (2).
Избыток титрант 2
Например: 1) NaCl + AgNO3 → AgС1 + NaNO3
оставшийся титрант 2
По каждому способу титрования проводятся необходимые расчёты. К реакциям в объёмном анализе предъявляются определённые требования.
1.Реакции должны быть практически необратимыми.
2.Реакция должна протекать в строгом соответствии с уравнением химической реакции без побочных продуктов
3. Реакция должна протекать достаточно быстро.
4.Должна быть чёткая фиксация конца титрования, т.е. точки эквивалентности.
Выбор способа фиксирования решается применительно к конкретным условиям.
В объёмном анализе необходимо знать точную концентрацию и объёмы растворов реагирующих веществ. Для измерения объёмов жидкости с точностью до 0,01 – 0,03 см 3 используется специально мерная посуда : мерные колбы, бюретки, пипетки, мерные цилиндры, мензурки и др. (рисунок 9.1).
Для точного измерения объёма соблюдают некоторые правила:
1. Глаз экспериментатора должен находиться на одном уровне с мениском измеряемой жидкости.
2. Объём прозрачных жидкостей отмеряют по нижнему мениску. Объём интенсивно окрашенных жидкостей – по внешнему мениску.
Мерные колбы (4) предназначены для приготовления растворов титранта, первичных стандартов, анализируемых проб. Мерные колбы бывают различной вместимости (от 2000см 3 до 25см 3 ) На узком и длинном горлышке колбы имеется метка, а на широкой части указан номинальный объём.
Пипетки (3) предназначены для отмеривания и переноса заданного объёма раствора из одного сосуда в другой. Различают пипетки Мора (1), рассчитанные на один объём, обозначаемый меткой на узкой части и градуированные пипетки (2). Для заполнения пипетки нижний конец её опускают в раствор почти до дна, с помощью резиновой груши заполняют раствор выше метки, затем плотно закрывают верхнее отверстие указательным пальцем. Держа пипетку вертикально, осторожно ослабляют давление пальца и дают избытку раствора стекать по каплям, чтобы мениск установился точно против метки. Вновь плотно закрыв пипетку пальцем, осторожно перенести в приготовленный сосуд и, открыв отверстие, дают жидкости медленно вытекать, наблюдая за тем, чтобы отверстие пипетки не касалось раствора в сосуде. Оставшиеся капли раствора в кончике пипетки выдувать запрещается, так как объем этих капель учтен при калибровке.
Бюретки (1,2) предназначены для измерения объёма вытекающей из них жидкости. Обычные лабораторные бюретки представляют собой стеклянные градуированные цилиндрические трубки, снабжённые затвором. В качестве затворов чаще всего используется стеклянный кран или резиновая трубка с затвором шарикового типа, с металлическим зажимом.
Для проведения титрования бюретки устанавливают в штативе строго вертикально, заполняют титрантом с помощью воронки выше нулевой отметки. Затем освобождают кончик бюретки от пузырьков воздуха, слегка приподнимая резиновую трубку и надавливая на неё в месте расположения стеклянного шарика. После этого снимают воронку и устанавливают уровень раствора на нулевой отметке. Титровать из бюретки небходимо медленно при постоянном перемешивании раствора в колбе для титрования, чтобы выяснить, на какой капле титранта наступает конец титрования, после чего отмечают по бюретке объем раствора, пошедшего на титрование исследуемого вещества.
Перед работой любую мерную посуду тщательно моют сначала хромовой смесью или раствором (0,1н) хлороводородной кислоты, после этого ополаскивают дистиллированной водой. В мерной посуде нельзя нагревать жидкости и наливать горячие растворы.
§3. Кислотно-основное титрование
Метод кислотно-основного титрования широко применяется в клинических анализах, санитарно-гигиенических и токсикологических исследованиях, в фармации, при анализе лекарственных препаратов, и т.д.
В основе кислотно-основного метода титрования лежат реакции между кислотами и основаниями, поэтому этот метод подразделяется в свою очередь на ацидиметрический и алкалиметрический.
В ацидиметрии в качестве титрантов применяют 0,01–0,1N растворы сильных кислот (HCl и H2SO4) для определения оснований, солей слабых кислот, аминов и их производных. Так как серная кислота гигроскопична, а соляная летуча, то установки точной концентрации этих веществ проводят по стандартным растворам, таких, например, как бура (Na2B4O7·10H2O).
Алкалиметрию применяют для определения сильных и слабых кислот (H3BO3, HCl, CH3COOH), а так же фенолов и солей слабых оснований, например, хлорида аммония NH4Cl. Титрантами в данном случае являются 0,01–0,1N растворы сильных оснований (NaOH, KOH). Стандартным титрантом в данном случае является раствор щавелевой кислоты – H2С2O4·5Н2О.
В основе метода кислотно-основного титрования лежит реакция нейтрализации, сущность которой заключается в следующем уравнении:
простейший вид: Н + + ОН – → Н2О
При этом ионы водорода H + кислоты связываются ионами OH – оснований, т.е. при титровании (прибавления малых порций из бюретки) кислоты к щелочи происходит постепенное уменьшение ионов Н + , а ионы ОН – увеличиваются. Таким образом, уменьшение концентрации кислоты можно судить по изменению концентрации ионов водорода. В точке эквивалентности, т.е. в конце титрования, концентрация ионов водорода [H + ] практически должна быть равна концентрации ионов гидроксила [OH – ]. Как показали исследования, величина концентрации ионов водорода, в данном случае, равна 10 –7 г-ион/л
На практике вместо концентрации водородных ионов используют понятие «водородный показатель», обозначаемый – рН и равный отрицательному десятичному логарифму из концентрации водородных ионов, т.е. 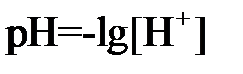
Значит, если [H + ] = 10 –7 г-ион/л, то рН = – lg10 –7 = 7.Такое значение рН обозначает нейтральную среду. Это значит, что в этом случае и [OH – ]=10 –7 , а рОН = 7.Таким образом в нейтральной среде сумма рН + рОН = 14.
При рН > 7 среда раствора будет щелочной, при рН + + Cl – + Na + + OH – → Na + + Cl – + H2O
Сокращённое ионное уравнение:
В точке эквивалентности будет нейтральная среда и рН = 7. Соль NaCl не подвергается гидролизу и реакция необратима.
2) Реакция между слабой кислотой и сильным основанием:
В ионном уравнении не диссоциирует слабая уксусная кислота, так как в растворе присутствуют сильные электролиты — основание и соль.
CH3COOH + Na + + OH – → CH 3COO – + Na + + H2O
И сокращенное уравнение показывает, что в точке эквивалентности образуется избыток ОН – ионов, т.е. рН > 7.
Кроме того, происходит гидролиз соли CH3COONa, что еще увеличивает число ОН – ионов. Гидролиз идет по следующему уравнению:
CH3COO – + Na + + H 2O → CH3COOН + Na + + ОН –
т.е. идет обратимый процесс.
3) Реакция между сильной кислотой и слабым основанием:
в ионном виде: H + + Cl – + NH 4OH → NH4 + + Cl – + H2O
Эта реакция так же обратима, т.к. соль NH 4Cl подвергается гидролизу по уравнению:
В точке эквивалентности реакция среды будет кислой, т.е. рН 
Заряженные частицы Ind – – сложные органические ионы имеющие окраску, отличающуюся от окраски молекулярной, неионизированной формы.
Если к водному раствору Hind добавить немного NaOH ,то гидроксидные ионы ОН – будут соединяться с ионами Н + , образуя H2O. Вследствие принципа Ле-Шателье равновесие диссоциации индикатора сдвигается вправо и раствор меняет окраску на окраску свободных ионов Ind -.
Если к тому же раствору прибавить HCl, то есть Н + , то равновесие сдвинется в сторону образования HInd и появится окраска недиссоциированных молекул. Известны одноцветные и двухцветные индикаторы. К одноцветным относится фенолфталеин, который в кислой и нейтральной среде – бесцветный, а в щелочной среде – малиновый цвет.
К двухцветным индикаторам относится метиловый оранжевый. В кислой среде этот индикатор имеет розовую окраску, в щелочной и нейтральной среде – жёлтую.
Каждый индикатор имеет определённый интервал перехода окраски, представляющий собой тот промежуток между двумя значениями рН, в котором изменяется окраска. Величина интервала перехода – DрН, обычно не превышает двух единиц. Так у фенолфталеина DрН = 8 – 10, а у метилоранжа
Среднее значение рН в интервале перехода окраски называется точкой перехода индикатора или показателем титрования. На практике, при титровании, показатель титрования есть конец реакции между кислотой и основанием. Значит точка перехода индикатора – есть точка конца титрования. Значения рН для различных индикаторов представлено в таблице 1.
Источник