- § 6. Формы существования химических элементов. Простые и сложные вещества. Вещества молекулярного и немолекулярного строения
- Классификация веществ
- Понятие химического элемента. Простые и сложные вещества
- Различие между атомами
- Химические элементы и их соединения
- Соединения. Химические формулы
- Простое и сложное химическое вещество
- Простые вещества
- Элемент и вещество
- Аллотропия
- Сложные вещества
- Классификация сложных химических веществ
- Вопросы и задания
- Ответы
§ 6. Формы существования химических элементов. Простые и сложные вещества. Вещества молекулярного и немолекулярного строения

Химические элементы редко встречаются в природе в виде одиночных атомов. Например, в космическом пространстве существует в виде отдельных атомов водород. В условиях же Земли более естественной и распространённой формой существования химических элементов являются химические соединения — простые и сложные вещества.
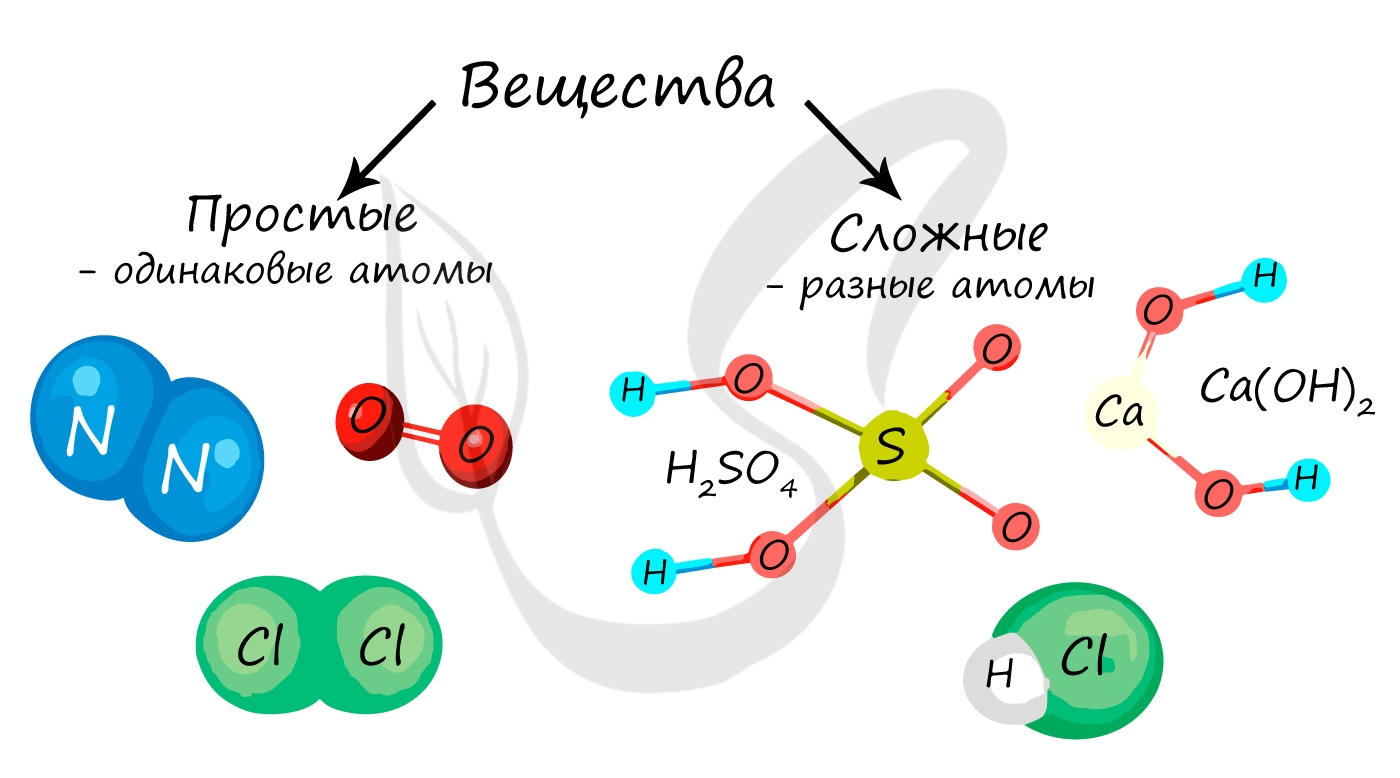
Химические соединения, образованные атомами одного химического элемента, называют простыми веществами. Особую группу простых веществ- неметаллов составляют содержащиеся в воздухе инертные газы (Не, Ne, Аr, Кr), имеющие одноатомные молекулы. Их ещё называют благородные газы.
Химические соединения, образованные атомами разных химических элементов, называют сложными веществами.
Таким образом, можно выделить три формы существования химических элементов: в виде одиночных атомов; в составе простых веществ; в составе сложных веществ. В таблице 2 приведены примеры различных форм существования некоторых химических элементов в природе.
Простые вещества делятся на металлы и неметаллы. Классификация и общие характеристики физических свойств металлов и неметаллов представлены на рисунке 19.
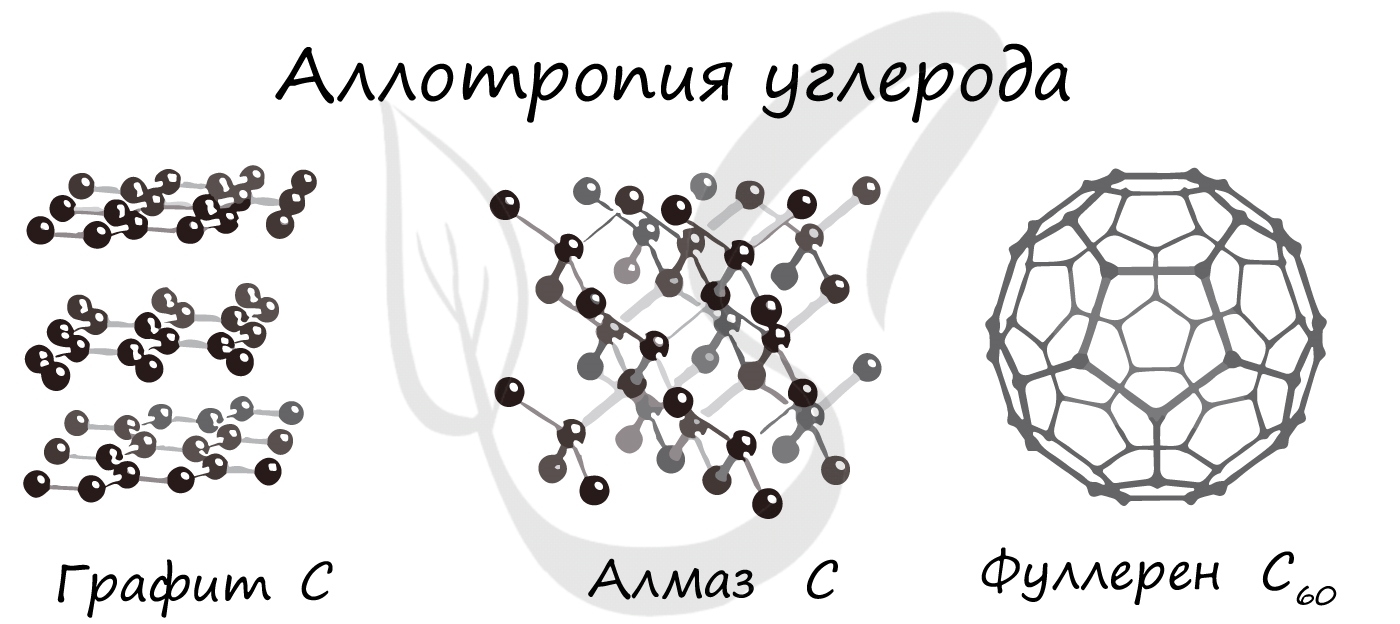
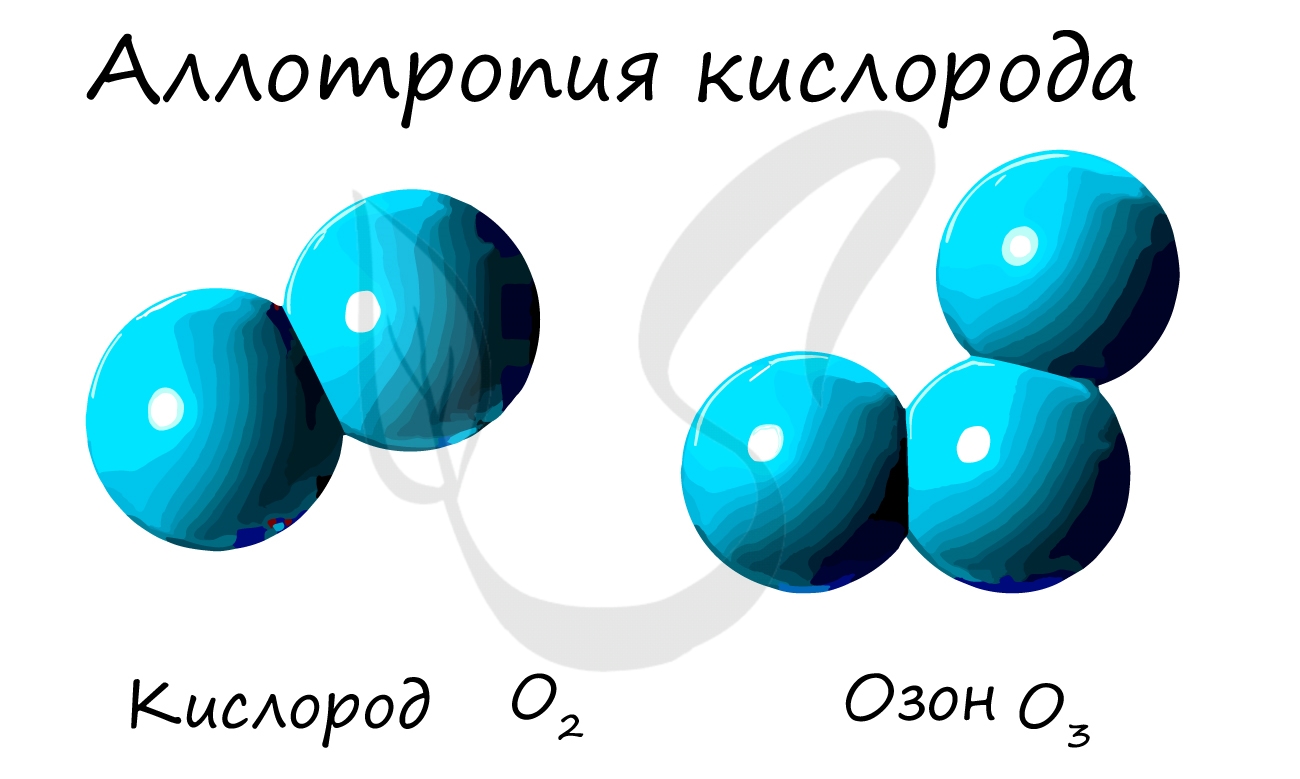
Русские названия простых веществ обычно совпадают с русскими названиями соответствующих химических элементов: водород — водород, медь — медь и т. д. Но есть и исключения. Например, атомы элемента углерода образуют несколько простых веществ (аллотропных модификаций) — сажу, алмаз, графит, различных по строению и свойствам. Атомы элемента кислорода образуют два простых вещества: кислород и озон, обладающие разным составом молекул, а следовательно, и разными свойствами.
Таким образом, сходство в названиях элементов и простых веществ не должно приводить к отождествлению этих понятий (табл. 3).
Некоторые сведения о молекулярном и немолекулярном строении веществ
Как видно из рисунков таблицы 2, далеко не все химические соединения состоят из молекул. Атомы химических элементов, соединяясь друг с другом, в одних случаях образуют молекулы, в других — более сложные структуры.
Порядок соединения атомов при образовании из них веществ обусловливает особенности строения веществ. Различают вещества молекулярного и немолекулярного строения.
Источник
Классификация веществ
Вещество в химии — любая совокупность атомов и молекул. Вещества в химии подразделяются на простые и сложные.
Простые и сложные вещества
Простые вещества состоят из атомов одного химического элемента, то есть их образуют два и более одинаковых атома: H2, N2, O2, O3(озон), Mn, Fe.
Сложные вещества состоят из атомов двух и более видов: KMnO4, H2SO4, HCl.
Предмет химии (греч. chymos — сок)
У любой науки есть предмет изучения и методами, с помощью которых изучается предмет. Химия — наука о веществах, их превращениях и явлениях, которые сопровождают эти превращения.
Хочу заметить важную деталь: необходимо четко разделять химические и физические реакции. При химических реакциях происходят изменения в составе молекул: одни атомы сменяются другими, молекулы рвутся на части и собираются снова в обновленном виде.
При физических реакциях молекулы неизменны, связи атомов внутри них не подвергается изменениям.
К признакам химических реакций относится ряд критериев:
- Выделение газа
- Появление запаха
- Изменение окраски раствора или реагирующих веществ
- Выпадение осадка
- Образование воды
- Выделение тепла
- Поглощение тепла
Аллотропия
Аллотропия (греч. allos — иной + tropos образ) — свойство некоторых химических элементов принимать различные физические формы, существовать в виде двух и более простых веществ.
Такие уникальные способности имеются у углерода. Его известнейшие аллотропные модификации: алмаз, графит и фуллерен. В разделе химических связей мы вернемся к ним, однако будет хорошо, если вы уже сейчас запомните: алмаз и графит имеют атомное строение, фуллерен — молекулярное.
Обратите внимание: вы можете догадаться о строении веществ по их формуле. У фуллерена молекулу составляют 60 атомов углерода. Мы изучали, что молекула — это как минимум два атома, соединенных вместе. Таким образом, уже по формуле, очевидно, что строение фуллерена молекулярное.
Среди аллотропных модификаций фосфора выделяют: белый, красный и черный фосфор. Белый (P4) фосфор имеет молекулярное строение, а красный и черный (P∞) — атомное.
Аллотропные модификации серы включают ромбическую, моноклинную, и пластическую серу. Ромбическая (S8) и моноклинная сера (S8) имеют молекулярное строение. Пластическая сера (S∞) представляет собой длинные цепочки атомов, тем не менее также характеризуется молекулярным строением.
Надо заметить, что с течением времени, пластическая и моноклинная модификации серы, неустойчивые, превращаются в ромбическую, наиболее устойчивую.
Из аллотропных модификаций кислорода наиболее известен озон (греч. ozo — иметь сильный запах). Озон — неустойчивая модификация кислорода, образуется в озоновом слое под действием ультрафиолетового излучения. Имеет молекулярное строение и формулу — O3.
Озон — ядовитый газ. Применяется как окислитель при отбеливании, при очистке воды и кондиционировании воздуха. В медицине существует целое направление, посвященное лечению с применение озона — озонотерапия.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Понятие химического элемента. Простые и сложные вещества
Классификация чистых веществ в химии начинается с разделения их на простые и сложные в зависимости от состава. Различие между ними, связанное с понятиями химического элемента и соединения, обусловлено атомно-молекулярным строением вещества.
Различие между атомами
Атом представляет собой связанную электрическими силами систему из ядра и электронного облака. Ядро образовано протонами и нейтронами и имеет положительный электрический заряд, складывающийся из зарядов протонов. Нейтроны, не имеющие заряда, вносят вклад в массу ядра и, соответственно, атома.
Мельчайшие носители отрицательного заряда – электроны – образуют вокруг ядра облако. Зарядом ядра определяется их число, от которого зависит конфигурация облака, – в частности, заполнение электронами его внешней оболочки, то есть химические свойства атома. Разнообразие атомов – это следствие существования ядер с разным количеством протонов.
Химические элементы и их соединения
Совокупность атомов с одинаковой величиной заряда ядра называют химическим элементом. Эта величина в периодической таблице представлена порядковым номером элемента. Например, номер азота – 7 – означает, что в ядре атома азота 7 протонов.
У химических элементов существуют разновидности – изотопы, отличающиеся числом нейтронов в ядре и значениями атомных масс. Физические свойства изотопов неодинаковы, а химические идентичны, поскольку они представляют один и тот же элемент.
Число внешних электронов в атоме может изменяться. В этом случае он приобретает электрический заряд и становится ионом: отрицательным, если присоединяет лишний электрон, и положительным при потере своего. При этом не происходит превращения одного химического элемента в другой, так как заряд ядра сохраняется.
Соединения. Химические формулы
Атомы вступают в химическую связь, взаимодействуя внешними электронными оболочками, и образуют молекулы или немолекулярные структуры с регулярным строением. Вещества, частицы которых представляют собой устойчивые сочетания атомов или ионов, называются химическими соединениями.
Химические обозначения соединений – формулы – отражают элементный состав и количество атомов каждого элемента в структурной единице вещества. Формула H2 означает, что молекула вещества образована одним элементом и состоит из двух атомов. По формуле KNO3 видно, что вещество составлено тремя элементами – калием, азотом и кислородом в соотношении 1:1:3.
Простое и сложное химическое вещество
Простые вещества
Простым называют вещество, состоящее из однотипных атомов, то есть образованное одним элементом. Его нельзя разложить на другие вещества.
Простые вещества подразделяют на две группы:
- металлы: натрий, алюминий, марганец, золото, железо и т. д.;
- неметаллы: кислород, озон, водород, хлор, графит и пр.
Если атомы связаны в молекулы, то простое вещество считается соединением (бром, фосфор, большинство газов). В отличие от них, металлы, алмаз, графит, инертные газы – это атомарные вещества.
Элемент и вещество
Понятие простого вещества необходимо отличать от понятия химического элемента. Элемент – это совокупность химически одинаковых атомов. В свободном виде он существует в форме природного или искусственного простого вещества.
| Химические элементы | Простые вещества | |
| Характеристики | Атомный номер Относительная атомная масса Химический символ | Физические свойства (магнитные, оптические, термические и пр.) Химическая формула |
| Примеры высказываний | Относительная атомная масса хлора равна 35,5 Азот входит в состав многих соединений | Молекула хлора имеет относительную массу 71 Азот входит в состав атмосферы |
Аллотропия
Некоторые элементы в свободном виде существуют в нескольких формах. Это явление называется аллотропией. Различным формам одного элемента – аллотропным модификациям – присущи разные свойства. Аллотропия обусловлена следующими причинами:
- Различия в составе. Например, вещества кислород (O2) и озон (O3) – аллотропные модификации химического элемента кислород.
- Различия в строении. Элемент углерод представлен такими веществами, как алмаз, графит, графен, фуллерены. Различают аморфный и кристаллический кремний, белый, красный, черный и другие виды фосфора.
Число химических элементов достигло 118, но вследствие аллотропии простых веществ насчитывается свыше 400.
Сложные вещества
Сложное вещество построено из химически связанных атомов различных элементов. Получение и разложение сложных веществ осуществляется в химических реакциях. Это отличает их от смесей.
- Неметаллы, как правило, образуют вещества, состоящие из молекул: воду H2O, аммиак NH3, углекислый газ CO2, метан CH4.
- Металлы образуют немолекулярные соединения: поваренную соль NaCl, негашеную известь CaO, гидрид меди CuH.
Классификация сложных химических веществ
Исходя из строения и свойств, выделяют следующие классы сложных соединений:
- Бинарные. Это вещества, образованные двумя элементами: гидриды (CaH2, KH), карбиды (SiC, Mg2C) бескислородные кислоты (соляная HCl, сероводород H2S) и их соли (хлориды, сульфиды и др.).
- Оксиды. Это сложные бинарные вещества, в составе которых есть кислород со степенью окисления (условным зарядом иона) -2. Различают основные K2O, MgO (степень окисления металла +1, +2), кислотные SO3, CO2, CrO3 с неметаллами или металлами в степени окисления от +5 до +7, амфотерные ZnO, Al2O3 и несолеобразующие (CO, SiO, NO и N2O) оксиды.
- Гидроксиды характеризуются составом вида «элемент – группа OH». К этому классу веществ относят:
- Кислоты (азотная HNO3, фосфорная H3PO4, серная H2SO4). Образуются в результате взаимодействия кислотных оксидов с водой. Имеют в составе один или несколько атомов водорода, которые могут замещаться атомом металла, и кислотный остаток.
- Основания (едкий натр NaOH, гашеная известь Ca(OH)2), образующиеся в реакциях воды с основными оксидами. Растворимые основания (KOH, NaOH) называются щелочами.
- Амфотерные гидроксиды способны проявлять и кислотные, и основные свойства.
- Соли. Это сложные химические вещества с составом типа «металл – кислотный остаток». Соль – продукт реакции между кислотой и основанием. Карбонат калия (поташ) K2(CO)3, сульфат меди (медный купорос) CuSO4 – примеры солей.
| Наименования некоторых кислот, кислотных остатков и солей | |||||
| Кислота | Кислотный остаток | Соль | |||
| Азотная | HNO3 | нитрат | NO3 | нитрат натрия | NaNO3 |
| Азотистая | HNO2 | нитрит | NO2 | нитрит кальция | Ca(NO2)2 |
| Серная | H2SO4 | сульфат | SO4 | сульфат алюминия | Al2(SO4)3 |
| Сернистая | H2SO3 | сульфит | SO3 | сульфит калия | K2SO3 |
| Угольная | H2CO3 | карбонат | CO3 | карбонат кальция | CaCO3 |
| Хлорная | HClO4 | перхлорат | ClO4 | перхлорат серебра | AgClO4 |
| Хлорноватая | HClO3 | хлорат | ClO3 | хлорат меди | Cu(ClO3)2 |
| Кремниевая (метакремниевая) | H2SiO3 | силикат (метасиликат) | SiO3 | метасиликат лития | Li2SiO3 |
| Уксусная | CH3COOH | ацетат | CH3COO | ацетат натрия | CH3COONa |
| Марганцовая | HMnO4 | перманганат | MnO4 | перманганат калия | KMnO4 |
| Муравьиная | HCOOH | формиат | HCOO | формиат калия | HCOOK |
Количество сложных веществ, включая полученные искусственно соединения, превышает 25 миллионов.
Вопросы и задания
- Выберите правильное окончание утверждения: формульная единица сульфата индия In2(SO4)3 содержит…
- 5 химических элементов;
- 3 химических элемента;
- 3 атома.
- В каком из высказываний речь идет о химическом элементе, а в каком – о простом веществе?
- калий входит в состав поташа;
- калий – мягкий серебристо-белый металл.
- Выберите правильное окончание утверждения: к простым веществам относится…
- негашеная известь;
- озон;
- аммиак.
- Составьте из предложенного перечня три списка: а) химические элементы; б) простые вещества; в) сложные вещества.
графит, вода, метан, углерод, красный фосфор.
- Напишите формулу вещества, молекула которого содержит атомы углерода и кислорода в соотношении 1:2. К какому классу соединений оно относится?
- соли;
- кислотные оксиды;
- основные оксиды.
- Определите вещество, которое образуется в реакции соединений SO3 и H2O. Классифицируйте его, выбрав вариант из списка:
- щелочь;
- соль;
- кислота.
- Заполните пропуски:
- сульфат натрия Na2SO4 – соль … кислоты;
- ZnOH — … гидроксид;
- основание …OH – продукт реакции … оксида Li2O с водой.
Ответы
- б).
- а) химический элемент; б) простое вещество.
- б) озон.
- а) углерод; б) графит, красный фосфор; в) вода, метан.
- Химическая формула – CO2, класс – б) кислотный оксид.
- Серная кислота H2SO4, вариант б).
а) сульфат натрия Na2SO4 – соль серной кислоты; б) ZnOH – амфотерный гидроксид; в) основание LiOH – продукт реакции основного оксида Li2O с водой.
Источник