Способы стандартизации титрованных растворов
Под стандартизацией раствора титранта понимают установление его точной концентрации с относительной погрешностью, не превышающей ± 0,1%.
Различают приготовленные и установленные растворы титрантов. Приготовленные растворы точной концентрации получают растворением точной навески тщательно очищенного исходного вещества в определенном объеме воды или другого растворителя. Так готовят, например, титрованный раствор NaCl .
Однако многие растворы, например титрованный раствор HCl , приготовить этим способом нельзя. В таких случаях готовят раствор титранта, концентрация которого известна лишь приблизительно, а затем его стандартизуют, т.е. устанавливают концентрацию точно. Эти растворы называют установленными. Для стандартизации растворов применяют специальные установочные вещества – первичные стандарты. Эти вещества должны иметь состав, точно отвечающий химической формуле, быть устойчивыми на воздухе и иметь по возможности большую молярную массу эквивалента *. Они должны быть также доступными и легко очищаться от примесей. Реакция титранта с раствором установочного вещества должна отвечать требованиям, которые предъявляются к титриметрическим реакциям, т.е. протекать быстро, количественно и стехиометрически.
Например, растворы NaOH и KOH часто стандартизуют по гидрофталату калия 
Нередко для целей стандартизации используют вторичные стандарты, в качестве которых выступают титрованные растворы веществ, способных взаимодействовать с титрантом.
Как правило, стандартизацию титранта стремятся проводить в тех же условиях, какие будут при выполнении анализа.
Источник
Стандартизация раствора титранта



Под стандартизацией раствора титранта имеют в виду установление его точной концентрации с относительной погрешностью, обычно не превышающей ± 0,1 %. Обязательным условием этой процедуры является высокая точность определения концентрации титранта.
приготовленные
установленныерастворы титрантов.
Приготовленныерастворы получают путем растворения точной навески тщательно очищенного исходного вещества в определенном объеме воды или другого растворителя (например, раствор NaCl, K2Cr2O7). Однако многие растворы таким путем приготовить нельзя, в том числе, NaOH, KMnO4. В таких случаях готовят раствор титранта приблизительной концентрации, а потом его стандартизуют, т. е. устанавливают концентрацию с необходимой точностью. Такие растворы называют установленными. Для стандартизации титрантов применяют специальные установочные вещества, так называемые первичные стандарты.
Первичные стандарты – вещества, имеющие состав, точно отвечающий химической формуле. Они должны удовлетворять следующим требованиям:
быть устойчивы на воздухе и иметь, по возможности, большую молярную массу эквивалента;
быть доступными, легко очищаться от примесей;
реакция вещества титранта с установочным веществом должна протекать быстро, количественно и стехиометрически.
Растворы NaOH и КОН часто стандартизуют по дифталату калия КНС8Н4О4 или дигидрату щавелевой кислоты Н2С2О4 · 2Н2О.
Растворы HCl и H2SO4 стандартизуют по карбонату натрия Na2СО3 или декагидрату тетрабората натрия Na2В4О7 ·10 Н2О.
Иногда для стандартизации используют вторичные стандарты. В качестве вторичных стандартов выступают титрованные растворы веществ, способных взаимодействовать с титрантом. Например, стандартизацию раствора HCl можно сделать по титрованному раствору NaOH.
Основное правило, которое необходимо помнить: стандартизация титранта и последующее выполнение анализа необходимо проводить в одних и тех же условиях, а для стандартизации использовать то же вещество, которое будет анализироваться в дальнейшем.
Стандартные растворы готовят в мерных колбах из фиксаналов, которые содержат точно фиксированное количество вещества, обычно 0,1 моль эквивалента.
При стандартизации растворов используют: 1) метод отдельных навесок; 2) метод пипетирования.
Метод отдельных навесок
Рассчитывают массу навески стандартного вещества при условии, что расход титранта на её титрование составляет не более 20 мл. На аналитических весах взвешивают в бюксах три навески, которые могут отличаться от рассчитанной на ± 10 %. Затем их переносят точно в конические колбы для титрования, добавляют индикатор и титруют. Рассчитывают молярную концентрацию титранта для каждой навески стандартного вещества и расхождение между наибольшим и наименьшим результатами. Если расхождение не превышает 0.2 – 0.3 %, то берут среднее значение из всех трех результатов. В случае большего расхождения взвешивают еще одну навеску стандартного вещества, титруют её, находят четвертый результат и снова проверяют сходимость значений молярной концентрации
Метод пипетирования
При стандартизации растворов этим методом рассчитывают навеску стандартного вещества, необходимую для приготовления заданного объема раствора первичного стандарта с концентрацией, как правило. близкой к молярной концентрации титранта. Взвешенную на аналитических весах навеску твердого вещества количественно переносят в мерную колбу, растворяют, тщательно перемешивая. Аликвоту полученного раствора отбирают пипеткой, предварительно промытой этим раствором, в коническую колбу для титрования и титруют стандартизуемым раствором. Аликвота – порция вещества, содержащаяся в растворе, отобранном с помощью пипетки.
При стандартизации раствора титрование проводят не менее трех раз. Если объемы, затраченные на титрование, совпадают между собой в пределах 0,2 – 0,3 %, то берут из них среднее значение и рассчитывают молярную концентрацию титранта. В случае большего расхождения проводят повторное титрование.
Для приготовления стандартных растворов используют также «фиксаналы» (стандарт-титры). Фиксанал представляет собой стеклянную или пластиковую ампулу, содержащую точную навеску стандартного твердого вещества (или определенный объем титрованного раствора), необходимую для приготовления 1 литра точно 0.1 N раствора.

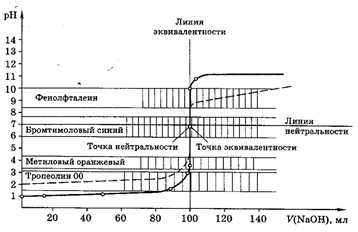
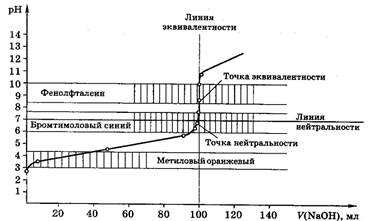
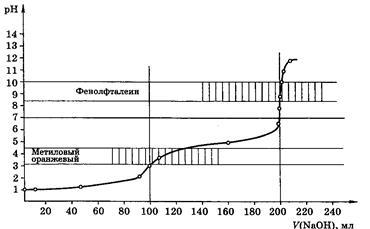
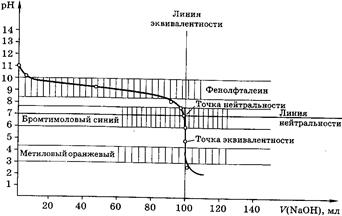
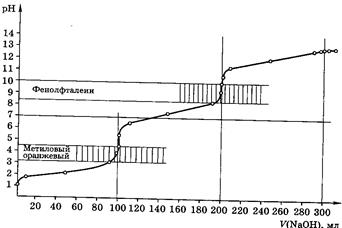
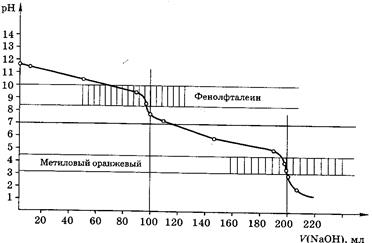
Кривые титрования
Кривые титрования являются важной характеристикой титриметрического метода. Они показывают графическую зависимость логарифма концентрации участника реакции, протекающей при титровании, или какого-то свойства раствора от объема добавленного титранта (или от степени оттитрованности). Например, для реакции кислотно-основного титрования: рН – V (объем титранта).
Кривая титрования служит для подбора индикатора, который позволит определить т.э. и т.к.т.
Рис 1. Кривая титрования 100,0 мл 0,1М НСl 0,1М раствором NaOH
Рис 2. Кривая титрования 100,0 мл 0,1М СН3СООН 0,1М раствором NaOH
Рис 3. Кривая титрования смеси 0,1М НСl и 0,1М СН3СООН 0.1М раствором NaOH
Рис 4. Кривая титрования 100,0 мл 0,1М NН3 0,1М раствором НСl
Рис 5. Кривая титрования 100,0мл 0,1М Н3РО4 0,1М раствором NaOH
Рис 6. Кривая титрования 100,0мл 0,1М Na2СО3 0,1М раствором НСl
Источник
СТАНДАРТИЗАЦИЯ ТИТРОВАННЫХ РАСТВОРОВ
После приготовления проводят стандартизацию титрованных растворов. Под стандартизацией титрованного раствора понимают процесс нахождения точной концентрации активного реагента в растворе.
Согласно ГФ концентрацию титрованных растворов устанавливают с помощью специальных установочных веществ (первичных стандартов) – исходных стандартных веществ. Их обозначают буквами РО (реактив основной). Исходные стандартные вещества(первичные стандарты) – вещества высокой чистоты. Согласно указаниям ОФС «Титрованные растворы» их готовят из реактивов, подвергая дополнительной очистке (сублимируют, перекристаллизовывают).
В основе стандартизации лежит стехиометрическое взаимодействие титранта и первичного стандартного вещества.
Вещества, используемые в качестве первичных стандартов, должны иметь:
– состав, точно соответствующий формуле;
– высокую чистоту (строгая стехиометричность состава);
– устойчивость на воздухе при комнатной температуре (не должны изменяться при хранении);
– отсутствие гигроскопической влаги (должны быть негигроскопичными);
– по возможности большую молярную массу эквивалента для обеспечения минимальной погрешности взвешивания;
Согласно ОФС «Титрованные растворы» в качестве исходных стандартных веществ (реактивов основных (РО); первичных стандартов) для установки концентрации титрованных растворов в титриметрическом анализе используют:
– калия бромат (РО) KBrO3;
– натрия карбонат безводный (РО) Na2CO3;
– натрия хлорид (РО) NaСl;
Нередко для стандартизации титрованных растворов используют вторичные стандарты, содержание активного компонента в которых находят с помощью первичных стандартов.
В качестве вторичных стандартов при стандартизации титрованных растворов согласно ГФ выступают титрованные растворы с установленной концентрацией, которые стехиометрически взаимодействуют со стандартизуемым титрованным раствором.
Например, стандартизацию титрованных растворов аммония тиоцианата (аммония роданида) согласно ГФ следует проводить, используя в качестве вторичного стандарта титрованные растворы серебра нитрата.
Для стандартизации заполняют бюретку приготовленным титрованным раствором и титруют точно отмеренный объем стандартного титрованного раствора (вторичный стандарт) или точную навеску исходного стандартного вещества (реактив основной (РО); первичный стандарт). В ряде случаев при стандартизации точно отмеренный объем приготовленного титрованного раствора титруют стандартным титрованным раствором (вторичный стандарт).
Точку конца титрования (ТКТ) при стандартизации приготовленного титрованного раствора определяют тем же методом, которым она будет устанавливаться в методике количественного определения анализируемого ЛС согласно НД – по индикатору, методом потенциометрии, амперометрии и др. При стандартизации титрованного раствора должен быть использован тот же состав среды, в котором он будет использоваться.
Способ приготовления титрованного раствора, методика стандартизации, установочное вещество, температурный режим, скорость титрования (при необходимости), защита от воздействия окружающей среды (титрование в атмосфере инертного газа и др.), способ расчета концентрации и поправочного коэффициента (К) титрованного раствора приводится в статье на титрованный раствор соответствующего наименования в ОФС «Титрованные растворы».
Согласно ГОСТу для расчета концентрации приготовленного титрованного раствора в ГФ приведены 2 способа:
– по навеске химически чистого вещества (первичный стандарт);
– по титрованному раствору известной концентрации (вторичный стандарт).
На основании найденной истинной концентрации рассчитывают поправочный коэффициент к молярной концентрации (К) приготовленного титрованного раствора, который характеризует точность приготовления титрованного раствора.
Поправочный коэффициент показывает отношение реально полученной (экспериментально установленной) концентрации титрованного раствора к теоретически заданной или отношение его истинного и теоретического титров:
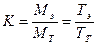
где Мэ, Мт – соответственно экспериментально установленная и теоретическая концентрация стандартизуемого титрованного раствора, М (моль/л); Тэ, Тт – соответственно истинное и теоретическое содержание растворенного вещества в стандартизуемом титрованном растворе, мг/мл.
Для обеспечения точности измерения молярной концентрации и поправочного коэффициента используют калиброванную посуду. При определении поправочного коэффициента проводят не менее трех параллельных титрований. Титрование ведут в конических колбах вместимостью 250 мл.
Если результаты титрования отличаются друг от друга менее чем на 0,05 мл, то для расчета К берут среднее арифметическое из полученных результатов. Если расхождения между отдельными титрованиями превышает 0,05 мл, то титрование повторяют до тех пор, пока не будут получены сходимые результаты.
Расхождение между коэффициентами поправки по каждой навеске установочного вещества (первичного стандарта) или по каждому объему раствора установочного вещества (вторичный стандарт) не должны превышать 0,001. Относительная погрешность определения поправочного коэффициента не должна превышать ±0,2%. Для этого следует титровать не менее 20,0-30,0 мл раствора (0,05·100/25 = 0,2%) и пользоваться мерными колбами и пипетками, предварительно проверенными на точность калибровки. Точность приготовления титрованных растворов является необходимым условием высокой точности титриметрических способов количественного определения фармацевтических субстанций и лекарственных средств.
Поправочный коэффициент нужно определять при 20 0 С. При этой же температуре рекомендуется проводить количественное определение титриметрическими методами с помощью титрованных растворов. Если титрованные растворы применяют при других температурах, то коэффициент поправки устанавливают при соответствующей температуре и используют температурную поправку.

Если титрованный раствор устойчив, соблюдены условия хранения и нет других указаний в НД, то коэффициент поправки проверяют один раз в месяц. В случае изменения титра титрованного раствора в процессе хранения под действием различных факторов окружающей среды (например, реактив Фишера, раствор иодмонохлорида, раствор иода), то согласно НД каждый раз перед применением заново определяют его титр (реактив Фишера) или параллельно проводят контрольный опыт на титрованный раствор.
Поправочный коэффициент согласно ГФ должен укладываться в интервал 0,9–1,1(т.е. отличаться от заданной концентрации не более чемна ±10%). В случаях, когда значения поправочных коэффициентов не укладываются в указанные пределы, растворы необходимо укрепить или разбавить.
Для РАЗБАВЛЕНИЯ титрованных растворов (поправочный коэффициент К больше 1,1) нужно добавить растворитель, рассчитав его объем по формуле:
V, мл = (К — 1,0) · (W – Wi) ; (8)
где V – объем растворителя, который нужно добавить для доведения поправочного коэффициента (К) до нормы, мл; W – заданный для приготовления объем титрованного раствора, мл; Wi – объем приготовленного титрованного раствора, израсходованный при установлении концентрации, мл.
Результат умножения соответствует количеству растворителя в мл, которое нужно прибавить к приготовленному раствору для доведения поправочного коэффициента (К) до требуемого значения.
ПРИМЕР:Поправочный коэффициент 500 мл 0,1 М раствора натрия гидроксида равен 1,15. Приведите расчет доведения поправочного коэффициента (К) до нормы.
РЕШЕНИЕ: Так как поправочный коэффициент (К) больше 1,10, то раствор следует разбавить, добавив воду в количестве:
(1,15 — 1,0) ·500 = 75 (мл).
ЗАКЛЮЧЕНИЕ: Раствор следует разбавить, добавив 75 мл воды.
Для УКРЕПЛЕНИЯ титрованного раствора (поправочный коэффициент К меньше 0,9) нужно добавить вещество, рассчитав его количество по формуле:
а, г = (1,0 – К) · m; (11)
где а– количество вещества, которое нужно добавить для доведения поправочного коэффициента до нормы, г; m– навеска вещества, взятая для приготовления заданного объема титрованного раствора, г.
ПРИМЕР:2000 мл 0,1 М раствора натрия гидроксида (Mr 40,0) приготовлены из навески массой 8,0 г (m). Поправочный коэффициент полученного раствора равен 0,85 (К). Приведите расчет доведения поправочного коэффициента (К) до нормы.
РЕШЕНИЕ: Раствор следует укрепить (поправочный коэффициент (К) меньше 1,0), добавив натрия гидроксид в количестве:
а, г = (1,0 – К) · m = (1,0 — 0,85) · 8 = 1,2.
ЗАКЛЮЧЕНИЕ: Раствор следует укрепить, добавив 1,2 г натрия гидроксида.
После добавления рассчитанного количества растворителя или исходного вещества проводят повторное (трехкратное) определение поправочного коэффициента. При соответствии поправочного коэффициента (К) требованиям ГФ титрованный раствор готов к употреблению.
Титрованные растворы, более разбавленные, чем представленные в ОФС «Титрованные растворы» (0,05; 0,02; 0,01; 0,001М), готовят непосредственно перед использованием путем разведения водой, свободной от углерода диоксида. При этом поправочные коэффициенты титрованных растворов для кислотно-основного и осадительного титрования, полученных путем разбавления более концентрированных исходных титрованных растворов, используют такие же, как и у исходных растворов.
Поправочные коэффициенты титрованных растворов для окислительно-восстановительного титрования, полученных путем разбавления более концентрированных исходных титрованных растворов, устанавливают заново.
Титрованные растворы готовят и хранят в стеклянных бутылках, склянках с тубусом, растворы щелочей – в полиэтиленовых бутылках, плотно закрытых пробками. Склянки с тубусом или бутыли для титрованных растворов светочувствительных веществ должны быть темного стекла или окрашены черным лаком.
Титрованные растворы следует тщательно оберегать от потери влаги и от разбавления водой, так как при этом изменяется их титр. Титрованные растворы хранят в помещениях при комнатной температуре в местах, защищенных от попадания прямых солнечных лучей, возможно дальше от источников тепла. При необходимости титрованные растворы защищают от воздействия углерода диоксида и влаги воздуха. При появлении капель испарившейся жидкости в верхней части бутылей с титрованным раствором бутыли необходимо тщательно взболтать. Титрованные растворы, в которых при хранении появились хлопья или осадок, применять нельзя.
На склянках с титрованными растворами должно быть указано название раствора, заданная молярная концентрация, коэффициент поправки, применяемый индикатор, дата (число, месяц, год) и температура установления поправочного коэффициента. Согласно ГОСТу допускается вместо заданной молярной концентрации и коэффициента поправки указывать значение точной молярной концентрации с четырьмя значащими цифрами после запятой.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник