Стандартизация титрантов в методе кислотно-основного титрования
Читайте также:
|
| Число тит-рований | Объем аликвоты раствора (Nа2В4О7 ), мл | Объем титранта (кислоты) по бюретке, мл | Среднее значение объема титранта, мл |
Затем проводят расчет молярной концентрации эквивалента и титра кислоты по среднему значению объема кислоты.
Лабораторная работа
Определение содержания щелочи в растворе
Целью работы является определение массы щелочи (NаОН) в растворе. Студент получает у преподавателя мерную колбу на 100.0 мл, в которую налито определенное количество щелочи. До риски в колбу добавляют дистиллированную воду, раствор тщательно перемешивается. В бюретку наливают кислоту, стандартизированную в предыдущей лабораторной работе. В коническую колбу для титрования отбирают пипеткой Мора 10.00 мл NаОН, прибавляют 1-2 капли индикатора метилоранжа и титруют раствором кислоты до появления оранжево-розовой окраски. Титруют до получения трёх сходимых результатов. Результаты записывают в таблицу, аналогичную в предыдущей работе. Рассчитывают нормальную концентрацию и титр щелочи, а также массу NаОН в 100.0 мл анализируемого раствора по вышеприведенным формулам (раздел 3.1).
Лабораторная работа
Определение кислотности квашеных овощей
При квашении овощей происходит молочнокислое брожение, в результате которого образуется молочная кислота 
Определение кислотности квашеных овощей сводится к титрованию их рассолов щелочью. Выражают кислотность в процентах молочной кислоты, которые показывают, сколько г молочной кислоты содержится в 100 г рассола. Например, реализуемая квашеная капуста должна иметь кислотность в зависимости от времени хранения от 0.7 до 2.4%
Методика эксперимента
В колбу для титрования наливают пипеткой 10.00 мл рассола, 3-5 капель фенолфталеина и оттитровывают раствором щелочи до появления устойчивой розовой окраски. Расчет кислотности рассола проводят по формуле:
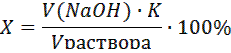
где Х – кислотность рассола в % молочной кислоты;
V(NaOH) – объем щелочи, пошедшей на титрование аликвоты рассола (мл), пересчитанный на концентрацию С (NaOH) = 0.1000 моль/л, по формуле
V(NaOH) = С (NaOH)практ ∙ V(NaOH)практ / 0.1000 ;
K – коэффициент пересчета на молочную кислоту, равный 0.00900 ;
Vраствора – объем рассола, взятый для титрования (мл).
3.3.5. Уровень требований по теме
«Метод нейтрализации»
В результате изучения темы «Метод нейтрализации» студент должен:
знать: сущность метода нейтрализации, типы кривых титрования, понятие о точке эквивалентности, теорию кислотно-основных индикаторов, правила выбора индикаторов кислотно-основного титрования;
уметь: готовить первичные и вторичные стандартные растворы, проводить стандартизацию растворов, собирать титровальную установку, правильно проводить титрование; рассчитывать нормальную концентрацию анализируемого раствора и его титр двумя способами;
владеть: современной химической терминологией в области метода нейтрализации, навыками работы с мерной посудой.
3.3.6. Контрольные задания 161-170
(метод нейтрализации)
161. а) Какой метод титриметрического анализа называется методом нейтрализации? Содержание каких веществ можно определять с помощью этого метода? Рассчитайте молярные массы эквивалента:
б) Проведена стандартизация раствора соляной кислоты. Для этого 5. 2060 г безводной соды Na2CO3 растворены в мерной колбе на 500.0 мл. Объём аликвоты раствора соды 25.00 мл, средний объём раствора кислоты по бюретке 26.18 мл. Рассчитать С(HCl), T(HCl), T(HCl/ Na2CO3).
162. а)Кривые титрования в методе нейтрализации и их типы. В общем виде изобразите их.
б) Навеску 0.3251 г технического NaOH растворили в мерной колбе ёмкостью 100.0 мл. На титрование 25.00 мл раствора израсходовано 18.40 мл 0.1000 н раствора HCl. Вычислите массовую долю NaOH в образце.
163. а) Какое практическое значение имеют кривые кислотно-основного титрования? Что такое скачок титрования? От чего зависит величина скачка титрования? В какой области рН лежит точка эквивалентности при титровании раствора слабого основания сильной кислотой?
б) Сколько мл раствора KOH с титром 0.01111 г/мл требуется для нейтрализации 25.00 мл раствора HCl с титром 0.007777 г/мл?
164. а) Что такое точка эквивалентности? Каким способом её фиксируют в методе нейтрализации? В какой области рН лежит точка эквивалентности при титровании раствора слабой кислоты сильным основанием?
б) На титрование 25.00 мл раствора Вa(OH)2 затрачено 23.61 мл раствора соляной кислоты с титром 0.004023 г/мл. Вычислить массу щелочи в 200.0 мл этого раствора.
165. а) Какие вещества называются кислотно-основными индикаторами? Константа диссоциации индикатора бромтимолового синего 1.6 · 10 –7 . Рассчитать интервал перехода его окраски и показатель титрования.
б) Сколько миллиграммов Na2CO3 содержится в растворе, если на нейтрализацию его до Н2CO3 идёт 23.00 мл 0.1025 н раствора HCl ?
166. а) Правила выбора кислотно–основных индикаторов. Скачок титрования лежит в интервале от рН=5 до рН= 9. Какие индикаторы можно выбрать для фиксирования точки эквивалентности, используя таблицу 7 в разделе « Приложения» ?
б) В агрохимическую лабораторию поступила склянка со щелочью со стёртой этикеткой. Титрование 1.100 г этого вещества потребовало 31.10 мл 0.8600 н раствора HCl. Какая щелочь КОН или NaOH была в склянке?
167. а)Бюретки. Основные правила работы с ними. Какова точность отсчётов по бюретке? В лабораторном журнале агрохимика представлены следующие замеры объёма кислоты по бюретке: 23.0 см 3 ; 23 см 3 ; 23.00 см 3 . Какая запись правильная? Почему?
б)Для определения точной концентрации раствора КОН навеску 2.3500 г щавелевой кислоты H2C2O4 растворили в колбе на 200.0 мл. На титрование 20.00 мл этого раствора затрачено 19.36 мл раствора КОН. Вычислите нормальную концентрацию и титр раствора щелочи.
168. а)Какие способы выражения концентрации растворов используются в титриметрическом анализе? Что означает T(HCl/ Na2CO3) = 0.001525 г/мл ?
б)Точную навеску буры Na2B4O7∙10 H2O массой 0.8714 г растворили в мерной колбе объемом 250.0 мл. На титрование 10.00 мл полученного раствора пошло 10.55 мл, 10.50 мл и 10.60 мл раствора азотной кислоты. Рассчитайте титр и молярную концентрацию эквивалента HNO3 в растворе.
169. а)Дайте определение понятий: титриметрический анализ, аналитический сигнал, титрование, стандартный раствор, первичные стандарты и требования к ним. Что служит аналитическим сигналом и первичным стандартом в методе нейтрализации?
б) Вычислить массу молочной кислоты CH3CH(OH)COOH в 400.0 мл раствора, если на 10.00 мл этого раствора израсходовано 12.50 мл раствора гидроксида натрия, Т(NaOH) = 0.001950 г/мл.
170. а)Какие методы различают в титриметрическом анализе в зависимости от типа химической реакции? Какие способы (приёмы) титрования применяются в этих методах? В чем сущность обратного титрования?
б)Какую массовую долю (%) карбоната натрия Na2CO3 содержит образец загрязненной соды, если на полную нейтрализацию 0.2648 г соды израсходовано 24.45 мл 0.1970 н раствора HCl?
Источник




