- Особенности культивирования анаэробных бактерий
- Особенности культивирования и выделения аэробных и анаэробных бактерий
- Биология для студентов – 24. Культивирование аэробных и анаэробных микроорганизмов
- 24. Культивирование аэробных и анаэробных микроорганизмов
- Культивирование аэробных микроорганизмов
- Способы культивирования микроорганизмов
- Особенности культивирования анаэробных бактерий
- Анаэробы – это бактерии. Особенности анаэробов, классификация и методы культивирования
- Классификация анаэробов
- Анаэробное деструктивное сообщество бактерий
- Физические методы
- Использование химических веществ
- Выделение чистой культуры
- Микробиология – Методы культивирования анаэробов
- Анаэробы
Особенности культивирования анаэробных бактерий
Важным условием, которое необходимо соблюдать на всех этапах выделения и идентификации анаэробов, является защита этих микробов от токсического действия молекулярного кислорода. Время между взятием материала и его посевом на питательные среды должно быть максимально коротким.
Анаэробные бактерии можно культивировать только на специальных бескислородных средах с низким окислительно-восстановительным потенциалом (10 — 150мВ). Для контроля за степенью насыщения этих сред кислородом используют специальные редокс — индикаторы (метиленовый синий, резазурин), восстановленные формы которых бесцветны. При возрастании окислительно-восстановительного потенциала (ОВП) метиленовый синий окрашивает среды в синий, а резазурин — в розовый цвет, что указывает на непригодность таких сред для культивирования облигатных анаэробов. Для сохранения низкого ОВП питательные среды должны быть агаризированы. Добавление даже 0,05% агара повышает их вязкость и уменьшает аэрацию.
Анаэробный тип энергетического метаболизма во много раз менее продуктивный, чем аэробный, поэтому питательные среды для анаэробов должны быть богаче питательными субстратами и витаминами. В практических лабораториях для выделения анаэробов из патологического материала чаще всего используют среду для контроля стерильности крови (СКС), среду Китта-Тароцци, анаэробный кровяной агар (на основе эритрит-агара или агара Д), среду Вильсона — Блера, среду Шедлера и др. Эти свежеприготовленные питательные среды должны быть использованы для посева в течение 2-х часов во избежание насыщения кислородом.
Методы создания анаэробных условий. Создание анаэробных условий достигается с помощью физических, химических, биологических и смешанных методов.
Физические методы. Основаны на выращивании микроорганизмов в безвоздушной среде, что достигается:
1. посевом в среды, содержащие редуцирующие и легко окисляемые вещества; В качестве редуцирующих веществ обычно используют кусочки (около 0,5 г) животных тканей (печень, мозг, почки, селезенка, кровь). Эти ткани связывают растворенный в среде кислород и адсорбируют бактерии. Чтобы уменьшить содержание кислорода в питательной среде, ее перед посевом кипятят 10-15 мин, а затем быстро охлаждают и заливают сверху небольшим количеством стерильного вазелинового масла. В качестве легко окисляемых веществ используют глюкозу, лактозу и муравьинокислый натрий. Лучшей жидкой питательной средой с редуцирующими веществами является среда Китта-Тароцци, которая используется для накопления анаэробов при первичном посеве из исследуемого материала и для поддержания роста выделенной чистой культуры анаэробов.
2. посевом микроорганизмов в глубину плотных питательных сред. Посев микроорганизмов в глубину плотных сред производят по методу Вейнберга
Метод Вейнберга. 1-2 капли материала со среды Кита-Тароцци вносят в пробирку с МПБ для разведения. Затем пастеровской пипеткой с запаянным концом переносят материал последовательно в 3-5 узких пробирок с сахарным МПА, предварительно расплавленным и прокипяченным в течение 20 мин и остуженным до 50°С, погружая капилляр пипетки в расплавленный агар до дна пробирки. Засеянные пробирки быстро охлаждают под струей холодной воды, при этом агар застынет и зафиксирует разобщенное положение отдельных микробных клеток. Инкубируют в анаэробных условиях. Через сутки отбирают колонии, на уровне колонии пробирку распиливают, колонию отсасывают пипеткой и переносят в среду Китта-Троцци для накопления и идентификации.
3. механическим удалением воздуха из сосудов, в которых выращиваются анаэробные микроорганизмы; Удаление воздуха производят путем его механического откачивания их специальных приборов — анаэростатов, в которые помещают чашку с посевом анаэробов. Переносной анаэростат представляет собой толстостенный металлический или пластиковый цилиндр с хорошо притертой крышкой (с резиновой прокладкой), снабженный отводящим краном и вакуумметром. После размещения засеянных чашек или пробирок воздух из анаэростата удаляют с помощью вакуумного насоса.
4. заменой воздуха в сосуде каким-либо индифферентным газом. Замену воздуха индифферентным газом (азотом, водородом, аргоном, С02) можно производить в анаэростатах путем вытеснения его газом из баллона.
Приборы и среды для культивирования анаэробов:
Микроанаэростат — используется для создания вакуума с дозированным содержанием кислорода. Прибор представляет собой герметически закрывающийся сосуд, снабженный манометром, в который помещают посевы и откачивают воздух. Микроанаэростат помещают в термостат.
Эксикатор — стеклянный лабораторный сосуд с притертой крышкой. В его донной части имеется дополнительная емкость, куда наливается смесь пирогаллола и едкого натра или гидросульфита натрия и двууглекислой соды. На сетку-подставку помещают посевы и притирают крышку с помощью вазелина. Эксикатор помещают в термостат.

Винтовой зажим с герметичной прокладкой
Рис. 9 Газогенераторные пакеты
Система Generbag anaer состоит из воздухонепроницаемых емкостей, изготовленных из прозрачной пластмассы и генераторов, содержащих смесь веществ, поглощающих кислород (рис. 9). При применении GasPak Plus необходимо увлажнить таблетку боргидрида натрия, при этом выделяется водород и в присутствии палладиевого катализатора он соединяется с кислородом с образованием воды. Последовательность работы: вынуть генератор из пакета, поместить в нижнюю часть воздухонепроницаемого пакета, затем поместить чашки (или пробирки) с посевами и закрыть пакет. Инкубация при 37°С.
Анаэробный бокс — прозрачная плексиглассовая камера со шлюзом, отверстиями для рук с рукавами, заканчивающимися резиновыми перчатками. В нем создаются стерильные условия, его заполняют газовой смесью и поддерживают температуру 37°С.
Среда Китта-Тароцци. Содержит мясо-пептонный бульон (МПБ), 0,5% глюкозы и 0,15% агара. На дно пробирки для адсорбции О2 помещают кусочки вареной печени или фарша слоем 1-1,5 см и заливают 6-7 мл среды. Среду перед посевом регенерируют (прогревают 15-20 мин на водяной бане для удаления воздуха, а затем быстро охлаждают). После посева среду заливают вазелиновым маслом и помещают в термостат.
Полужидкий сахарный агар (высокий столбик). В пробирку с 6-7 мл расплавленного и охлажденного до 40-45 0 полужидкого питательного агара, содержащего 0,5-1% глюкозы, вносят исследуемый материал и перемешивают. Посевы помещают в термостат.
Химические методы. Основаны на поглощении кислорода воздуха в герметически закрытом сосуде (анаэростате, эксикаторе) такими веществами, как пирогаллол или гидросульфит натрия.
1. Применение щелочных растворов пирогаллола для поглощения кислорода в замкнутой воздушной среде.
2. Можно применять гидросульфит натрия. Для связывания кислорода в 1 л объема берут 100 мл свежеприготовленного 20% раствора Na2S204и 16 мл 50% КОН.
3. Использование веществ — редуцентов, к которым относятся тиогликолевая кислота или тиогликолат натрия (0,01-0,02%), аскорбиновая кислота (0,1%), различные сахара (0,1-3%), цистин и цистеин (0,03-0,05%), муравьинокислый натрий (0,25-0,75%) и др.
Применение газогенерирующих систем для создания анаэробных условий в замкнутой воздушной среде (микроанаэростатах, эксикаторах, прозрачных газонепроницаемых пластиковых пакетах). Для образования водорода и двуокиси углерода, необходимых для роста облигатных анаэробов, используют специальные таблетки, которые активируются добавлением воды. Водород, генерируемый таблетками боргидрида натрия, связывает кислород воздуха в присутствии палладиевого катализатора с образованием воды. Углекислый газ вырабатывается при взаимодействии лимонной кислоты с бикарбонатом натрия.
Биологические методы
1. Совместное выращивание анаэробов и аэробов (метод Фортнера). При этом на одну половину чашки Петри с плотной питательной средой засевают исследуемый материал, а на другую — культуру аэробного микроорганизма, способного энергично поглощать кислород. После посева чашку закрывают крышкой, края которой для герметизации заливают парафином или заклеивают пластилином. В качестве активного поглотителя кислорода из замкнутого пространства часто используют культуру “чудесной палочки” (Serratia marcescens), которая является своеобразным индикатором качества анаэробиоза. При недостаточной герметизации чашки этот микроорганизм образует ярко-красный пигмент, а при сохранении строго анаэробных условий вырастают бесцветные или бледно-розовые колонии.
2. Помещение в питательную среду кусочков печени, головного мозга, почек и других внутренних органов. При этом тканевые клетки активно поглощают и адсорбируют на себе кислород, в результате чего в среде создаются анаэробные условия. Примером питательной среды, сконструированной по этому принципу, является содержащая кусочки печени среда Китта — Тароцци. К тому же в печеночной ткани содержится большое количество веществ с SH-группой (цистеин, глютатион и др.), обладающих сильным редуцирующим действием.
3. Культуры некоторых облигатных анаэробов можно поддерживать путем пассажа на лабораторных животных, однако в настоящее время этот метод используется достаточно редко.
Комбинированные методы основаны на сочетании физических, химических и биологических методов создания анаэробиоза, и используются в большинстве практических лабораторий. Для работы с наиболее чувствительными к молекулярному кислороду анаэробами используют строгую анаэробную технику (метод Хангейта). Принцип метода заключается в использовании лишенных кислорода питательных сред, воздух над которыми удаляется и замещается бескислородным газом.
III. План практической работы
1. Изучить аппаратуру для стерилизации, культивирования бактерий аэробов и анаэробов, зарисовать схему устройства микроанаэростата
2. Изучить технику и зарисовать схемы посевов исследуемого материала на питательные среды с целью получения изолированных колоний
3. Выписать цель и схему бактериологического метода исследования
4. Ознакомиться с питательными средами и заполнить таблицу «Питательные среды».
5. Заполните таблицу «Основные методы стерилизации»
6. Посеять смесь бактерий истощающим штрихом на МПА с целью выделения чистой культуры
7. Решить ситуационные задачи
IV. Примеры ситуационных задач
Ситуационная задача № 1
Из материала больного выделили кишечную палочку. Какие питательные среды используют для того, чтобы выделить чистую культуру и отличить ее от других представителей кишечной микрофлоры:
1. Дифференциально-диагностические среды
2. Универсальные среды
3. Среды обогащения
4. Синтетические среды
Ситуационная задача № 2
Для проведения бактериологических исследований необходимо подготовить стерильные чашки Петри, пипетки, колбы и др. посуду. Какой метод стерилизации используют:
1. Стерилизацию сухим жаром
2. Стерилизацию облучением
3. Химическую стерилизацию
4. Стерилизацию текучим паром
Ситуационная задача № 3
Из больного с опасением на анаэробную инфекцию взяли материал (раневой экссудат). Какие среды используют для культивирования возбудителя:
1. Среду Китта-Тароцци
2. Среду Вильсона — Блера
3. Среду Плоскирева
Ситуационная задача № 4
Врач-бактериолог в мазке из исследуемого материала выделил смесь нескольких микроорганизмов. Что необходимо для дальнейшей идентификации возбудителя:
1. Получение чистых культур микроорганизмов
2. Посев исследуемого материала на среду накопления
3. Произвести реакцию агглютинации с поливалентными сыворотками
4. Произвести посев материала на ряд Гиса
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Источник
Особенности культивирования и выделения аэробных и анаэробных бактерий
Биология для студентов – 24. Культивирование аэробных и анаэробных микроорганизмов
24. Культивирование аэробных и анаэробных микроорганизмов
Поскольку микроорганизмы по-разному относятся к молекулярному кислороду, это определяет и различия в способах их культивирования.
Культивирование аэробных микроорганизмов проводят следующим образом:
- на поверхности плотных сред или в тонком слое жидких сред, когда микроорганизмы получают кислород непосредственно из воздуха;
- в жидких средах (глубинное культивирование). В этом случае микроорганизмы используют растворенный в среде кислород. В связи с низкой растворимостью кислорода, для обеспечения роста аэробных бактерий в толще среды, требуется постоянное аэрирование.
Культивирование анаэробных микроорганизмов более сложно, чем выращивание аэробов, так как здесь должен быть сведен до минимума контакт микроорганизмов с молекулярным кислородом. Для создания анаэробных условий используют различные приемы. Их подразделяют на физические, химические и биологические. Все они основаны на том, что микроорганизмы культивируют в каком-то замкнутом пространстве.
К физическим методам создания анаэробных условий относится культивирование в микроанаэростате – вакуумном аппарате для выращивания микроорганизмов, в котором воздух замещен газовой смесью. Наиболее часто используемая смесь имеет следующий состав: азот с 5% СО2 и 10% Н2.
К химическим методам относится:
- Использование химических веществ, поглощающих молекулярный кислород. В качестве поглотителей молекулярного кислорода в лабораторной практике используют щелочной раствор пирогаллола, дитионит натрия (Na2S2O4), металлическое железо, хлорид одновалентной меди и некоторые другие реактивы.
- Использование восстанавливающих агентов, которые добавляют в большинство сред для снижения окислительно-восстановительного потенциала среды: тиогликолат натрия, цистеин, аскорбиновая кислота.
Как пример биологического способа создания анаэробных условий – выращивание совместно с аэробными или факультативно-анаэробными бактериями.
Например, питательную среду в чашке Петри разделяют желобком на две половины, на одну половину засевают какой-либо аэробный микроорганизм, на другой – анаэроб. Края чашки заливают парафином.
Рост анаэробного микроорганизма начнется только после полного использования кислорода аэробом.
Для культивирования анаэробных бактерий используют и другие методы, ограничивающие доступ воздуха к растущей культуре:
- выращивание в высоком слое среды;
- выращивание в толще плотной среды;
- культивирование в вязких средах, в которых диффузия молекулярного кислорода в жидкость уменьшается с увеличением ее плотности;
- заливка среды с посевом высоким слоем стерильного вазелинового масла или парафина.
Культивирование аэробных микроорганизмов
Культивирование на поверхности плотных и жидких сред. В этом случае микроорганизмы выращивают на поверхности плотной среды или в тонком слое жидкой среды, и кислород поступает к ним непосредственно из воздуха. При поверхностном культивировании важно увеличить площадь соприкосновения среды с воздухом.
Для этого среды наливают тонким слоем в посуду с широким дном — чашки Петри, колбы Виноградского, матрацы (см. рис. 30). В жидких средах аэробные микроорганизмы часто растут, образуя на поверхности пленку. Факультативные анаэробы развиваются не только на поверхности, но и в толще жидкой среды, вызывая более или менее равномерное ее помутнение.
Поверхностное культивирование микроорганизмов применяется как в лабораторных условиях, так и в промышленности.
Глубинное культивирование в жидких средах. Все способы глубинного культивирования аэробных микроорганизмов сводятся к увеличению поверхности соприкосновения питательной среды с кислородом воздуха.
Следует иметь в виду, что при глубинном культивировании в жидких средах микроорганизмы используют растворенный кислород.
Вместе с тем растворимость кислорода в воде невелика, поэтому, чтобы обеспечить рост аэробных микроорганизмов в толще среды,- ее необходимо постоянно аэрировать. При аэрировании среды учитывают два показателя: интенсивность аэрации и степень аэрации.
Интенсивность аэрации характеризуется скоростью растворения кислорода в единице объема культу-ральной среды за единицу времени. Степень аэрации — это объем воздуха, продуваемый через определенный объем среды за единицу времени.
Наиболее простой и широко распространенный в лабораторной практике способ глубинного культивирования — выращивание на качалках, обеспечивающих встряхивание или вращение колб или лробирок со скоростью 100—200 и более оборотов в минуту. Чем больше скорость вращения, тем больше соприкосновение среды с воздухом и выше насыщение ее кислородом.
Увеличить аэрацию среды при работе на одной и той же качалке можно уменьшением объема среды или применением колб с отбойниками — вдавливаниями внутрь в виде 4—8 отростков 2—3 см длиной При вращении колб с отбойниками поверхность соприкосновения среды с воздухом заметно увеличивается благодаря разбрызгиванию жидкости Чем больше отбойников, тем сильнее разбрызгивание жидкости, тем выше аэрация.
Интенсивность аэрации при выращивании микроорганизмов на качалках характеризуют, как правило, скоростью поглощения кислорода водным раствором сульфита. Раствор сульфита наливают в сосуды для культивирования вместо питательной среды и через определенные промежутки времени .
измеряют количество окисленного сульфита в тех же условиях аэрации, при которых выращиваются исследуемые микроорганизмы. Сульфитный метод не дает возможности определить концентрацию кислорода в культуре. Концентрацию кислорода, растворенного в культуральной жидкости, определяют полярографически.
Помимо перемешивания аэрировать культуру микроорганизмов можно продуванием через толщу среды стерильного воздуха. Этот способ часто используют в лабораторных исследованиях, но особенно широкое применение он нашел в промышленной микробиологии при получении биомассы и различных продуктов жизнедеятельности микроорганизмов — антибиотиков, ферментов, кислот.
Скорость протекания воздуха через среду необходимо контролировать. Для этого используют различные приборы: газовые часы, ратометры и др. В ферментерах количество пропускаемого воздуха поддерживают на заданном уровне автоматически. Воздух стерилизуют путем прохождения через активированный древесный уголь, стеклянную вату, пропитанную антисептиком, или специальные ткани из полимеров.
опытах, когда объем и скорость поступления воздуха невелики, используют заранее простерилизованные ватные фильтры. Для возможно более сильного распыления воздух пропускают через мелкопористые пластинки ■— барботеры; в лабораторных опытах с этой целью применяют стеклянные фильтры.
Для аэрации культур микроорганизмов, как правило, используют обычный воздух. Продувание сред кислородом в лабораторных условиях не рекомендуется, так как чрезмерное насыщение среды кислородом (до 40 мг/л) может привести к угнетению роста микроорганизмов.
В ферментерах принудительную аэрацию обычно совмещают с механическим перемешиванием среды мешалками, скорость вращения которых может достигать сотен и даже тысяч оборотов в минуту. Выращивание в высоком слое среды. Это наиболее простой, способ ограничения доступа воздуха к клеткам микроорганизмов.
Жидкую среду наливают в сосуды для культивирования высоким слоем. Так как нельзя стерилизовать среды, если они занимают более половины высоты сосуда, часть среды стерилизуют отдельно и стерильно доливают ею сосуд для культивирования сразу же после посева.
Непосредственно перед посевом среду кипятят иди прогревают на кипящей водяной бане 30—40 мин, затем быстро охлаждают, чтобы в ней не успел раствориться кислород воздуха, и вносят на дно посевной материал.
Культивирование в вязких средах. Диффузия кислорода в жидкость уменьшается с увеличением ее вязкости. Поэтому в вязких средах, таких .
как картофельная или среды с кукурузной либо другой мукой, хорошо развиваются некоторые облигатные анаэробы, например, возбудители маслянокислого или ацетонобу-тилового брожения.
Вязкость жидких сред легко увеличить, если добавить к ним 0,2—0,3% агара.
Выращивание в толще плотной среды. Этим приемом пользуются для получения изолированных колоний при выделении чистых культур или определении численности анаэробных микроорганизмов.
Посевной материал вносят в расплавленную и остуженную до 48—50° агаризованную, желательно осветленную среду, тщательно перемешивают и оставляют в пробирках или переливают стерильной пипеткой в заранее простерилизованные трубки Бурри или чашки Петри.
Поверхность среды в пробирках заливают парафином. Трубки Бурри — это стеклянные трубки длиной 20—25 см, диаметром 1,0—1,5 см. Трубки стерилизуют, закрыв оба конца ватными пробками.
Перед посевом ватную пробку у одного конца заменяют стерильной резиновой, через другой конец трубки вносят среду с посевным материалом и закрывают также резиновой пробкой (рис. 38).
При использовании чашек Петри для выращивания анаэробов засеянную агаризованную среду наливают в крышку чашки и, после того как среда застынет, плотно прижимают к ее поверхности дно чашки. Зазор между стенками дна и крышки, где среда соприкасается с воздухом, заливают стерильным парафином
Выращивание в анаэростатах. Анаэробные микроорганизмы можно выращивать в анаэростатах — вакуумных металлических камерах, снабженных манометром. Анаэростатом может служить обычный вакуумный стеклянный эксикатор.
Из анаэростата откачивают воздух, а затем, как правило, заполняют его газовой смесью, состоящей из азота (90—80%) и углекислоты (10—20%), до давления порядка 67-Ю3 Па (500 мм рт. ст.).
Избыточное давление исключает возможность диффузии кислорода воздуха.
Некоторые строгие анаэробы, например, метанобразующие бактерии, ацетогены, некоторые грибы, расщепляющие целлюлозу, микроорганизмы рубца жвачных животных, погибают даже при кратковременном контакте с кислородом воздуха. Работа с такими микроорганизмами представляет большие трудности и требует специального оборудования.
Для культивирования строгих (обли-гатных, экстремальных) анаэробов необходимо применять методы, позволяющие исключать молекулярный кислород из сред культивирования, создавать и поддерживать в них низкий окислительно-восстановительный потенциал (ОВП).
С этой целью используют технику, разработанную профессором Хангейтом (Hun-gate): 1) среды для выращивания микроорганизмов и все добавки в них готовят перед автоклавированием с максимальной защищенностью от контакта с кислородом (кипячение и т. д.
); 2) после авто-клавирования среды и добавки для них немедленно охлаждают в токе стерильного газа, освобожденного от следов кислорода пропусканием над медными стружками, нагретыми до 350—400 °С; 3) до посева микроорганизмов в среды добавляют восстановители (цистеин, сульфид натрия, тиогликолат в щелочной среде) для химического поглощения следов кислорода, диффундирующего в сосуды для культивирования даже через резиновые пробки; 4) посевы, разлив сред, в том числе агаризованных, проводят в токе стерильного газа, не содержащего кислорода; 5) микроорганизмы выращивают и поддерживают в герметически закрытых сосудах, в атмосфере бескислородного газа, часто под давлением для исключения проникновения воздуха; 6) все шланги, по которым идут газы для продувки сосудов, должны быть из специальной резины, со слабой степенью диффузии кислорода воздуха, или заменены на металлические трубки; 7) все пересевы и добав’ки в среды проводят с помощью шприцев, продутых газом, не содержащим кислорода.
Степень поглощения кислорода и восстановленности среды определяется окислительно-восстановительным потенциалом Eh, который может быть измерен электрометрически на потенциометре или с помощью индикаторных красителей, например, резазурина, феносафранина, нейтрального красного и т. д., изменяющих окраску при изменении Eh.
Особенно удобен резазурин, который добавляют к средам в концентрации 0,0001 % и стерилизуют вместе с минеральными компонентами среды. В окисленной форме он окрашен в голубой цвет, при восстановлении цвет меняется на слабо-розовый, полностью восстановленная форма бесцветна.
Ре-зазурин изменяет окрраску при значениях ОВП, близких к—420″ мВ, феносафранин — в области —252 мВ.
Для культивирования анаэробов предложены специальные камеры и система ГазПак (ОазРак), образующая газы (водород и СОг) в замкнутом пространстве и эффективно поглощающая кислород.
В качестве поглотителя кислорода в лабораторной практике используют щелочной раствор пирогаллола, дитионитанатрия, металлическое железо и некоторые другие реактивы. При этом необходимо учитывать поглощающую способность реактивов и объем замкнутого пространства, в котором выращивают микроорганизм.
Например, на каждые 100 мл емкости используют 1 г пирогаллола и 10 мл 2,5 н. раствора гидроксдода натрия. Поскольку многие анаэробы нуждаются в углекислоте, пирогаллол часто растворяют не в щелочи, а в насыщенном растворе бикарбоната натрия.
Полноту поглощения кислорода контролируют раствором, содержащим окислительно-восстановительный индикатор. Для приготовления раствора смешивают равные объемы 0,024%-ного ЫаОН, 0,015%-ного водного метиленового синего и 6%-ной глюкозы; в качестве антисептика к раствору добавляют тимол.
Перед использованием в пробирку наливают 5 мл смеси и нагревают на кипящей водяной бане до обесцвечивания, быстро охлаждают и помещают в анаэростат. В анаэробных условиях раствор остается бесцветным.
В качестве восстановителя чаще всего используют сульфид и тиогликолат натрия. Обычно готовят 1%-ные растворы этих восстановителей в 5%-ном растворе бикарбоната натрия, стерилизуют автоклавированием и добавляют к средам сульфид натрия из расчета 250—500 мг/л, а тиогликолат — до 250 мг/л среды. Восстановители используют в концентрациях, не влияющих иа рост микроорганизмов.
Для культивирования строгих анаэробов предложены специальные камеры, заполненные газовыми смесями (чаще всего 90%’ N2, 5% С02 и 5% Н2), которые содержат внутри все необходимое для выполнения микробиологических работ, включая термостат. Это оборудование сложно и дорого, но оно имеет одно неоспоримое преимущество —■ контакт клеток с кислородом воздуха остается минимальным почти на всех этапах работы.
Билет №16
Воспользуйтесь поиском по сайту:
Способы культивирования микроорганизмов
⇐ ПредыдущаяСтр 6 из 15Следующая ⇒
1 Понятие о культивировании микроорганизмов
2 Способы культивирования аэробных и анаэробных микроорганизмов
3 Техника посева микроорганизмов в жидкие питательные среды
4 Техника посева микроорганизмов на агаризованную среду
Понятие о культивировании микроорганизмов
Культивирование микроорганизмов, помимо состава питательной среды, сильно зависит от физических и химических факторов (температуры, кислотности, аэрации, света и т. д.). При этом количественные показатели каждого из них неодинаковы и определяются особенностями метаболизма каждой группы бактерий.
Можно выделить методы культивирования на твердых и в жидких питательных средах; в аэробных, анаэробных и микроаэрофильных условиях. Характеристики этого процесса устанавливают путем измерения таких показателей как число клеток или их биомасса.
В лаборатории микроорганизмы выращивают на плотных и жидких питательных средах, которые разливают в пробирки, колбы, матрасы и чашки Петри. Посуду и питательные среды предварительно стерилизуют различными методами.
Внесение микроорганизмов в стерильную среду называется посевом, или инокуляцией.
Посев микроорганизмов требует соблюдения определенных правил, которые необходимо выполнять, чтобы предохранить исследуемую культуру от загрязнения посторонними микроорганизмами. Перед посевом следует сделать надписи на посуде.
Клетки микроорганизмов для посева или приготовления препаратов берут бактериологической петлей или иглой, если микроорганизмы выращивали на плотной среде.
В случае, когда микроорганизмы выращены в жидкой среде, лучше пользоваться пипеткой.
После пересева пробирки или другие сосуды с микроорганизмами помещают в термостаты с определенной температурой.
По окончании работы посуду с культурами микроорганизмов, подлежащими выбрасыванию, следует автоклавировать, чтобы убить клетки, и только после этого мыть. Допускается заливать дезинфицирующим раствором поверхность плотных сред. Через сутки среды можно выбрасывать и посуду мыть. Неаккуратное обращение с культурами микроорганизмов приводит к возникновению бактериального аэрозоля.
Способы культивирования аэробных и анаэробных
Микроорганизмов
Культивирование аэробных микроорганизмовпроводят следующим образом:
– на поверхности плотных сред или в тонком слое жидких сред, когда микроорганизмы получают кислород прямо из воздуха;
– в жидких средах (глубинное культивирование). В этом случае микроорганизмы используют растворенный в среде кислород. В связи с низкой растворимостью кислорода, для обеспечения роста аэробных бактерий в толще среды, требуется постоянное аэрирование.
Наиболее простой и широко используемый в лабораторной практике способ глубинного культивирования – выращивание на шейкерах, обеспечивающих встряхивание колб или пробирок со скоростью 100–200 об/мин и более. Помимо перемешивания, аэрировать культуру микроорганизмов можно продуванием под давлением через толщу среды стерильного воздуха.
Граница между аэробными и анаэробными микроорганизмами является относительно условной. Хотя облигатными анаэробами обычно считают бактерии, рост которых невозможен в присутствии растворенного кислорода, на практике к анаэробным относят те бактерии, которые не растут на поверхности твердой или полужидкой среды на воздухе при атмосферном давлении.
Аэротолерантные бактерии хорошо растут на поверхности агара и чашках при низком уровне кислорода. Степень анаэробиоза измеряется по окислительно-восстановительному (редокс, Eh) потенциалу среды.
При увеличении Eh выше 100 мВ, обусловленном присутствием растворимого кислорода, подавляется рост всех анаэробных бактерий.
Для удаления кислорода и создания соответствующих условий среды можно воспользоваться следующими методами:
1 Культивирование в микроанаэростате – аппарате для выращивания микроорганизмов, в котором воздух замещен газовой смесью. Наиболее часто используемая смесь имеет следующий состав: азот с 5 % СО2 и 10 % Н2.
2 Использование химических веществ, поглощающих молекулярный кислород.
В качестве поглотителей молекулярного кислорода в лабораторной практике используют щелочной раствор пирогаллола, дитионит натрия (Na2S2O4), металлическое железо, хлорид одновалентной меди и некоторые другие реактивы.
Поглотители помещают на дно химического эксикатора с притертой крышкой, а также анаэробные бактерии, засеянные в колбу, пробирку или чашку Петри. При таком способе создания анаэробных условий необходимо учитывать поглощающую способность реактивов и объем замкнутого пространства, в котором выращиваются бактерии.
3 Использование восстанавливающих агентов, которые добавляют для снижения окислительно-восстановительного потенциала среды: тиогликолат натрия, цистеин, дитиотрейтол, аскорбиновая кислота.
Удаления кислорода из среды можно добиться и в результате быстрого нагревания и кипячения среды с последующим быстрым охлаждением.
Если в такую среду засеять анаэробные микроорганизмы и наслоить смесь (1:1) масла и парафина, то в подобных условиях будет наблюдаться рост нестрогих анаэробов.
4 Выращивание совместно с аэробными или факультативно-анаэробными бактериями. В жидкой среде с восстанавливающими агентами перед инокуляцией анаэроба проводят культивирование, например, E.coli, что приводит к удалению из среды остаточного кислорода. Перед инокуляцией анаэробов клетки E.coli убивают нагреванием.
Существует и другая модификация метода. На половине чашки Петри засевают какой-либо аэробный микроорганизм, на другой – анаэроб. Края чашки заливают парафином. Рост анаэробного микроорганизма начнется после полного использования кислорода аэробом.
Для культивирования анаэробных бактерий используют и другие методы, ограничивающие доступ воздуха к растущей культуре:
– выращивание в высоком слое среды;
– выращивание в толще плотной среды;
– культивирование в вязких средах, в которых диффузия молекулярного кислорода в среду уменьшается с увеличением ее плотности;
– заливка среды с посевом высоким слоем стерильного вазелинового масла или парафина.
©2015 arhivinfo.ru Все права принадлежат авторам размещенных материалов.
Особенности культивирования анаэробных бактерий
Важным условием, которое необходимо соблюдать на всех этапах выделения и идентификации анаэробов, является защита этих микробов от токсического действия молекулярного кислорода. Время между взятием материала и его посевом на питательные среды должно быть максимально коротким.
Анаэробные бактерии можно культивировать только на специальных бескислородных средах с низким окислительно-восстановительным потенциалом (10-150 мВ). Для контроля за степенью насыщения этих сред кислородом используют специальные редокс — индикаторы (метиленовый синий, резазурин), восстановленные формы которых бесцветны.
При возрастании окислительно-восстановительного потенциала (ОВП) метиленовый синий окрашивает среды в синий, а резазурин — в розовый цвет, что указывает на непригодность таких сред для культивирования облигатных анаэробов. Для сохранения низкого ОВП питательные среды должны быть агаризированы.
Добавление даже 0,05% агара повышает их вязкость …
и уменьшает аэрацию.
Анаэробный тип энергетического метаболизма во много раз менее продуктивный, чем аэробный, поэтому питательные среды для анаэробов должны быть богаче питательными субстратами и витаминами.
В практических лабораториях для выделения анаэробов из патологического материала чаще всего используют среду для контроля стерильности крови (СКС), среду Китта-Тароцци, анаэробный кровяной агар (на основе эритрит-агара или агара Д), среду Вильсона — Блера, среду Шедлера и др.
Эти свежеприготовленные питательные среды должны быть использованы для посева в течение 2-х часов.
Методы создания анаэробных условий.Создание анаэробных условий достигается с помощью физических, химических, биологических и смешанных методов.
Физические методы.Основаны на выращивании микроорганизмов в безвоздушной среде, что достигается:
1. Посевом в среды, содержащие редуцирующие и легко окисляемые вещества; В качестве редуцирующих веществ обычно используют кусочки (около 0,5 г) животных тканей (печень, мозг, почки, селезенка, кровь).
Эти ткани связывают растворенный в среде кислород и адсорбируют бактерии. Чтобы уменьшить содержание кислорода в питательной среде, ее перед посевом кипятят 10-15 мин, а затем быстро охлаждают и заливают сверху небольшим количеством стерильного вазелинового масла.
В качестве легко окисляемых веществ используют глюкозу, лактозу и муравьинокислый натрий.
Лучшей жидкой питательной средой с редуцирующими веществами является среда Китта-Тароцци, которая используется для накопления анаэробов при первичном посеве из исследуемого материала и для поддержания роста выделенной чистой культуры анаэробов.
2. Посевом микроорганизмов в глубину плотных питательных сред. Посев микроорганизмов в глубину питательных сред производят по методам Вейнберга и Виньяль-Вейона.
3. Механическим удалением воздуха из сосудов, в которых выращиваются анаэробные микроорганизмы. Удаление воздуха производят путем его механического откачивания из специальных приборов — анаэростатов, в которые помещают чашку с посевом анаэробов.
Переносной анаэростат представляет собой толстостенный металлический или пластиковый цилиндр с хорошо притертой крышкой (с резиновой прокладкой), снабжённый отводящим краном и вакуумметром.
После размещения засеянных чашек или пробирок воздух из анаэростата удаляют с помощью вакуумного насоса.
4. Заменой воздуха в сосуде каким-либо индифферентным газом. Замену воздуха
индифферентным газом (азотом, водородом, аргоном, С02) можно производить в анаэростатах
вытеснения его газом из баллона.
Приборы и среды для культивированияанаэробов:
Микроанаэростат — используется для создания вакуума с дозированным содержанием
кислорода. Прибор представляет собой герметически закрывающийся сосуд, снабженный
нанометром, в который помещают посевы и откачивают воздух. Микроанаэростат помещают
Эксикатор — стеклянный лабораторный сосуд с притертой крышкой. В его донной части
имеется дополнительная емкость, куда наливается смесь пирогаллола и едкого натра или,
гидросульфита натрия и двууглекислой соды. На сетку-подставку помещают посевы и притирают
крышку с помощью вазелина. Эксикатор помещают в термостат.
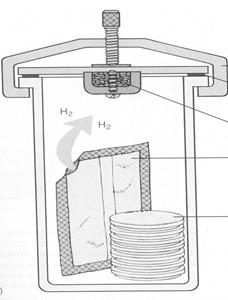
Газ-пак (Generbag anaer). Для создания анаэробных условий используются газогенераторные пакеты с реагентами — GasPak, GasPak Plus (газогенераторный пакет с палладиевым катализатором) и другие.
Рис. 9. Газогенераторные пакеты
Система Generbag anaer состоит из воздухонепроницаемых емкостей, изготовленных из прозрачной пластмассы и генераторов, содержащих смесь веществ, поглощающих кислород. (рис. 9).
При применении GasPak Plus необходимо увлажнить таблетку боргидрида натрия, при этом выделяется водород и в присутствии палладиевого катализатора он соединяется с кислородом с образованием СО2.
Последовательность работы: вынуть генератор из пакета, поместить в нижнюю часть воздухонепроницаемого пакета (анаэростата), затем поместить чашки
(или пробирки) с посевами и закрыть пакет (анаэростат). Инкубация при 37°С.
Анаэробный бокс — прозрачная плексиглассовая камера со шлюзом, отверстиями для рук с рукавами, заканчивающимися резиновыми перчатками. В нем создаются стерильные условия, его заполняют газовой смесью и поддерживают температуру 37°С.
Среда Китта-Тароцци. Содержит мясо-пептонный бульон (МПБ), 0,5% глюкозы и 0,15% агара.
На дно пробирки для адсорбции СЬ помещают кусочки вареной печени или фарша слоем 1-1,5 см и заливают 6—7 мл среды.
Среду перед посевом регенерируют (прогревают 15-20 мин на водяной бане для удаления воздуха, а затем быстро охлаждают). После посева среду заливают вазелиновым маслом и помещают в термостат.
Полужидкий сахарный агар (высокий столбик). В пробирку с 6-7 мл расплавленного и охлажденного до 45 полужидкого питательного агара, содержащего 0,5-1% глюкозы, вносят исследуемый материал и перемешивают. Посевы помещают в термостат.
Химические методы.Основаны на поглощении кислорода воздуха в герметически закрытом сосуде (анаэростате, эксикаторе) такими веществами, как пирогаллол или гидросульфит натрия.
1. Применение щелочных растворов пирогаллола для поглощения кислорода в замкнутой (путем воздушной среде.
2. Можно применять гидросульфит натрия. Для связывания кислорода в 1 л объема берут 100 мл свежеприготовленного 20% раствора Na2S2O4 и 16 мл 50% КОН.
3. Использование веществ — редуцентов, к которым относятся тиогликолевая кислота или тиогликолат натрия (0,01-0,02%), аскорбиновая кислота (0,1%), различные сахара (0,1-3%), цистин и цистеин (0,03-0,05%), муравьинокислый натрий (0,25-0,75%) и др.
Применение газогенерирующих систем для создания анаэробных условий в замкнутой воздушной среде (микроанаэростатах, эксикаторах, прозрачных газонепроницаемых пластиковых пакетах).
Для образования водорода и двуокиси углерода, необходимых для роста облигатных анаэробов, используют специальные таблетки, которые активируются добавлением воды.
Водород, генерируемый таблетками боргидрида натрия, связывает кислород воздуха в присутствии палладиевого катализатора с образованием CO2. Углекислый газ вырабатывается при взаимодействии лимонной кислоты с бикарбонатом натрия.
Анаэробы – это бактерии. Особенности анаэробов, классификация и методы культивирования
Самой богатой по количеству и разнообразию путей метаболизма группой организмов являются прокариоты.
Часть из них, чтобы синтезировать АТФ (основную энергетическую “валюту” клетки), используют схему аэробного дыхания, типичную для большинства эукариотов.
Микроорганизмы, не обладающие данным механизмом, называются анаэробами. Эти бактерии способны получать энергию из химических соединений без участия кислорода.
Классификация анаэробов
По отношению к кислороду выделяют две группы анаэробных бактерий:
- факультативные – могут получать энергию как с участием кислорода, так и без него, переход с одного типа метаболизма на другой зависит от условий среды;
- облигатные – никогда не используют O2.
Для факультативных анаэробов бескислородный тип метаболизма имеет приспособительное значение, и бактерии прибегают к нему только в крайнем случае, при попадании в анаэробную среду. Это объясняется тем, что кислородное дыхание энергетически гораздо выгодней.
У другой группы анаэробов отсутствует биохимический механизм использования O2 для окисления соединений, и присутствие этого элемента в окружающей среде не только не полезно, но и токсично.
Выделяют несколько типов облигатных анаэробов, различающихся по устойчивости к присутствию молекулярного кислорода:
- строгие погибают даже при незначительной концентрации O2;
- умеренно строгие характеризуются средней или высокой устойчивостью к присутствию кислорода;
- аэротолерантные – особая группа прокариот, способная не только выживать, но и расти в воздушной среде.
Отношение конкретной бактерии к кислороду можно определить по характеру ее роста в толще питательной среды.
К аэротолерантным микроорганизмам относят молочнокислые бактерии. Некоторые виды (например, Clostridium) могут быть устойчивы к высокой концентрации кислорода за счет образования эндоспор.
Все анаэробы – это типичные хемотрофы, поскольку в качестве источника энергии используют энергию химических связей. При этом энергетическими донорами могут быть как органические вещества (хемоорганотрофия), так и неорганические (хемолитотрофия).
У бактерий-анаэробов существуют две разновидности бескислородного метаболизма: дыхание и брожение. Принципиальное различие между ними заключается в механизме ассимиляции энергии.
Так, при брожении энергия сначала запасается в фосфагенной форме (например, в виде фосфоенолпирувата), а затем при участии цитозольных дегидрогеназ происходит субстратное фосфолирирование АДФ. Электроны при этом передаются эндогенному или экзогенному акцептору, который становится побочным продуктом процесса.
При дыхательном типе метаболизма энергия запасается в специфическом соединении – Pmf, который либо сразу используется для клеточных процессов, либо поступает в сосредоточенную на мембране электротранспортную цепь, где синтезируется АТФ. Только, в отличие от аэробного дыхания, конечным акцептором электронов служит не кислород, а другое соединение, которое может иметь как органическую, так и неорганическую природу.
Основная задача, которую решает анаэробная бактерия с дыхательным типом метаболизма, – найти альтернативу молекулярному кислороду. Именно от этого зависит энергитический выход реакции. В зависимости от вещества, выполняющего роль терминального акцептора, различают следующие виды анаэробного дыхания:
Анаэробное дыхание менее эффективно, чем аэробное, но по сравнению с брожением дает гораздо больший энергетический выхлоп.
Анаэробное деструктивное сообщество бактерий
Данный тип микробиоты образуется в богатых органикой экологических нишах, в которых кислород практически полностью израсходован (затапливаемые почвы, подземные гидросистемы, илистые отложения и т.д.). Здесь происходит ступенчатая деградация органических соединений, осуществляемая двумя группами бактерий:
- первичные анаэробы отвечают за первый этап дессимиляции органики;
- вторичные анаэробы – это микроорганизмы с метаболизмом дыхательного типа.
Среди первичных анаэробов различают гидролитиков и диссипотрофов, которые связаны друг с другом трофическими взаимодействиями. Гидролитики образуют биопленки на поверхности твердых субстратов и продуцируют гидролитические экзоферменты, которые расщепляют сложные органические соединения на олигомеры и мономеры.
Образовавшиеся питательный субстрат в первую очередь используются самими гидролитиками, но также и диссипотрофами. Последние обычно менее кооперированы и не выделяют значительных количеств экзоферментов, поглощая готовые продукты гидролиза биополимеров. Характерным представителем диссипотрофов являются бактерии рода Syntrophomonas.
Особые требования по выращиванию предъявляются только к облигатно-анаэробным бактериям. Факультативные прекрасно размножаются в кислородной среде.
Методы культивирования анаэробных микроорганизмов подразделяются на три категории: химические, физические и биологические. Их основная задача заключается в том, чтобы понизить либо полностью исключить присутствие кислорода в питательной среде. Степень допустимой концентрации O2 определяется уровнем толерантности конкретного анаэроба.
Физические методы
Суть физических методов состоит в том, чтобы убрать кислород из воздушной среды, с которой контактирует культура, либо полностью исключить контакт бактерий с воздухом. К данной группе относят следующие технологии культивирования:
- выращивание в микроаэростате – специальном приборе, в котором вместо атмосферного воздуха создается искусственная газовая смесь;
- глубинное культивирование – посев бактерий не на поверхность, а высоким слоем или в толщу среды таким образом, чтобы туда не проникал воздух;
- использование вязких сред, в которых диффузия O2 снижается с увеличением плотности;
- выращивание в анаэробной банке;
- заливка поверхности среды вазелиновым маслом или парафином;
- использование CO2-инкубатора;
- применение анаэробной станции SIMPLICITY 888 (самый современный метод).
Обязательной частью физических методов является предварительное кипячение питательной среды, чтобы удалить из нее молекулярный кислород.
Использование химических веществ
Химические соединения, используемые для выращивания анаэробов, разделяют на 2 группы:
- Поглотители кислорода сорбируют молекулы O2. Поглощающая способность зависит от вида вещества и объема воздушного пространства в среде. Наиболее часто применяют пирогаллол (щелочной раствор), металлическое железо, хлорид одновалентной меди, дитионит натрия.
- Восстанавливающие агенты (цистеин, дитиотрейтол, аскорбиновая кислота и др.) снижают окислительно-восстановительный потенциал среды.
Особой разновидностью химических методов является использование газогенерирующих систем, в состав которых входят агенты, генерирующие водород и углекислый газ, а O2 поглощает палладиевый катализатор. Такие системы применяют в замкнутых емкостях для выращивания (анаэростаты, пластиковые пакеты и т.д.).
К биологическим методам относят совместное выращивание анаэробов и аэробов. Последние удаляют из среды кислород, создавая условия для роста своих “сожителей”. В качестве сорбирующих агентов могут использовать и факультативно-анаэробные бактерии.
Существует две модификации данного метода:
- Посев двух культур на разные половины чашки Петри, которую затем закрывают крышкой.
- Посев с использованием “часового стекла”, содержащего среду с аэробной бактерией. Таким стеклом накрывают чашку Петри, сплошным слоем засеянную анаэробной культурой.
Иногда аэробные микроорганизмы используют на этапе подготовки жидкой питательной среды для инокуляции анаэробов. После удаления остаточного кислорода аэроба (например, E. colli) убивают нагреванием, а затем засевают нужную культуру.
Выделение чистой культуры
Чистой культурой называют популяцию микроорганизмов, принадлежащую к одному виду, обладающую одними свойствами и полученную из одной клетки.
Для получения группы бактерий с такими характеристиками обычно используют методы истончающего штриха и предельных разведений, но работа с анаэробами – это особый процесс, требующий исключения контакта с кислородом при получении изолированных колоний.
Существует несколько способов выделения чистой культуры анаэробов. К ним относятся:
- Метод Цейсслера – посев истончающим штрихом на чашки Петри с созданием анаэробных условий и последующей инкубацией в термостате (от 24 до 72 часов).
- Метод Вейнберга – выделение анаэробов в культуру с использованием сахарного агара (посев высоким столбиком), бактерии переносятся запаянным капилляром. Вначале материал помещается в пробирку с изотоническим раствором (этап разведения), затем в пробирку с агаром, имеющим температуру 40-45 градусов, в которой тщательно перемешивается со средой. После этого происходит последовательный пересев в еще 2 пробирки, последняя из которых охлаждается под струей воды.
- Метод Перетца – разведенный в изотоническом растворе материал заливают в чашку Петри таким образом, чтобы она заполнила пространство под лежащей на ее дне стеклянной пластинкой, на которой и должен начаться рост.
Во всех трех методах материал из полученных изолированных колоний пересевается на среду контроля стерильности (СКС) либо среду Китта-Тароцци.
Микробиология – Методы культивирования анаэробов
Для культивирования анаэробных микроорганизмов необходимо создание бескислородных условий, достигаемое различными методами.
Физические методы основаны на создании вакуума в специальных аппаратах — анаэростатах. Иногда воздух в них заменяют каким-либо другим газом, например СО2.
Доступ кислорода в питательную среду можно затруднить, если культивировать анаэробов в глубине столбика сахарного агара или среды Вильсона — Блера, налитых в пробирки в расплавленном состоянии и остуженных до 43°С.
По методу Вейона — Виньяля расплавленный и остуженный агар с посевным материалом набирают в стеклянные трубочки, которые запаивают с двух концов.
Химические методы заключаются в том, что при культивировании исследуемого материала на плотных средах в эксикатор помещают химические вещества, например пирогаллол и щелочь, реакция между которыми идет с поглощением кислорода. В жидкие питательные среды можно добавлять различные редуцирующие вещества: аскорбиновую или тиогликолевую кислоту.
Биологический метод основан на одновременном культивировании аэробов и анаэробов на плотных питательных средах в чашках Петри, герметически закупоренных.
Вначале кислород поглощается растущими аэробами, посеянными на одной половине среды, а затем начинается рост анаэробов, посев которых сделан на другой половине. Наиболее удобна для культивирования анаэробов специальная среда Китта — Тароцци.
В нее входят сахарный МПБ, который наливают в пробирки в количестве 10—12 мл, и кусочки вареных паренхиматозных органов. Перед употреблением среду Китта — Тароцци кипятят на водяной бане для удаления растворенного в ней кислорода.
Среду заливают сверху стерильным вазелиновым маслом. Заметный рост анаэробов (помутнение) может наблюдаться через 48 ч и более в зависимости от количества посевного материала.
Рост изолированных колоний анаэробов можно получить при рассеве исследуемого материала по поверхности кровяно-сахарного агара, разлитого в чашки Петри. После посева чашки помещают в анаэростат. Исследуемый материал в убывающей концентрации можно засевать в высокий столбик агара.
Образовавшиеся отдельные колонии анаэробов выделяют, распилив пробирку в месте роста. Колонии анаэробов для получения значительного количества биомассы отсевают затем на среду Китта — Тароцци.
В качестве источника энергии для анаэробов используют глюкозу, добавление которой в питательную среду обязательно.
Анаэробы
Анаэробы — это микробы, способные расти и размножаться без доступа свободного кислорода. Токсическое действие кислорода на анаэробов связано с подавлением активности ряда бактериальных ферментов. Различают факультативные анаэробы, способные изменять анаэробный тип дыхания на аэробный, и строгие (облигатные) анаэробы, имеющие только анаэробный тип дыхания.
При культивировании строгих анаэробов применяют химические способы устранения кислорода: добавляют в среду, окружающую анаэробов, вещества, способные поглощать кислород (например, щелочной раствор пирогаллола, гидросульфит натрия), либо вводят в состав питательных сред вещества, способные восстанавливать поступающий кислород (например, пировиноградную кислоту, цистеин, глютатион и др.). Можно обеспечить рост анаэробов физическими способами: механически удалять воздух из питательных сред перед посевом путем кипячения с последующей заливкой поверхности среды жидким вазелиновым маслом, а также использовать анаэростат; производить посев уколом в высокий столбик питательного агара, заливая его затем вязким вазелиновым маслом. Биологический способ обеспечения бескислородных условий для анаэробов состоит в комбинированном, совместном посеве культур аэробов и анаэробов.
К патогенным анаэробам относятся палочки столбняка, ботулизма, возбудители анаэробной инфекции (см. Клостридии). См. также Бактерии.
Анаэробы — микроорганизмы, способные существовать и нормально развиваться без доступа свободного кислорода.
Термины «анаэробы» и «анаэробиоз» (жизнь без доступа воздуха; от греч. отрицательной приставки anaer — воздух и bios—жизнь) предложил Л. Пастер в 1861 г.
для характеристики условий существования открытых им микробов маслянокислого брожения.
Анаэробы обладают способностью разлагать в бескислородной среде органические соединения и таким образом получать необходимую энергию для своей жизнедеятельности.
Анаэробы широко распространены в природе: они обитают в почве, иле водоемов, компостных кучах, в глубине ран, в кишечнике людей и животных — всюду, где происходит разложение органических веществ без доступа воздуха.
По отношению к кислороду анаэробы делятся на строгие (Облигатные) анаэробы, которые не способны расти в присутствии кислорода, и условные (факультативные) анаэробы, которые могут расти и развиваться как в присутствии кислорода, так и без него.
К первой группе относится большинство анаэробов из рода Clostridium, бактерии молочнокислого и маслянокислого брожения; ко второй группе — кокки, грибки и др.
Кроме этого, существуют микроорганизмы, требующие для своего развития небольшой концентрации кислорода,— микроаэрофилы (Clostridium histolyticum, Clostridium tertium, некоторые представители рода Fusobacterium и Actinomyces).
Род Clostridium объединяет около 93 видов палочковидных грамположитсльных бактерий, образующих терминальные или субтерминальные споры (цветн. рис. 1—6). К патогенным клостридиям принадлежат Cl. perfringens, Cl. oedema-tiens, Cl. septicum, Cl.
histolyticum, Cl. sordellii, являющийся возбудителями анаэробной инфекции (газовой гангрены), гангрены легких, гангренозного аппендицита, послеродовых и послеабортных осложнений, анаэробных септицемий, а также пищевых отравлений (Cl.
perfringens, типы А, С, D, F).
Патогенными анаэробами являются также Cl. tetani — возбудитель столбняка и Cl. botulinum — возбудитель ботулизма.
Род Bacteroides включает 30 видов бактерий палочковидной формы, не образующих спор, грамотрицательных, большинство из них является строгими анаэробами. Представители этого рода обнаруживаются в кишечном и мочеполовом трактах человека и животных; некоторые виды патогенны, вызывают септицемию и абсцессы.
Анаэробы рода Fusobacterium (небольшие палочки с утолщением на концах, не образующие спор, грамотрицательные), являющиеся обитателями полости рта человека и животных, в ассоциации с другими бактериями вызывают некробациллез, ангину Венсана, гангренозные стоматиты.
Анаэробные стафилококки рода Peptococcus и стрептококки рода Peptostreptococcus обнаруживаются у здоровых людей в дыхательных путях, во рту, влагалище, кишечнике. Кокки-анаэробы вызывают различные гнойные заболевания: абсцесс легких, мастит, цистит, миозит, аппендицит, сепсис после родов и абортов, перитонит и т. п.
анаэробы из рода Actinomyces вызывают актиномикоз у людей и животных.
Некоторые анаэробы также выполняют полезные функции: способствуют перевариванию и усвоению питательных веществ в кишечнике людей и животных (бактерии маслянокислого и молочнокислого брожения), участвуют в круговороте веществ в природе.
Способы выделения анаэробов основаны на создании анаэробных условий (снижении парциального давления кислорода в среде), для создания которых применяют следующие методы: 1) удаление кислорода из среды путем выкачивания воздуха или вытеснения индифферентным газом; 2) химическое поглощение кислорода при помощи гидросульфита натрия или пирогаллола; 3) комбинированное механическое и химическое удаление кислорода; 4) биологическое поглощение кислорода облигатными аэробными микроорганизмами, посеянными на одной половине чашки Петри (метод Фортнера); 5) частичное удаление воздуха из жидкой питательной среды путем кипячения ее, добавления редуцирующих веществ (глюкоза, тиогликолат, цистеин, кусочки свежего мяса или печени) и заливки среды вазелиновым маслом; 6) механическая защита от кислорода воздуха, осуществляемая путем посева анаэробов в высокий столбик агара в тонких стеклянных трубках по методу Вейона.
Методы идентификации выделенных культур анаэробов — см. Анаэробная инфекция (микробиологическая диагностика).
Источник