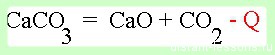- Обратимые и необратимые реакции. Химическое равновесие. Смещение равновесия
- Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
- Содержание:
- Обратимые и необратимые химические реакции
- Химическое равновесие
- Константа равновесия
- Смещение химического равновесия под действием различных факторов
- Влияние температуры
- Влияние концентрации
- Влияние давления
- Влияние катализатора
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Влияние концентрации на смещение химического равновесия
- Влияние температуры на смещение химического равновесия
- Влияние давления на смещение химического равновесия
Обратимые и необратимые реакции. Химическое равновесие. Смещение равновесия
Темы кодификатора: обратимые и необратимые реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
По возможности протекания обратной реакции химические реакции делят на обратимые и необратимые.
Обратимые химические реакции – это реакции, продукты которых при данных условиях могут взаимодействовать друг с другом.
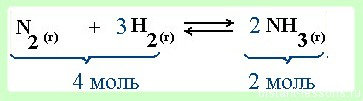
Например , синтез аммиака — реакция обратимая:
Процесс протекает при высокой температуре, под давлением и в присутствии катализатора (железо). Такие процессы, как правило, обратимые.
Необратимые реакции – это реакции, продукты которых при данных условиях взаимодействовать друг с другом не могут.
Например , реакции горения или реакции, протекающие со взрывом — чаще всего, необратимые. Горение углерода протекает необратимо:
Более подробно про классификацию химических реакций можно прочитать здесь.
Вероятность взаимодействия продуктов зависит от условий проведения процесса.
Так, если система открытая , т.е. обменивается с окружающей средой и веществом, и энергией, то химические реакции, в которых, например, образуются газы, будут необратимыми.
Например , при прокаливании твердого гидрокарбоната натрия:
выделяется газообразный углекислый газ и улетучиватся из зоны проведения реакции. Следовательно, такая реакция будет необратимой при данных условиях.
Если же рассмотреть замкнутую систему , которая не может обмениваться веществом с окружающей средой (например, закрытый ящик, в котором происходит реакция), то углекислый газ не сможет улететь из зоны проведения реакции, и будет взаимодействовать с водой и карбонатом натрия, то реакция будет обратимой при данных условиях:
Рассмотрим обратимые реакции. Пусть обратимая реакция протекает по схеме:
aA + bB ⇔ cC + dD
Скорость прямой реакции по закону действующих масс определяется выражением:
Скорость обратной реакции:
Здесь k1 и k2 – константы скорости прямой и обратной реакции соответственно, СA, CB, CC, CD – концентрации веществ А, В, С и D соответственно.
Если в начальный момент реакции в системе нет веществ C и D, то сталкиваются и взаимодействуют преимущественно частицы A и B, и протекает преимущественно прямая реакция.
Постепенно концентрация частиц C и D также начнет повышаться, следовательно, скорость обратной реакции будет увеличиваться. В какой-то момент скорость прямой реакции станет равна скорости обратной реакции. Это состояние и называют химическим равновесием .
Таким образом, химическое равновесие — это такое состояние системы, при котором скорости прямой и обратной реакции равны .
Так как скорости прямой и обратной реакции равны, скорость образования реагентов равна скорости их расходования, и текущие концентрации веществ не изменяются . Такие концентрации называют равновесными .
Обратите внимание, при равновесии протекает и прямая, и обратная реакции, то есть реагенты взаимодействуют друг с другом, но и продукты взаимодействуют друг с другом с такой же скоростью. При этом внешние факторы могут воздействовать и смещать химическое равновесие в ту или иную сторону. Поэтому химическое равновесие называют подвижным , или динамическим .
Исследования в области подвижного равновесия начались еще в XIX веке. В трудах Анри Ле-Шателье были заложены основы теории, которые позже обобщил ученый Карл Браун. Принцип подвижного равновесия, или принцип Ле-Шателье-Брауна, гласит:
Если на систему, находящуюся в состоянии равновесия, воздействовать внешним фактором, который изменяет какое-либо из условий равновесия, то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Иными словами: при внешнем воздействии на систему равновесие сместится так, чтобы компенсировать это внешнее воздействие.
Этот принцип, что очень важно, работает для любых равновесных явлений (не только химических реакций). Однако мы сейчас рассмотрим его применительно к химическим взаимодействиям. В случае химических реакций внешнее воздействие приводит к изменению равновесных концентраций веществ.
На химические реакции в состоянии равновесия могут воздействовать три основных фактора – температура, давление и концентрации реагентов или продуктов.
1. Как известно, химические реакции сопровождаются тепловым эффектом. Если прямая реакция идет с выделением теплоты (экзотермическая, или +Q), то обратная — с поглощением теплоты (эндотермическая, или -Q), и наоборот. Если повышать температуру в системе, равновесие сместится так, чтобы это повышение компенсировать. Логично, что при экзотермической реакции повышение температуры компенсировать не получится. Таким образом, при повышении температуры равновесие в системе смещается в сторону поглощения теплоты, т.е. в сторону эндотермических реакций (-Q); при понижении температуры — в сторону экзотермической реакции (+Q).
2. В случае равновесных реакций, когда хотя бы одно из веществ находится в газовой фазе, на равновесие также существенно влияет изменение давления в системе. При повышении давления химическая система пытается компенсировать это воздействие, и увеличивает скорость реакции, в которой количество газообразных веществ уменьшается. При понижении давления система увеличивает скорость реакции, в которой образуется больше молекул газообразных веществ. Таким образом: при увеличении давления равновесие смещается в сторону уменьшения числа молекул газов, при уменьшении давления — в сторону увеличения числа молекул газов.
Обратите внимание! На системы, где число молекул газов-реагентов и продуктов одинаково, давление не оказывает воздействие! Также изменение давления практически не влияет на равновесие в растворах, т.е. на реакции, где газов нет.
3. Также на равновесие в химических системах влияет изменение концентрации реагирующих веществ и продуктов. При повышении концентрации реагентов система пытается их израсходовать, и увеличивает скорость прямой реакции. При понижении концентрации реагентов система пытается их наработать, и увеличивается скорость обратной реакции. При повышении концентрации продуктов система пытается их также израсходовать, и увеличивает скорость обратной реакции. При понижении концентрации продуктов химическая система увеличивает скорость их образования, т.е. скорость прямой реакции.
Если в химической системе увеличивается скорость прямой реакции, мы говорим, что равновесие сместилось вправо , в сторону образования продуктов и расходования реагентов . Если увеличивается скорость обратной реакции, мы говорим, что равновесие сместилось влево , в сторону расходования продуктов и увеличения концентрации реагентов .
Например , в реакции синтеза аммиака:
повышение давления приводит к увеличению скорости реакции, в которой образуется меньшее число молекул газов, т.е. прямой реакции (число молекул газов-реагентов равно 4, число молекул газов в продуктах равно 2). При повышении давления равновесие смещается вправо, в сторону продуктов. При повышении температуры равновесие сместится в сторону эндотермической реакции, т.е. влево, в сторону реагентов. Увеличение концентрации азота или водорода сместит равновесие в сторону их расходования, т.е. вправо, в сторону продуктов.
Катализатор не влияет на равновесие, т.к. ускоряет и прямую, и обратную реакции.
Источник
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
Содержание:
В химии есть обратимые и необратимые химические реакции. Они протекают по разному принципу и имеют свои особенности. Равновесие в реакции способно смещаться под воздействием определенных факторов.
Обратимые и необратимые химические реакции
Обратимые реакции – это процессы, которые протекают одинаково в обоих направлениях. Например:
Реакции протекают при одинаковых условиях, образуют продукты равных объемах.
Необратимые реакции характеризуются процессом, который протекает в одном направлении, практически до конца. В продуктах всегда образуется нерастворимое соединение или газ, либо слабый электролит. Например: С+О2=СО2. Поскольку углекислый газ является летучим веществом, то разложить его на кислород и углерод невозможно.
Важно! Горение и взрывы в химии являются необратимыми процессами.
Химическое равновесие
Химическое равновесие – это состояние химических веществ, при котором устанавливается одинаковая скорость протекания процессов прямой и обратной стороны. Смещать равновесие можно воздействием температуры, давления или увеличением концентрации одного из веществ.
Равновесными называются реакции, в которых скорость прямой реакции равна скорости обратной реакции. То есть, образование продуктов происходит со скоростью расходования реагентов. Состояние равновесия характерно для любой обратимой реакции.
Равновесные реакции имеют одинаковые концентрации веществ. Рассмотрим подробный пример:
А+В=С+D – обратимая реакция. При взаимодействии веществ правой стороны их концентрация снижается, что снижает и скорость. Соответственно концентрация веществ левой стороны увеличивается. Постепенно эти показатели выравниваются и становятся равновесными. Это и называется равновесием.
Константа равновесия
Исходя из равновесия химических реакций, находят, что концентрации действующих веществ и полученных веществ остаются равными. Это называется равновесными концентрациями.
Константа равновесия является химическим выражением, описывающим закон действующих масс для равновесных систем. Для каждого реагента и продукта реакции обозначают равновесную концентрацию: [A], [B], [C], [D]. Каждое значение возводят в степень равную коэффициенту, находящемуся перед веществом.
K равн= [C] x ×[D] y /[A] a ×[B] b
От наличия в реакции катализатора значение остается неизменным. Он способен ускорить уравновешивание скорости и концентраций.
Катализатор – вещество, которое ускоряет ход как прямой, так и обратной реакции и на смещение химического равновесия влияния не оказывает.
Важно! Для каждого химического процесса константа равновесия является постоянным неизменным значением.
Смещение химического равновесия под действием различных факторов
О подвижности равновесия говорили ученые еще в XIX веке. В то же время активно проводились исследования, чтобы доказать свои предположения. Анри Ле-Шателье был первым, кто попытался рассказать об этом в своих трудах. Позже его исследования обобщил Карл Браун. Принцип Ле-Шателье говорит о:
Если на систему, находящуюся в равновесии оказывается влияние, то равновесие смещается в ту сторону, которое ослабляет это влияние
Влияние температуры
В обратимых реакциях прямая и обратная сторона процесса противоположны по температуре друг другу. В зависимости от температурного коэффициента реакции подразделяются на экзотермические (температура в процессе реакции выделяется). При повышении температуры в такой системе равновесие будет смещаться в сторону обратной реакции.
Эндотермические реакции (которые протекают при нагревании) наоборот, если нагревать такую реакцию, то будет протекать быстрее прямая реакция.
Это значит, если в прямой стороне наблюдается показатель +Q-экзотермический процесс, то в обратной будет –Q – эндотермический процесс. Если увеличить температуру исходных продуктов, то химическое равновесие сместиться в ту сторону, в которой наблюдается пониженная температура.
Влияние концентрации
По принципу Ле-Шателье, увеличение концентрации реагентов вызывает смещение равновесие в сторону, где они расходуются, в прямом процессе. А если концентрация веществ понижается, то химическое равновесие снижается в сторону обратных процессов.
Такой же принцип действует и на увеличение концентрации продуктов реакции. Химическое равновесие смещает в ту сторону, где происходит расход реагентов, значит в сторону обратной реакции. Если концентрацию продуктов понизить, то равновесие сместиться в сторону прямого процесса.
Влияние давления
Давление меняет равновесие не во всех процессах. Это происходит в реакциях с газообразными продуктами. Сумма коэффициентов прямой и обратной реакции должны быть неравными.
Важно! На состояние равновесия процессов с твердыми веществами давление не влияет.
При разной концентрации газообразных веществ слева и справа реакции, повышение давления приведет к смещению химического равновесия. Смещается в ту сторону, где количество газообразных веществ уменьшается, а показатели давления повышаются.
Влияние катализатора
Большинство химических реакций происходит под действием катализаторов. Это специальные добавки, в виде соединений и комплексов, которые ускоряют процесс образования продуктов. Их добавление никак не влияет на химическое равновесие. В некоторых процесс способствует быстрому уравновешиванию сторон.
Таблица химического равновесия
Источник
Химия, Биология, подготовка к ГИА и ЕГЭ
В части А ЕГЭ по химии есть задания на тему смещения химического равновесия. Это довольно простая тема обратимости химических реакций и укладывается буквально в три примера.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Мы как раз рассмотрим влияние на химическое равновесие трех факторов: концентрации, температуры и давления.
Еще в 1994 году французский химик Анри Луи Ле Шателье сформулировал общий принцип для смещения любого химического равновесия:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
Влияние концентрации на смещение химического равновесия
реакция образования аммиака — протекает в газовой среде
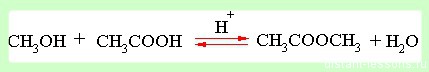
реакция образования сложного эфира — реакция, проходящая в жидкой среде.
- Увеличение концентрации реагентов смещает химическое равновесие в сторону продуктов реакции как в газовой, так и в жидкой среде.
- Удаление продуктов из среды реакции так же смещает равновесие в сторону продуктов реакции.
- Увеличение концентрации продуктов смещает химическое равновесие в сторону обратной реакции.
Влияние температуры на смещение химического равновесия
Все химические реакции делятся на два типа:
- Эндотермические реакции — реакции, протекающие с поглощением теплоты.
Экзотермические реакции — протекают с выделением теплоты.
Соответственно, с помощью температурного воздействия мы можем оказывать влияние на смещение химического равновесия в системе:
в эндотермической реакции:
- увеличение температуры смещает равновесие в сторону продуктов (прямой реакции);
- уменьшение температуры смещает равновесие в сторону реагентов (обратной реакции);
в экзотермической реакции:
- увеличение температуры смещает равновесие в сторону реагентов (обратной реакции);
- уменьшение температуры смещает равновесие в сторону продуктов (прямой реакции);
Влияние давления на смещение химического равновесия
Этот вопрос относится только к реакциям в газовой среде .
- При увеличении давления равновесие смещается в сторону меньшего объема (в данном примере 4 моль → 2 моль, т.е. равновесие сместится в сторону продукта реакции -образования аммиака).
- При уменьшении давления — в сторону большего объема (в сторону обратной реакции)
Если в реакции участвуют твердые вещества , например: 2C (тв) + O2 (г) ↔ 2CO (г), то их количество не учитывается .
Если объем (количество веществ) смеси не меняется , то изменение давления не будет оказывать влияние на смещение химического равновесия .
Катализаторы не влияют на смещение химического равновесия!
- В ЕГЭ это вопрос А21 — Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов
[TESTME 58]
Источник