Способы смещения равновесия при гидролизе
Факторы, влияющие на гидролиз
Влияние факторов на гидролиз солей
Температура. Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает.
Концентрация продуктов гидролиза. Гидролиз — обратимый процесс. В соответствие с принципом Ле Шателье, повышение концентрации ионов водорода (для примера 1) приведет к смещению равновесия влево. Степень гидролиза будет уменьшаться. Также будет влиять увеличение концентрации гидроксид-ионов для реакции рассмотренной в примере 2.
Разбавление. В соответствии с принципом Ле Шателье, при разбавлении равновесие смещается в сторону протекания этой реакции, вправо, степень гидролиза возрастает.
Добавки посторонних веществ. На положение равновесия влияет добавление веществ, которые могут реагировать с одним из участников реакции.
Если в результате гидролиза образуются ионы водорода (гидролиз по катиону):
Me n+ + H-OH MeOH (n-1)+ + H +
сдвинуть равновесие вправо можно:
- добавлением раствора гидроксида натрия (NaOH), содержащего гидроксид-ионы, которые будут взаимодействовать с ионами водорода;
- добавлением раствора соли, образованной сильным основанием и слабой кислотой (например, раствор сульфита натрия Na2SО3)
В результате концентрация ионов водорода уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет.
Источник
Смещение равновесия в процессах гидролиза солей



Так как гидролиз большинства солей является обратимым процессом, то степень гидролиза можно изменять, смещая равновесие реакций гидролиза и нейтрализации. Важнейшими факторами, влияющими на степень гидролиза, являются следующие: 1) константа диссоциации кислоты или основания, образующих соль, 2) общая концентрация соли, 3) температура, 4) рН раствора.
Влияние первого фактора видно из формулы Кг= К 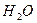
Константа гидролиза тем больше, чем меньше Кдисс. электролита, то есть чем слабее образующийся электролит, тем сильнее гидролизуется соль.
Из уравнения h = 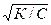
Влияние температуры на степень, гидролиза можно вывести из принципа Ле -Шателье. Реакция нейтрализации экзотермична, следовательно, гидролиз, (обратный ей процесс) эндотермичен, как и диссоциация воды. Поэтому при повышении температуры раствора гидролиз усиливается, охлаждение раствора подавляет гидролиз.
Выше было показало, что при гидролизе солей по катиону образуется кислая среда , при гидролизе но аниону – щелочная . Поэтому изменяя рН раствора, можно усиливать или подавлять гидролиз. Так, введение в раствор FеС1з кислоты вызовет смещение равновесия влево, то есть степень гидролиза уменьшится. Наоборот, связывание ионов Н + усилит гидролиз. Поэтому при сливании растворов солей, одна из которых гидролизуется по катиону, а другая –по аниону, происходит взаимное усиление гидролиза и гидролиз может протекать необратимо. Так, в растворах FеС1з и Na2S, взятых в отдельности, протекает практически только по первой ступени, и устанавливаются соответственно равновесия (1) и (5). При сливании этих растворов происходит реакция нейтрализации:
или в молекулярной форме
и равновесие гидролиза (1, (5) смещаются вправо, становятся возможными вторая и третья (3), (4) стадии гидролиза, что приводит к необратимому протеканию совместного гидролиза этих двух солей:
По подобной схеме взаимного усиления гидролиза, приводящего к образованию осадка и газа, взаимодействуют соли, образованные катионами Аl 3+ , Cr 3+ , Fe 3+ c карбонатами и сульфидами щелочных металлов. Поэтому эти соли невозможно получить реакциями обмена из водных растворов.
Источник
Смещение равновесий гидролиза солей
Если соль подвергается обратимому гидролизу, то в растворе соли устанавливается динамическое химическое равновесие между солью и продуктами её гидролиза: NH4Cl + HOH ↔ NH4OH + HCl.
Влияние на него различных факторов может быть выяснено на основании принципа Ле-Шателье. В соответствии с этим принципом, внешнее воздействие на систему, находящуюся в равновесии, приводит к смещению этого равновесия в направлении, при котором эффект произведённого воздействия ослабляется.
По принципу Ле-Шателье установившееся равновесие можно сместить в сторону прямой или обратной реакции, изменяя концентрацию ионов соли или продуктов её гидролиза. При повышении в растворе концентрации ионов продуктов гидролиза соли гидролиз замедляется, равновесие смещается в сторону обратной реакции. Так, при добавлении щёлочи (ионов ОН — ) в раствор соли, образованной слабой кислотой и сильным основанием, равновесие смещается в сторону образования соли:







При добавлении щёлочи в растворе повышается концентрация ионов ОН — и равновесие смещается в сторону обратной реакции, гидролиз соли замедляется.
При добавлении кислоты (ионов Н + ) в раствор соли KCN гидролиз соли усиливается, равновесие смещается в сторону прямой реакции:



Появившиеся в растворе ионы Н + кислоты вступают в реакцию нейтрализации с ионами ОН — продукта гидролиза соли, концентрация ионов ОН — в растворе уменьшается, равновесие смещается в сторону прямой реакции и гидролиз соли усиливается.
Таким образом, на глубину протекания гидролиза существенное влияние оказывают следующие факторы:
· Концентрация гидролизующейся соли: уменьшение концентрации соли, т.е. разбавление её раствора, приводит к усилению гидролиза соли;
· Концентрация одноимённых ионов: при добавлении в раствор соли, гидролизующейся по катиону, кислоты (Н + -ионов) гидролиз замедляется, как и при добавлении щёлочи (ОН — -ионов) в раствор соли, гидролизующейся по аниону;
· Температура: так как гидролиз – процесс эндотермический, то повышение температуры (нагревание), в соответствии с принципом Ле-Шателье, должно увеличивать его интенсивность;
· Природа соли: чем слабее электролит, образовавший соль, тем глубже протекает процесс гидролиза соли.
Комплексные соединения
Ионы некоторых элементов обладают способностью присоединять к себе полярные молекулы или другие ионы, образуя сложные комплексные ионы.
















 |
Рисунок 1.–Схема строения K4[Fe(CN)6]
Соединения, в состав которых входят комплексные ионы, способные существовать как в кристаллическом состоянии, так и в растворе, называются комплексными соединениями.
Комплексные соединения образуются по донорно-акцепторному механизму.
В молекуле комплексного соединения различают следующие структурные элементы: ион–комплексообразователь (центральный атом), координированные вокруг него присоединенные частицы – лиганды, составляющие вместе с комплексообразователем внутреннюю координационную сферу, и остальные частицы, входящие во внешнюю координационную сферу. Ионы внешней сферы связаны с ионами внутренней сферы ионным типом связи, а лиганды с центральным атомом – ковалентным типом связи. Поэтому при растворении комплексных соединений лиганды остаются в прочной связи с ионом-комплексообразователем, образуя почти не диссоциирующий комплексный ион. Число сигма-связей, образованных центральным атомом с лигандами, называется координационным числом центрального атома (к.ч.).
На рисунке 1 приведена схема строения гексацианоферрата (II) калия K4[Fe(CN)6] – комплексного соединения, образующегося при взаимодействии: 4KCN + Fe(CN)2 = K4[Fe(CN)6].
При растворении комплексное соединение диссоциирует, участвуя в первичной диссоциации, на ионы внешней и внутренней сферы:
Характерные комплексообразователи: Fe 3+ , Fe 2+ , Co 3+ , Cu 2+ , Ag + , Zn 2+ , Cr 3+ , Ni 2+ (комплексообразователем могут быть атомы и ионы).
Характерные лиганды: CI − , Br − , NO2 − , CN − , NH3, H2O (лигандами могут быть анионы и молекулы).
Заряд комплексного иона равняется алгебраической сумме зарядов составляющих его ионов. Например, заряд комплексного иона [Fe(CN)6] х- рассчитаем следующим образом: заряд иона Fe = +2, сумма зарядов 6 ионов CN − равна (-6). Отсюда: х = +2 – 6 = — 4.
Входящие в состав комплексного иона нейтральные молекулы не оказывают влияния на заряд комплексного иона.
Если все лиганды внутренней сферы являются нейтральными молекулами, то заряд комплексного иона равен заряду комплексообразователя.
Так, у иона [Cu(NH3)4] 2+ заряд меди х=2+, поэтому заряд комплексного иона – 2+.
Заряд комплексного иона равен сумме зарядов ионов, находящихся во внешней сфере. В К4[Fe(CN)6] заряд [Fe(CN)6] равен -4, так как во внешней сфере находятся четыре иона К + и их суммарный заряд равен 4+. Молекула любого комплексного соединения электронейтральна.
Пример. Вычислите заряды комплексных ионов, образованных платиной (IV) : 1) [Pt(NH3)4CI2]; 2) [Pt(NH3)CI5]; 3) [Pt(NH3)2CI4].
Решение.Степень окисления атома платины равна +4, заряд молекул NH3 равен нулю, а заряд двух хлорид-ионов равен 2; алгебраическая сумма зарядов:
Рассуждая подобным образ, найдем заряд других ионов:
В первом случае внешняя сфера содержит отрицательно заряженные ионы, во втором – положительно заряженные ионы, а в третьем – соединение практически является неэлектролитом.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Источник











