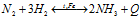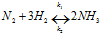Химическое равновесие и условия его смещения
Существуют обратимые и необратимые химические реакции. Химические реакции, протекающие при данных условиях во взаимно противоположных направлениях с сопоставимыми скоростями, называют обратимыми, например:
CH3COOH + CH3OH 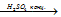
В тот момент, когда скорости прямой и обратной реакций выравниваются, устанавливается химическое равновесие, то есть соотношение между продуктами реакций и исходными веществами остается постоянным. Состояние системы, при котором скорость прямой реакции равна скорости обратной, называется химическим равновесием. Такое состояние может сохраняться бесконечно долго, если не происходит изменения условий реакции (концентрации, температуры, давления). При изменении этих условий происходит смещение (или сдвиг) равновесия.
Смещение равновесия определяется принципом Ле-Шателье, который гласит: если на систему, находящуюся в равновесии, оказывается какое-либо внешнее воздействие, то система реагирует так, чтобы уменьшить это воздействие. Например:
Реакция протекает в газовой фазе, обратима, прямая реакция экзотермична. Химические реакции, которые при одних и тех же условиях могут идти в противоположных направлениях, называются обратимыми.
При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Уравнение рассматриваемой выше реакции можно записать в виде:
Реакцию, протекающую слева направо, называют прямой (константа скорости прямой реакции k1), справа налево – обратной (константа скорости обратной реакции k2). В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратимая реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной – увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакции становятся равными.
Константа химического равновесия представляет собой отношение константы скорости прямой реакции к константе скорости обратной реакции, а также отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ. Константа химического равновесия зависит от температуры и природы реагирующих веществ, но не зависит от концентрации.
Константа химического равновесия является количественной характеристикой химического равновесия и характеризует выход продуктов реакции. Если К >1, то в равновесной системе больше продуктов реакции, т.е. в данном случае выход продуктов реакции больше, чем исходных веществ. Если К
Способы смещения химического равновесия
1. а). Увеличение концентрации одного из реагирующих веществ вызовет смещение равновесия в сторону его потребления, так, добавление в систему азота или водорода вызовет сдвиг равновесия вправо, а аммиака — влево. Уменьшение концентрации какого-либо из участников равновесия вызовет его образование. Так, например, связывая аммиак в соль, можно равновесие полностью сместить вправо.
2. б). Изменение давления вызовет в равновесной системе смещения в сторону той реакции, которая может компенсировать это изменение. В данном случае увеличение давления ускорит реакцию, идущую с уменьшением общего количества газообразных веществ, то есть равновесие сместится вправо, а уменьшение давления — реакцию, идущую с увеличением общего количества газообразных веществ, то есть равновесие сместится влево.
3. в). Увеличение температуры, то есть подвод тепла, смещает равновесие в сторону реакции, идущей с поглощением тепла, то есть эндотермической, а уменьшение температуры, то есть отнятие тепла, — в сторону реакции, идущей с выделением тепла, то есть экзотермической. В данном примере повышение температуры смещает равновесие влево, а понижение — вправо (в сторону синтеза аммиака).
4. г) Катализатор не влияет на положение равновесия, поскольку он в равной степени изменяет скорости прямой и обратной реакций.
Источник
Химическое равновесие и способы его смещения



Химическое равновесие – это такое состояние системы при котором скорость прямой и обратной реакции равны.
На химическое равновесие влияют:
Концентрация реагирующих веществ, температура, давление (для газов).
Принцип Ле – Шателье:
Если на систему, находящуюся в химическом равновесии, производится какое либо внешнее воздействие, тов системе усиливаются процессы, которые стремятся свести это воздействие к минимуму.
Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Химическое равновесие является динамическим равновесием. В равновесном состоянии продолжают протекать и прямая, и обратная реакции, но так как скорости их равны, концентрации всех веществ в реакционной системе не изменяются. Эти концентрации называются равновесными концентрациями.
Смещение химического равновесия
Принцип Ле-Шателье
Химическое равновесие является подвижным. При изменении внешних условий скорости прямой и обратной реакций могут стать неодинаковыми, что обусловливает смещение (сдвиг) равновесия.
Если в результате внешнего воздействия скорость прямой реакции становится больше скорости обратной реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если скорость обратной реакции становится больше скорости прямой реакции, то говорят о смещении равновесия влево (в сторону обратной реакции). Результатом смещения равновесия является переход системы в новое равновесное состояние с другим соотношением концентраций реагирующих веществ.
Направление смещения равновесия определяется принципом, который был сформулирован французским ученым Ле-Шателье (1884 г):
Если на равновесную систему оказывается внешнее воздействие, то равновесие смещается в сторону той реакции (прямой или обратной), которая противодействует этому воздействию.
Важнейшими внешними факторами, которые могут приводить к смещению химического равновесия, являются:
а) концентрации реагирующих веществ;
В) давление.
Влияние концентрации реагирующих веществ
Если в равновесную систему вводится какое-либо из участвующих в реакции веществ, то равновесие смещается в сторону той реакции, при протекании которой данное вещество расходуется. Если из равновесной системы выводится какое-либо вещество, то равновесие смещается в сторону той реакции, при протекании которой данное вещество образуется.
Например, рассмотрим, какие вещества следует вводить и какие вещества выводить из равновесной системы для смещения обратимой реакции синтеза аммиака вправо:
Для смещения равновесия вправо (в сторону прямой реакции образования аммиака) необходимо в равновесную смесь вводить азоти водород (т. е. увеличивать их концентрации) и выводить из равновесной смеси аммиак (т. е. уменьшать его концентрацию).
Влияние температуры
Прямая и обратная реакции имеют противоположные тепловые эффекты: если прямая реакция экзотермическая, то обратная реакция эндотермическая (и наоборот). При нагревании системы (т. е. повышении ее температуры) равновесие смещается в сторону эндотермической реакции; при охлаждении (понижении температуры) равновесие смещается в сторону экзотермической реакции.
Например, реакция синтеза аммиака является экзотермической: N2(г) + 3H2(г) → 2NH3(г) + 92кДж, а реакция разложения аммиака (обратная реакция) является эндотермической: 2NH3(г)→ N2(г) + 3H2(г) — 92кДж. Поэтому повышение температуры смещает равновесие в сторону обратной реакции разложения аммиака.
Влияние давления
Давление влияет на равновесие реакций, в которых принимают участие газообразные вещества. Если внешнее давление повышается, то равновесие смещается в сторону той реакции, при протекании которой число молекул газа уменьшается. И наоборот, равновесие смещается в сторону образования большего числа газообразных молекул при понижении внешнего давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на равновесие в данной системе.
Например, для увеличения выхода аммиака (смещение вправо) необходимо повышать давление в системе обратимой реакции 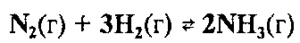
Источник
Лекция на тему «ХИМИЧЕСКОЕ РАВНОВЕСИЕ»
Тема : Химическое равновесие.
Цель: Актуализировать знания о химическом равновесии и условиях при котором оно смещается.
1. Кинетическое и термодинамическое описание химического равновесия.
2. Смещение химического равновесия (принцип Ле — Шателье).
3. Равновесия в биологических средах.
1.Обратимыми химическими реакциями называются химические реакции и физико-химические процессы, самопроизвольно протекающие как в прямом, так и в обратном направлении. Уравнение гипотетической обратимой реакции может быть представлено схемой:
аА + bВ
Ниже приведены примеры некоторых обратимых реакций:
N2 + 3 H2 
NH4Cl + H2O 
Hb + O2
Пределом протекания обратимых процессов является состояние химического равновесия. Химическое равновесие — это такое состояние обратимого процесса, в котором скорость прямой и обратной реакций равны между собой (рисунок 3).
Рисунок 3. Изменение скорости прямой и
обратной реакций в ходе обратимого процесса
Признаком химического равновесия является постоянство во времени концентрации всех веществ, участвующих в процессе (рисунок 4). Концентрации веществ в состоянии химического равновесия называются равновесными: [Ā], моль/л.
Рисунок 4 — Кинетические кривые
обратимой реакции аА 
Кинетическое описание химического равновесия основано на законе действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ (Гульдберг-Вааге,1884).
Согласно закону действующих масс, скорости прямой и обратной реакций равны:
где υпр — скорость прямой реакции,
υобр — скорость обратной реакции,
kпр — константа скорости прямой реакции,
kобр — константа скорости обратной реакции.
В состоянии равновесия υпр = υобр, следовательно можно записать, что
Отношение констант скорости является постоянной величиной, обозначаемой Kc:
где Kс – концентрационная константа равновесия.
Таким образом, закон действующих масс для обратимой реакции записывается так:

Например, для биохимической реакции окисления гемоглобина в оксигемоглобин
Hb + O2
константа химического равновесия равна:
Если в химической реакции участвуют газообразные, жидкие и твердые вещества, то для расчета Кс используют только равновесные концентрации газов.
Например, синтез кристаллической мочевины из углекислого газа и аммиака описывается уравнением:
CO2 (г) + 2 NH3 (г)
В равновесии участвуют как газообразные, так и твердые вещества, но концентрацию кристаллической мочевины при составлении уравнения для Kc не учитывают:
Если К >> 1, то равновесие смещено вправо, (υпр > υобр); если К
В 
где Δ G– это изменение свободной энергии Гиббса в ходе процесса, а Δ G o – стандартное изменение свободной энергии.
В состоянии химического равновесия Δ G = 0, а концентрации веществ А, В, С и D являются равновесными. Соответственно
Δ G o = — RT ln K.
Таким образом, K зависит только от температуры и природы реагирующих веществ.
2. Смещение химического равновесия (принцип Ле- Шателье)
Состояние химического равновесия является наиболее энергетически выгодным состоянием обратимого процесса, так как характеризуется минимальным запасом внутренней энергии системы (G min) (рисунок 5).
Рисунок 5 — Энергетическая диаграмма
Таким образом, любой обратимый процесс стремится к равновесию. В 1884 г. французский физико-химик и металлург Ле -Шателье сформулировал общий закон смещения химического равновесия.
Принцип Ле -Шателье : «Если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменив температуру, давление или концентрации веществ), то положение равновесия сместится таким образом, чтобы ослабить внешнее воздействие».
Этот принцип позволяет предсказать качественные изменения в равновесной системе при изменении условий.
Частные случаи принципа Ле- Шателье:
1) Повышение температуры смещает равновесие в сторону эндотермической, а понижение температуры — в сторону экзотермической реакции.
Рассмотрим влияние температуры на равновесие обратимой биохимической реакции
Hb + O2
При повышении температуры равновесие смешается влево (кровь отдает кислород тканям), при понижении температуры равновесие смещается вправо (кровь обогащается кислородом).
2) При повышении давления равновесие смещается в сторону меньшего количества газообразных веществ, а при понижении давления — в сторону их большего количества. Изменение давления не влияет на смещение химического равновесия, если: (а) в реакции не участвуют газы; (б) реакция протекает без изменения количества газообразных веществ. Например,
N2 + O2
Используя данный принцип, можно рассмотреть влияние давления на равновесие обратимой реакции окисления гемоглобина в оксигемоглобин.
Венозная кровь поступает в легкие, где испытывает повышенное давление кислорода О2. В результате равновесие смещается вправо (кровь насыщается кислородом). Артериальная кровь, поступающая в ткани, оказывается при пониженном давлении кислорода, в результате чего равновесие смещается влево (кровь отдает кислород тканям).
3) При увеличении концентрации вещества, участвующего в обратимом превращении, равновесие смещается в сторону той реакции, которая протекает с убылью этого вещества (и наоборот).
Например, при увеличении содержания гемоглобина в крови равновесие смещается вправо (ткани обогащаются кислородом). При недостатке гемоглобина (анемия) равновесие смещается влево (больной страдает от кислородной недостаточности).
3. Равновесие в биологических средах
Важнейшей биологической средой является вода. Описание процессов, протекающих в водных растворах, возможно с позиций теории химического равновесия. Многие процессы, играющие важную роль в метаболизме живых организмов, связаны с обратимым переносом протонов (протолитические равновесия).
К важнейшим протолитическим равновесиям относится диссоциация воды, протекающая по уравнению:
H2O
Вода – очень слабый электролит; при комнатной температуре из 5 млн. молекул воды только одна молекула диссоциирует на ионы. Поскольку молярная концентрация молекул воды значительно превышает молярную концентрацию ионов ([H2O]>> [H+]) , то можно считать, что концентрация молекул воды является величиной постоянной ([H2O] = const). Применив закон действующих масс, напишем выражение для концентрационной константы равновесия рассматриваемого процесса:
Умножив левую и правую части уравнения на [H2O], получим уравнение
Kw — ионное произведение воды; эта величина является константой равновесия, описывающей обратимую диссоциацию воды. При стандартной температуре (t = 25 o C) Кw = [H + ][OH — ] = 10 -14 .
Для воды и водных растворов:

Не менее важным является протолитическое равновесие, устанавливающееся при диссоциации слабых кислот и оснований.
Уксусная кислота является слабым электролитом. Ее диссоциация протекает обратимо по уравнению:
CH3COOH
Константа равновесия, описывающая данный обратимый процесс обозначается Ka и называется константой кислотности:
Аммоний гидроксид является слабым электролитом. Его диссоциация протекает обратимо по уравнению:
NH4OH
Константа равновесия, описывающая данный обратимый процесс обозначается Kb и называется константой основности:
Чем больше Ка и Kb, тем сильнее диссоциируют кислоты и основания в водных растворах.
К протолитическим равновесиям, играющим важную биологическую роль, относятся реакции гидролитического разложения веществ. Гидролиз солей — это реакция ионного обмена между составными частями соли и воды, протекающая с изменением кислотности раствора. Гидролизу подвергаются растворимые соли, в состав которых входят катионы слабых оснований или анионы слабых кислот.
1.Какие химические реакции называют обратимыми?
2.Что произойдет, если на систему, находящуюся в равновесии оказать внешнее воздействие?
3.В какую сторону сместиться равновесие при повышении температуры и давления?
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Источник