- Способы решения задач по химии для 8 9 класса
- Алгоритм № 2. Вычисление объема вещества по известной массе другого вещества, участвующего в реакции.
- Алгоритм № 3. Расчет по химическому уравнению объемных отношений газов
- Алгоритм № 4. Вычисление относительной плотности газа по другому газу
- Алгоритм № 5. Вычисление массовой доли вещества в растворе
- Алгоритм № 6. Вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества.
- Алгоритм № 7. Расчеты по термохимическим уравнениям. Вычисление количества теплоты по известной массе вещества.
- Алгоритм № 8. Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты.
- Алгоритм № 9. Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
- Способы решения задач по химии для 8 9 класса
- 1 Определение относительной молекулярной массы Мг
- 2 Определение массовой доли элемента в соединении
- 3 Определение числа молекул в порции вещества
- 4 Определение массы атома в граммах
- 5 Определение молярной массы
- 6 Определение массового отношения элементов в соединении
- 7 Определение объема, который занимает порция газа при н.у.
- 8 Определение теплового эффекта реакции
- 9 Определение максимального выхода продукта реакции
- 10 Определение реального выхода продукта реакции
- 11 Определение выхода продукта по стехиометрическим соотношениям
- 12 Определение содержания основного компонента (или содержания примеси) в исходном веществе
- 13 Определение выхода реакции, когда одно из исходных веществ взято в избытке
- 14 Определение состава газовой смеси (в объемных процентах)
- 15 Определение объема газа, расходуемого на проведение реакции с другими газами
- 16 Определение молекулярной формулы вещества по относительной плотности его паров
- 17 Определение состава газовой смеси
- 18 Определение состава солей в растворе
- 19 Приготовление раствора с заданной массовой долей растворенного вещества
- 20 Приготовление раствора с заданной массовой долей растворенного вещества
- 21 Приготовление раствора с заданной массовой долей растворенного вещества
- 22 Приготовление раствора с заданной массовой долей растворенного вещества
- 23 Приготовление раствора с заданной молярной концентрацией
- 24 Определение формулы органического вещества по данным о массе продуктов реакции
- 25 Определение молекулярной формулы органического вещества по данным о продукте реакции
- 2 Комментарии
- Добавить комментарий Отменить ответ
- Школьные предметы:
- Поиск конспекта
- Новые конспекты
- О проекте
- Новости
- Научиться решать задачи по химии легко: следуем инструкции
- У громоздких формул есть смысл
- Проверяем свою готовность к задаче
- Теперь можно приступать
- Еще по этой теме:
- Серная кислота
- Теперь «ХиШник» стал полностью бесплатным
- Азотная кислота
- Диены
- Правило Марковникова
- Таблицы для ЕГЭ по химии
- Внеклассное мероприятие по химии
- Формулы для решения задач по химии
- Химические профессии
- ЕГЭ по химии 2019
- Критерии оценивания ОГЭ по химии, баллы 2019
- Изменения ОГЭ по химии в 2019 году
- Подготовка к ОГЭ по химии
- Онлайн тесты по химии
- Все об ОГЭ по химии в 2019
- Тест по химии 11 класс
- Тест по химии 10 класс
- Тест по химии 9 класс
- Тест по химии 8 класс
- Ионная связь
- Водородная связь
- Подготовка к ЕГЭ по химии с нуля
- Металлическая связь
- Ковалентная связь
- Шкала перевода баллов ЕГЭ по химии 2018
- Учимся на летних каникулах
- «ХиШник» приехал на Сахалин!
- Мой сын увлёкся химией, что делать?
- Двенадцать сервисов для изучения химии, с которыми ты точно сдашь
- О правах и обязанностях в школе: почему необходимо сотрудничество учеников и учителей
- Современный задачник по химии
- Выбираем репетитора по химии: инструкция
- Изменения в ЕГЭ по химии 2018 года, новая демоверсия, спецификация, кодификаторы ЕГЭ
- Обновление в демонстрационной версии «ХиШника»
- Активация лицензионного ключа и первые шаги в «ХиШнике».
- Современный урок химии по ФГОС
- ХиШник в школе: ИКТ на уроках химии
- Ура! Новые планы ХиШника и подарочки
- Родина приложения «ХиШник» – Новосибирский Академгородок
- Можно ли просматривать историю решения задач учениками в онлайн-режиме?
- Можно ли заниматься в «ХиШнике» со смартфона/планшета?
- Семинар от «ХиШника» на КПК для учителей химии
- Команда «ХиШника» провела мастер-класс для преподавателей химии и методистов
- Как купить полный доступ к приложению?
- «ХиШник» представляет два кейса на ярмарке кейсов «Школа реальных дел»
- Спасибо!
Способы решения задач по химии для 8 9 класса
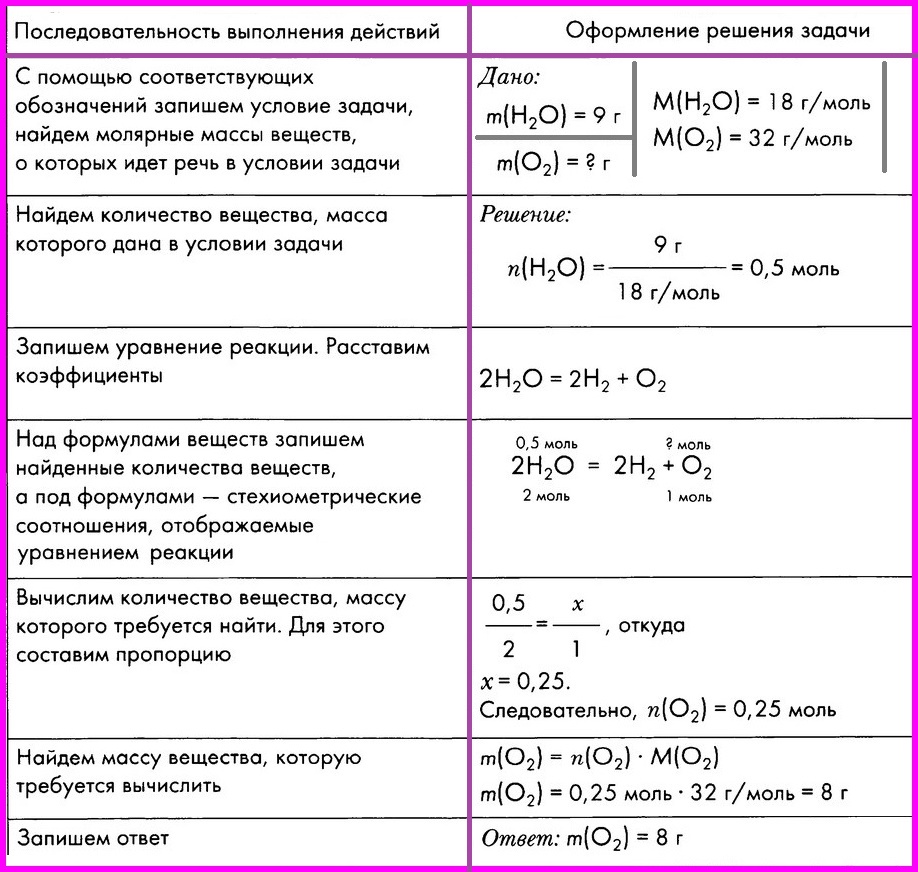
ЗАДАЧА: Вычислите массу кислорода, выделившегося в результате разложения порции воды массой 9 грамм.
Алгоритм № 2. Вычисление объема вещества по известной массе другого вещества, участвующего в реакции.
ЗАДАЧА: Вычислите объем кислорода (н.у.), выделившегося в результате разложения
порции воды массой 9 г.
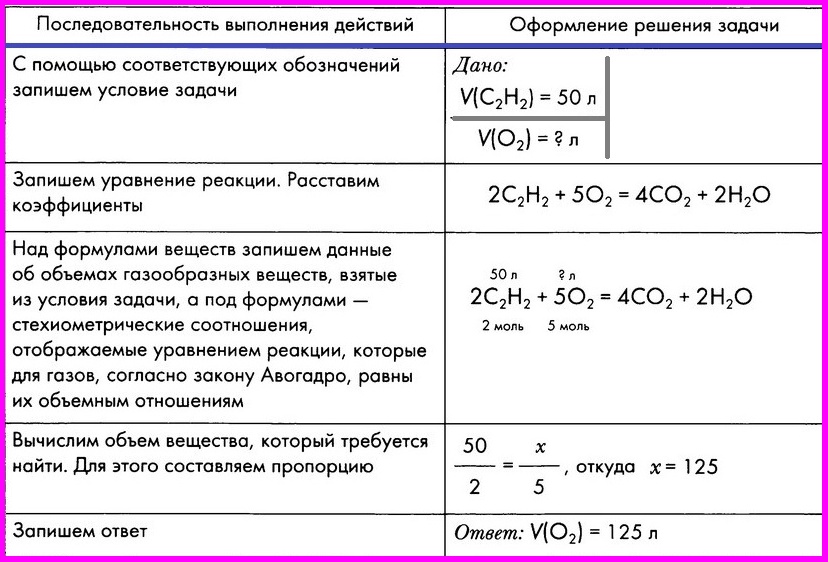
Алгоритм № 3. Расчет по химическому уравнению объемных отношений газов
ЗАДАЧА: Вычислите объем кислорода, необходимого для сжигания порции ацетилена объемом 50 л.
Алгоритм № 4. Вычисление относительной плотности газа по другому газу
ЗАДАЧА: Вычислите плотность кислорода а) по водороду; 6) по воздуху.
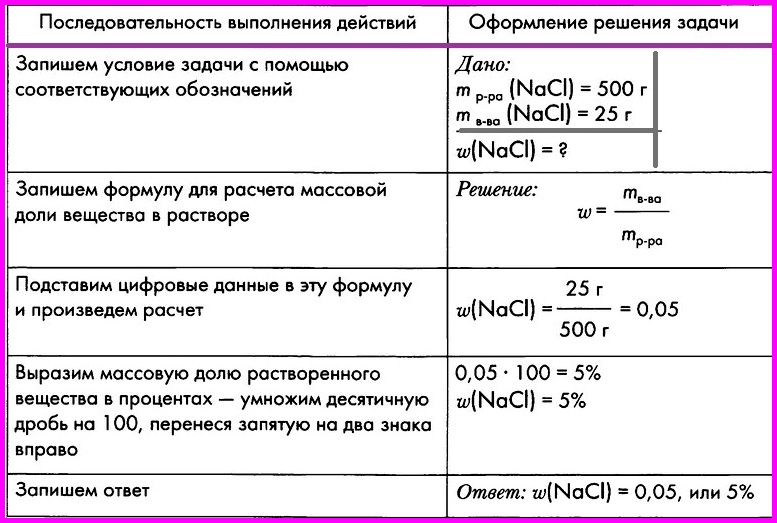
Алгоритм № 5. Вычисление массовой доли вещества в растворе
ЗАДАЧА: При выпаривании раствора массой 500 г образовалось 25 г кристаллической соли — хлорида натрия. Вычислите массовую долю соли в исходном растворе.
Алгоритм № 6. Вычисление массы вещества в растворе по массе раствора и массовой доле растворенного вещества.
ЗАДАЧА: Вычислите массу гидроксида натрия, необходимого для приготовления 400 г 20%-ного раствора гидроксида натрия.
Алгоритм № 7. Расчеты по термохимическим уравнениям. Вычисление количества теплоты по известной массе вещества.
ЗАДАЧА: По термохимическому уравнению 2Сu + O2 = 2СuO + 310 кДж вычислите количество теплоты, выделившейся в результате окисления порции меди массой 16 г.
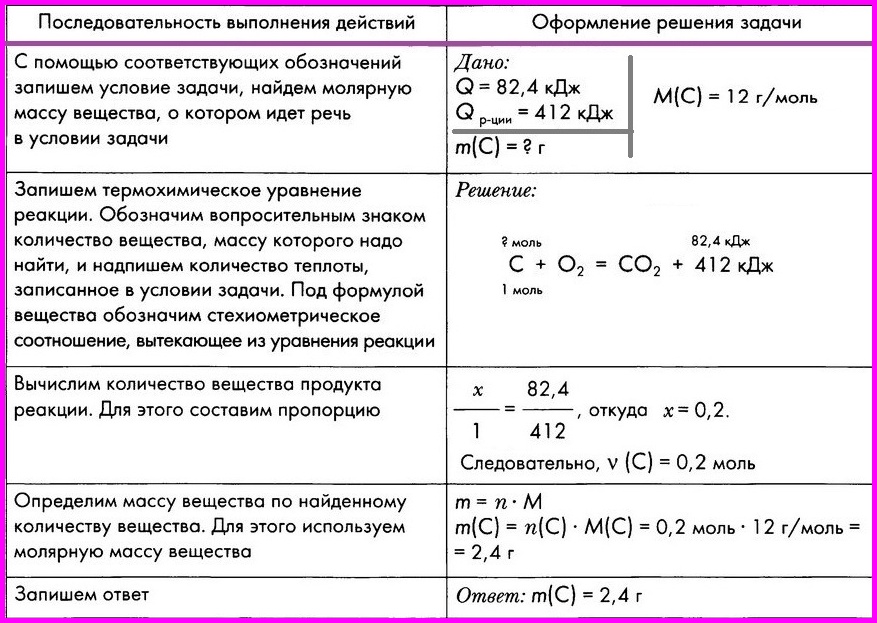
Алгоритм № 8. Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты.
ЗАДАЧА: По термохимическому уравнению С + O2 = СO2 + 412 кДж вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж .
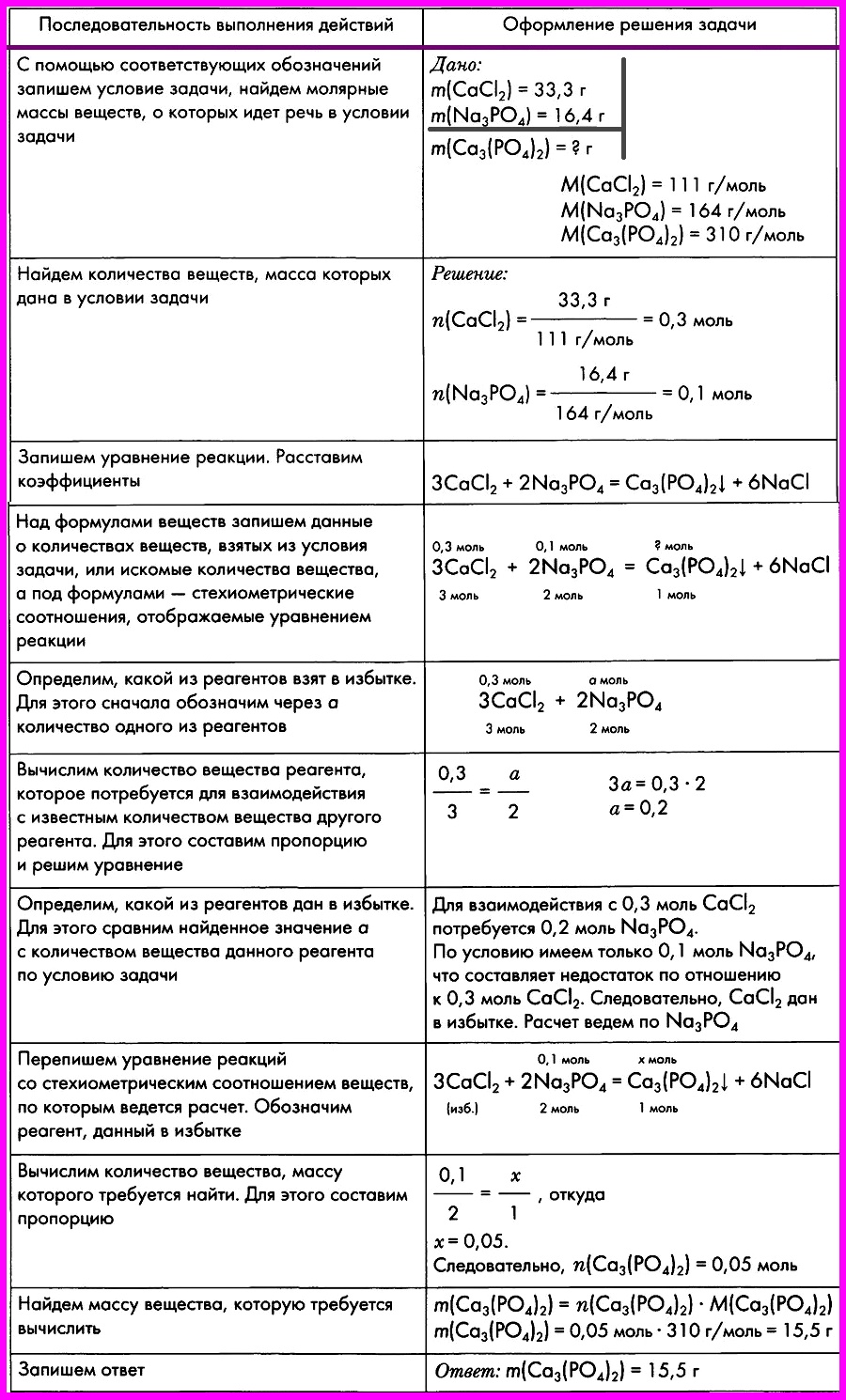
Алгоритм № 9. Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке.
ЗАДАЧА: Смешали два раствора, один из которых содержал 33,3 г хлорида кальция, а другой — 16,4 г фосфата натрия. Вычислите массу образовавшегося фосфата кальция.
Вы смотрели Справочник по химии «Алгоритмы решения типовых задач». Выберите дальнейшее действие:
Источник
Способы решения задач по химии для 8 9 класса
Ключевые слова: решение 25 типовых задач по химии, определение массы, доли, числа,
1 Определение относительной молекулярной массы Мг
Задача Какова относительная молекулярная масса Мг нитробензола С6Н5NO2? Какова молекулярная масса этого вещества в а.е.м.?
2 Определение массовой доли элемента в соединении
Задача Какова масса в граммах 1 атома 131 I ?
3 Определение числа молекул в порции вещества
Задача Сколько молекул воды содержится в 1 капле воды массой 0,03 г?
4 Определение массы атома в граммах
Задача Какова массовая доля фосфора в фосфате кальция Са3(РO4)2 ?
Ответ: ω = 0.2 или 20%
5 Определение молярной массы
Задача Какова молярная масса вещества, если масса 2.5 моль этого вещества равна 250 г?
6 Определение массового отношения элементов в соединении
Задача Каково массовое отношение углерода, водорода и кислорода в глюкозе С6Н1206 ?
7 Определение объема, который занимает порция газа при н.у.
Задача Какой объем (н.у.) занимают 66 г С02?
8 Определение теплового эффекта реакции
Задача Молярная теплота сгорания угля на воздухе 393.5 кДж/моль. Сколько теплоты выделится при полном сгорании 1 кг угля?
9 Определение максимального выхода продукта реакции
Задача Сколько максимально литров (н.у.) водорода можно получить, используя 45.5 г цинка и избыток соляной кислоты?
10 Определение реального выхода продукта реакции
Задача При прокаливании 15,8 г перманганата калия КМnО4 получено 0,896 л (н.у.) кислорода. Каков выход кислорода в данном случае?
11 Определение выхода продукта по стехиометрическим соотношениям
Задача Сколько граммов азотной кислоты HNO3 максимально можно получить из 44.8 л (н.у.) азота?
12 Определение содержания основного компонента (или содержания примеси) в исходном веществе
Задача Каково содержание (в процентах) СаСО3 в образце известняка, при длительном прокаливании 400 г которого получено 78,4 л С02 (н.у.)?
13 Определение выхода реакции, когда одно из исходных веществ взято в избытке
Задача Сколько граммов поваренной соли NaCI можно получить, если смешать два раствора, один из которых содержит 29,2 г HCI, а другой 44 г NaOH?
14 Определение состава газовой смеси (в объемных процентах)
Задача 20 л (н.у.) аммиака пропустили через нагретую до 350°С трубку с железным катализатором. Объем полученной газовой смеси (н.у.) равен 25 л. Каков состав полученной газовой смеси (в объемных процентах) ?
15 Определение объема газа, расходуемого на проведение реакции с другими газами
Задача Какой минимальный объем кислорода, содержащего 10 объемн. % озона, необходим для полного сжигания 4 л пропана С3Н8 ?
16 Определение молекулярной формулы вещества по относительной плотности его паров
Задача Относительная плотность паров углеводорода по воздуху 2,69. Массовая доля водорода в соединении 7,69%. Какова молекулярная формула углеводорода?
17 Определение состава газовой смеси
Задача Относительная плотность 30 л смеси метана СН4 и азота N2 по гелию равна 5. Сколько литров метана и азота взято для приготовления смеси?
18 Определение состава солей в растворе
Задача В растворе смешали 9,8 г H2S04 и 6,5 г NaOH. Какие соли и в каких количествах образовались?
19 Приготовление раствора с заданной массовой долей растворенного вещества
Задача Сколько граммов сахарозы надо растворить в 250 г воды, чтобы получить раствор с массовой долей сахарозы 0,3 (30%)?
20 Приготовление раствора с заданной массовой долей растворенного вещества
Задача : Сколько граммов медного купороса CuS04 • 5Н20 надо добавить к 300 г 2%-го раствора сульфата меди, чтобы получить 5%-ный раствор ?
21 Приготовление раствора с заданной массовой долей растворенного вещества
Задача Сколько миллилитров воды нужно добавить к 100 мл 30%-го раствора соляной кислоты с плотностью 1,15 г/мл, чтобы получить раствор с массовой долей НCl 5%?
22 Приготовление раствора с заданной массовой долей растворенного вещества
Задача Сколько граммов ВаО надо добавить к 100 г воды, чтобы получить 5%-ный раствор?
23 Приготовление раствора с заданной молярной концентрацией
Задача Сколько граммов сульфата натрия Na2S04* 10Н20 необходимо для приготовления 0,5 л раствора с молярной концентрацией 0,02 моль/л?
24 Определение формулы органического вещества по данным о массе продуктов реакции
Задача При полном сгорании 6,0 г органического вещества получено 8,8 г С02 и 3.6 г воды. Плотность паров органического вещества по водороду равна 30. Какова молекулярная формула вещества?
25 Определение молекулярной формулы органического вещества по данным о продукте реакции
Задача При обработке 14,8 г одноосновной карбоновой кислоты избытком цинка получено 2,24 л водорода. Какова молекулярная формула кислоты?
Автор задач: С.С.Бердоносов
Решение 25 типовых задач по химии. Выберите дальнейшие действия:
2 Комментарии
Спасибо! Все задачи решены в одном ключе (используются одни и те же приемы), что ускоряет их понимание и использование.
Благодарю! Помогли вспомнить решение нужной мне задачи. 17. 03 21г.
Добавить комментарий Отменить ответ
Школьные предметы:
Поиск конспекта
Новые конспекты
О проекте
Сайт «УчительPRO» — некоммерческий школьный проект учеников, их родителей и учителей. Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie и других пользовательских данных в целях функционирования сайта, проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Возрастная категория: 12+
(с) 2021 Учитель.PRO — Копирование информации с сайта только при указании активной ссылки на сайт!
Источник
Новости
Научиться решать задачи по химии легко: следуем инструкции
У громоздких формул есть смысл
Задачи по химии делятся на несколько разных видов: на составление уравнения химической реакции, на анализ растворов веществ, на определение массы или плотности. Способы их записи и решения различаются. Многие хотели бы научиться с легкостью читать условные обозначения в химии, и кому-то это покажется недостижимым мастерством. Но все дело как раз в том, что символы и формулы ученые придумали, чтобы как можно удобнее записать свои представления о химических процессах. Поэтому за символами нужно научиться видеть конкретную информацию о веществах и их характеристиках.
Возможно даже нелишним будет узнать, кто, когда и при каких обстоятельствах ввел то или иное обозначение.
Возьмем понятие «количество вещества». Оно очень важно для решения расчетных задач по уравнениям химических реакций. Эту особую единицу измерения не нужно путать с массой. Под ней понимают количество структурных элементов (атомов, молекул или ионов). Никогда не говорят: «здесь количество вещества 4 молекулы», потому что измеряют его в молях. В международной системе единиц СИ количество вещества принято обозначать буквой n.
Проверяем свою готовность к задаче
Прежде чем приступать к решению задач, нужно быть уверенным, что ты выучил основные термины. Кроме уже рассмотренного количества вещества, нужно знать, что такое масса, молярная масса, постоянная Авогадро, массовая доля, выход продукта, стехиометрический коэффициент, и так далее.
Знать Таблицу химических элементов — это почти то же самое, что и выучить таблицу умножения в математике и склонения в русском языке. Нет, зубрить список элементов не нужно, потому что таблица всегда может быть перед глазами, даже на ОГЭ и ЕГЭ. Но нужно уметь с ней работать, знать общие принципы построения этой таблицы. А затем станет ясно, как структура таблицы и свойства элементов зависят друг от друга. Например, в таблице Менделеева содержится такая важная справочная информация, как атомная масса элементов. Обратите внимание: знание атомной массы элементов нам пригодится для решения задачи, приведенной ниже!
Самые важные формулы, которые нужно запомнить:
- Формула расчета массовой доли в растворе (ω) очень простая и содержится уже в самом определении. Массовая доля — это отношение массы (m) растворенного вещества к общей массе раствора. Если требуется ответ в процентах, то тогда так:
ω = mр.в./mр-ра*100%
- Масса вещества это произведение количества вещества на молярную массу.
m = n*M
- Формула объема газа при нормальных условиях.
V = n*22,4л/моль
- Формула плотности
ρ = m/V
Из этих формул можно вывести другие формулы. Ниже мы для примера определим массу растворенного вещества исходя из массовой доли.
Теперь можно приступать
Когда ты удостоверился, что азы усвоены, можно решать задачи на растворы, смеси и все остальные. Решение задачи выстраивается пошагово. Например, определим массу гидроксида натрия, необходимого для полной нейтрализации 1000 г 49% раствора серной кислоты.
- Пишем условие в следующем виде:
m р-ра = 1000г
ω(H2SO4) = 49%
m(NaOH) = ?
- Какую формулу для чего использовать.
Для начала мы определяем, какие формулы здесь использовать. Чтобы знать массу гидроксида натрия (NaOH), необходимо знать массу серной кислоты. Пока известна только ее массовая доля (49%). Мы выведем формулу массы серной кислоты с помощью формулы массовой доли вещества (мы ее записывали выше):
m(H2SO4) = m р-ра * ω(H2SO4)/100% = 1000 г * 49%/100% = 490 г
Как масса серной кислоты поможет найти массу гидроксида натрия? Если посмотреть на формулу поиска массы, то ответ очевиден. Нужно найти количество вещества гидроксида натрия, которое можно узнать по уравнению реакции нейтрализации.
- Используем уравнение реакции
При работе с уравнением реакции нам пригодится знание того, что стехиметрический коэффициент — коэффициент, стоящий перед символом или формулой вещества в химическом уравнении. Важно, что он отражает не количество молекул участвующих в реакции веществ, а их относительное количество. Количество вещества гидроксида натрия нам неизвестно, поэтому над уравнением мы ставим x моль.
x моль
2NaOH + H2SO4 = Na2SO4 + 2H2O
2 моль 1 моль
Количество вещества серной кислоты мы можем узнать, так как уже выяснили ее массу, а молярная масса легко вычисляется как сумма атомных масс, входящих в состав молекулы.
n(H2SO4) = 490г/98г/моль = 5 моль.
x моль 5 моль 2NaOH + H2SO4 = Na2SO4 + 2H2O
2 моль 1 моль
Зная по уравнению реакции, что количества вещества гидроксида натрия в два раза больше, чем у серной кислоты, мы вывели значение n(NaOH) = 10 моль.
Осталось только найти массу вещества NaOH.
m(NaOH) = 10 моль * 40г/моль = 400г.
Это и есть ответ.
Иногда в ходе работы с задачами придется возвращаться к учебнику и повторять пройденный материал. В этом нет ничего страшного, рано или поздно знания закрепятся. Рекомендуем использовать приложение “ХиШник”, в котором решение задач сопровождается решениями и подсказками. Записывать решения и уравнения реакций удобнее сначала в специальном редакторе, который снабжен всплывающими подсказками. После тренировки в “ХиШнике” обязательно получится решать задачи вручную и без подсказок. Так или иначе, полученные теоретические знания обязательно закрепятся на практике, и решать задачи по химии будет легко и интересно.
Теперь вы знаете, что научиться решать задачи по химии несложно: достаточно просто следовать инструкциям.
Еще по этой теме:
Серная кислота
Основные сведения о серной кислоте: свойства, получение, применение.
Теперь «ХиШник» стал полностью бесплатным
Как развивалось приложение все эти годы, и почему мы им так гордимся.
Азотная кислота
Статья содержит основную информацию об азотной кислоте: её свойства, получение и применение.
Диены
Основные сведения о диеновых углеводородах: номенклатура и изомерия, классификация, химические свойства, получение.
Правило Марковникова
Правило Марковникова: формулировка, механизм протекания реакций, исключения из правила.
Таблицы для ЕГЭ по химии
В статье представлены таблицы, необходимые при изучении химии и сдаче ЕГЭ.
Внеклассное мероприятие по химии
Идеи интересных внеклассных мероприятий по химии.
Формулы для решения задач по химии
Перечень основных формул, которые используются при решении школьных задач по химии.
Химические профессии
Обзор необычных профессий, связанных с химией.
ЕГЭ по химии 2019
Основная информация о ЕГЭ по химии 2019: структура экзамена, баллы, даты проведения.
Критерии оценивания ОГЭ по химии, баллы 2019
Подробно расскажем о баллах ОГЭ по химии 2019, методах и критериях оценивания заданий и переводе первичных баллов в школьную оценку.
Изменения ОГЭ по химии в 2019 году
Расскажем об изменениях, которые ждут школьников при сдаче ОГЭ по химии в 2019 году.
Подготовка к ОГЭ по химии
Несколько советов и рекомендаций, следуя которым подготовка к ОГЭ по химии будет проходить результативно.
Онлайн тесты по химии
Немного информации о проверке знаний с помощью тестов по химии в режиме онлайн.
Все об ОГЭ по химии в 2019
Основные сведения об ОГЭ по химии 2019: даты, время, баллы, материалы для подготовки.
Тест по химии 11 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 11 классе.
Тест по химии 10 класс
Общие сведения о тестах по химии в 10 классе.
Тест по химии 9 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 9 классе.
Тест по химии 8 класс
Рассказываем в общих чертах о тестах по химии в 8 классе
Ионная связь
Статья, содержащая в себе базовые понятие об ионном виде химической связи.
Водородная связь
Статья о водородном типе химической связи и его особенностях.
Подготовка к ЕГЭ по химии с нуля
В статье дано несколько действенных советов по подготовке к ЕГЭ по химии «с нуля».
Металлическая связь
Продолжаем серию статей про виды химической связи.
Ковалентная связь
Начинаем серию статей про виды химической связи.
Шкала перевода баллов ЕГЭ по химии 2018
Отвечаем на вопросы о системе оценивания и переводе первичных баллов в тестовые.
Учимся на летних каникулах
Размышляем о том, как полезно провести время во время летнего отдыха на каникулах. (в статье есть подарок внимательным читателям)
«ХиШник» приехал на Сахалин!
Этим летом открывается очередная летняя сессия областной профильной школы для одаренных детей «Эврика».
Мой сын увлёкся химией, что делать?
Собрали ТОП-5 полезных материалов для старшеклассника.
Двенадцать сервисов для изучения химии, с которыми ты точно сдашь
Великолепная подборка полезных сайтов для самостоятельного изучения химии.
О правах и обязанностях в школе: почему необходимо сотрудничество учеников и учителей
Что такое право само по себе и откуда оно берется. Как не заработать славу скандалистов, «вечно качающих права», и при этом не переносить безропотно нарушение своих личных границ…
Современный задачник по химии
материал о том, какие виды задачников по химии существуют и как среди них ориентироваться.
Выбираем репетитора по химии: инструкция
Или не выбираем
Изменения в ЕГЭ по химии 2018 года, новая демоверсия, спецификация, кодификаторы ЕГЭ
ФИПИ снова решил усложнить нам жизнь новыми требованиями к ЕГЭ. О том, почему изменения не всегда плохи, и как встретить их с достоинством.
Обновление в демонстрационной версии «ХиШника»
Мы расширили приветственное окно, чтобы при входе в приложение всем новым пользователям были понятны основные принципы работы «ХиШника».
Активация лицензионного ключа и первые шаги в «ХиШнике».
Что такое лицензионный ключ и как происходит его активация в приложении
Современный урок химии по ФГОС
Для чего нужны стандарты, по которым происходит обучение химии в российских школах, и как приложение “ХиШник” поможет соответствовать этим стандартам?
ХиШник в школе: ИКТ на уроках химии
Как наше приложение поможет внедрить ИКТ в уроки
Ура! Новые планы ХиШника и подарочки
Подводим итоги 2017, планируем 2018 и, конечно же, дарим подарки!
Родина приложения «ХиШник» – Новосибирский Академгородок
Почему же родиной «ХиШника» стал Новосибирский Академгородок?
Совпадение не случайное.
Можно ли просматривать историю решения задач учениками в онлайн-режиме?
Итак, «ХиШник» это приложение, в котором могут работать и ученики, и преподаватели. После того, как преподаватель создает в приложении учебную группу
Можно ли заниматься в «ХиШнике» со смартфона/планшета?
Сегодня у нас вопрос, которого мы давно ждали: можно ли заниматься в «ХиШнике» со смартфона/планшета?
Семинар от «ХиШника» на КПК для учителей химии
На прошлой неделе мы провели семинар в рамках масштабных ежегодных курсов повышения квалификации на базе СУНЦ НГУ (Новосибирск, Академгородок).
Команда «ХиШника» провела мастер-класс для преподавателей химии и методистов
Вчера команда «ХиШника» провела мастер-класс для преподавателей химии и методистов программ повышения квалификации из разных регионов России.
Как купить полный доступ к приложению?
Сегодня новый вопрос: что делать, если решать задачи в демо-версии приложения понравилось, как получить полный доступ? Отвечаем!
«ХиШник» представляет два кейса на ярмарке кейсов «Школа реальных дел»
Ярмарка кейсов «Школы реальных дел» – уже в эту пятницу! В этом году «ХиШник» представляет два кейса.
Служба поддержки:
support@hishnik-school.ru
Для СМИ:
onp@alekta.ru
Спасибо!
от 01.01.2017 года
Настоящее пользовательское (лицензионное) соглашение (далее – «Соглашение») заключается между Обществом с ограниченной ответственностью «АЛЕКТА» (далее – «Лицензиар»), и Пользователем (физическим лицом, выступающем в роли конечного потребителя Продукта) совместно именуемые «Стороны».
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно представляет собой публичную оферту и, после его принятия Вами, образует соглашение между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в тексте Соглашения.
Принимая настоящее Соглашение, Вы соглашаетесь с положениями, принципами, а также соответствующими условиями лицензионного соглашения, изложенными ниже.
Источник