Регуляция скорости ферментативных реакций.
Особенностью ферментативных реакций является наличие механизмов регуляции их скорости. Благодаря регуляторным механизмам ферментативные реакции протекают со скоростями, соответствующими потребностям организма. Например, при выполнении мышечной работы резко повышается скорость реакций окисления, сопровождающихся выделением энергии, и одновременно снижается скорость реакций синтеза, потребляющих энергию. Во время отдыха после работы наблюдается возрастание скорости реакций синтеза химических соединений, использованных при выполнении физических нагрузок.
К основным механизмам регуляции скорости ферментативных реакций можно отнести следующие:
· Изменение скорости синтеза ферментов. Ферменты, являясь белками, постепенно разрушаются, и поэтому в клетках постоянно синтезируются новые ферментные белки. При повышении скорости образования новых ферментов их содержание в клетках возрастает. При этом скорость ферментативных реакций увеличивается, так как зависимость скорости реакции от концентрации фермента носит прямолинейный характер. При уменьшении выработки ферментов их концентрация в клетках постепенно снижается, что сопровождается падением скорости катализируемых ими реакций.
Изменение скорости синтеза ферментов обычно происходит под влиянием гормонов, которые ускоряют или замедляют первый этап синтеза ферментных белков — считывание генетической информации – транскрипцию. Поэтому данный механизм регуляции часто называется регуляцией на генетическом уровне.
· Модификация ферментов. Под модификацией понимается незначительное изменение химического состава молекулы фермента, приводящее к изменению каталитической активности.
Модификация может быть обратимой и необратимой.
В первом случае изменение строения фермента носит обратимый характер и фермент может многократно менять свою активность. Например, некоторые ферменты содержат в своей молекуле остаток фосфорной кислоты. При отщеплении фосфатного остатка у одних ферментов каталитическая активность снижается; при включении его снова в состав ферментов активность их возрастает. У других же ферментов фосфорилированная форма (содержащая фосфат), наоборот, малоактивна. Отщепление фосфорной кислоты от таких ферментов ведет к повышению их активности.
Примером необратимой модификации служит активация пищеварительных ферментов, действующих на пищевые белки. Так, в составе желудочного сока содержится белок пепсиноген, не обладающий каталитической активностью. В полости желудка под действием соляной кислоты от этого белка отщепляется небольшой полипептид и образуется очень активный фермент, расщепляющий в пищевых белках пептидные связи – пепсин. (Белки, являющиеся предшественниками ферментов, называются проферментами).
· Изменение конформации ферментов. Изменение конформации, т.е. пространственного строения ферментного белка происходит под действием неконкурентных ингибиторов и активаторов, которыми могут быть гормоны, промежуточные и конечные продукты ферментативных реакций, ионы металлов, лекарства (см. выше). Изменение конформации ферментов возможно и при изменении условий среды, например, при повышении или снижении кислотности.
Дата добавления: 2015-03-11 ; просмотров: 2541 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
ТЕМА 2.8. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
1.Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути (последовательного превращения одних веществ в другие), достаточно регулировать количество молекул фермента или их активность. Обычно в метаболических путях имеются ключевые ферменты,за счет которых происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами.Регуляция скорости ферментативных реакций осуществляется на трех независимых уровнях: изменением количества молекул фермента, доступностью молекул субстрата и кофермента, изменением каталитической активности молекулы фермента (табл. 2.6).
Таблица 2.5. Способы регуляции скорости ферментативных реакций
| Способ регуляции | Характеристика |
| Изменение количества молекул фермента | Количество молекул фермента в клетке определяется соотношением двух процессов: синтеза и распада. Наиболее изучен механизм регуляции синтеза фермента на уровне транскрипции (синтеза мРНК), который регулируется определенными метаболитами, гормонами и рядом биологически активных молекул |
| Доступность молекул субстрата и кофермента | Важный параметр, контролирующий протекание ферментативной реакции, — наличие субстрата и кофермента. Чем больше концентрация исходного субстрата, тем выше скорость реакции |
| Изменение каталитической активности молекулы фермента | Основными способами регуляции активности ферментов являются: — аллостерическая регуляция; — регуляция с помощью белок-белковых взаимодействий; — регуляция путем фосфорилирования-дефосфорилирова- ния молекулы фермента; — регуляция частичным (ограниченным) протеолизом |
Рассмотрим способы регуляции скорости ферментативных реакций за счет изменения каталитической активности молекулы фермента.
2. Аллостерическая регуляция. Аллостерическими ферментаминазывают ферменты, активностькоторых может регулироватьсяс помощью веществэффекторов.Участвующие в аллостерической регуляции эффекторы — это клеточные метаболиты, которые часто являются участниками именно того пути, регуляцию которого они осуществляют.
Эффектор, который вызывает снижение (ингибирование)активности фермента, называется ингибитором.Эффектор, который вызываетповышение (активацию)активности ферментов, называют активатором.
Аллостерические ферменты имеют определенные особенности строения:
— обычно являются олигомерными белками,состоящими из нескольких протомеров;
— имеют аллостерический центр,пространственно удаленный от каталитического активного центра;
— эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах.
Аллостерические центры, так же как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие — к ингибиторам.
Протомер, на котором находится аллостерический центр, называется регуляторным протомеромв отличие от каталитического протомера,содержащего активный центр, в котором проходит химическая реакция.
Аллостерические ферменты обладают свойством кооперативности:взаимодействие аллостерического эффектора с аллостерическим центром вызывает кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или повышает каталитическую активность фермента. Если к аллостерическому центру присоединяется ингибитор, то в результате кооперативных конформационных изменений происходит изменение конформации активного центра, что вызывает снижение сродства фермента к субстрату и, соответственно, снижение скорости ферментативной реакции. И наоборот, если к аллостерическому центру присоединяется активатор, то сродство фермента к субстрату увеличивается, что вызывает повышение скорости реакции. Последовательность событий при действии аллостерических эффекторов представлена на рис. 2.26.
Регуляция аллостерических ферментов обратима:отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента.
Аллостерические ферменты катализируют ключевые реакцииданного метаболического пути.
Аллостерические ферменты играют важную роль в различных метаболических путях, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состава клетки. Скорость метаболических процессов зависит от концентрации веществ, как использующихся, так и образующихся в данной цепи реакций. Исходные вещества могут быть активаторами аллостерических ферментов метаболического пути. В то же время при накапливании конечного продукта какого-либо метаболического пути он может действовать как аллостерический ингибитор фермента. Такой способ регуляции распространен в организме и носит название «отрицательная обратная связь»:

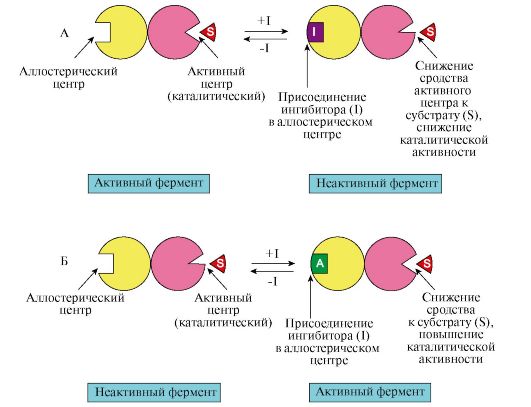
А — действие отрицательного эффектора (ингибитора). Ингибитор (I) присоединяется к аллостерическому центру, что вызывает кооперативные конформационные изменения в молекуле фермента, в том числе и в активном центре фермента. Сродство фермента к субстрату снижается, в результате снижается и скорость ферментативной реакции; Б — действие положительного эффектора (активатора). Активатор (А) присоединяется к аллостерическому центру, что вызывает кооперативные конформационные изменения. Сродство фермента к субстрату повышается, и скорость ферментативной реакции увеличивается. Продемонстрировано обратимое действие как ингибитора, так и активатора на активность фермента
Рассмотрим аллостерическую регуляцию процесса катаболизма глюкозы, который заканчивается образованием молекулы АТФ (рис. 2.27). В том случае, если молекулы АТФ в клетке не расходуются, она является ингибитором аллостерических ферментов данного метаболического пути: фосфофруктокиназы и пируваткиназы. В то же время промежуточный метаболит катаболизма глюкозы — фруктозо-1,6-бисфосфат является аллостерическим активатором фермента пируваткиназы. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяет

Молекула АТФ является аллостерическим ингибитором ферментов метаболического пути — фосфофруктокиназы и пируваткиназы. Молекула фруктозо-1,6-бисфосфата является аллостерическим активатором фермента пируваткиназы
осуществлять регуляцию скорости метаболического пути. Аллостерические ферменты катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте разветвления метаболического пути.
3. Регуляция с помощью белок-белковых взаимодействий.Некоторые ферменты изменяют свою активность в результате белок-белковых взаимодействий. Можно выделить по крайней мере два механизма изменения активности фермента таким способом: активация ферментов в результате присоединения белков-активаторов (активация фермента аденилатциклазы с помощью α-субъединицы G-белка, см. модуль 4) и изменение каталитической активности в результате ассоциации и диссоциации протомеров.
В качестве примера регуляции каталитической активности ферментов ассоциацией или диссоциацией протомеров можно рассмотреть регуляцию фермента протеинкиназы А.
Протеинкиназа А(цАМФ-зависимая) состоит из четырех субъединиц двух типов: двух регуляторных (R) и двух каталитических (С). Такой тетрамер не обладает каталитической активностью. Регуляторные субъединицы имеют участки связывания для циклического 3′,5′-АМФ (цАМФ) (по два на каждую субъединицу). Присоединение четырех молекул цАМФ к двум регуляторным субъединицам приводит к изменению конформации регуляторных протомеров и к диссоциации тетрамерного комплекса; при этом высвобождаются две активные каталитические субъединицы (рис. 2.28). Активная протеинкиназа А катализирует перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (т.е. вызывает фосфорилирование белков).
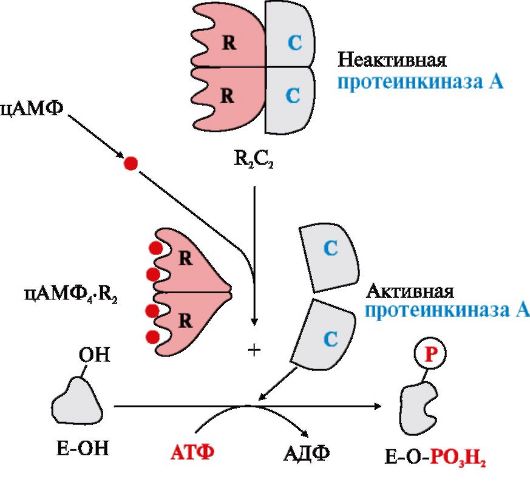
Активация ПКА осуществляется с помощью четырех молекул цАМФ, которые присоединяются к двум регуляторным субъединицам, что приводит к изменению конформации регуляторных протомеров и диссоциации тетрамерного комплекса. При этом высвобождаются две активные каталитические субъединицы, способные вызывать фосфорилирование белков
Отщепление молекул цАМФ от регуляторных субъединиц приводит к ассоциации регуляторных и каталитических субъединиц протенкиназы А с образованием неактивного комплекса.
4. Регуляция каталитической активности ферментов путем фосфорилирова- ния-дефосфорилирования.В биологических системах часто встречается механизм регуляции активности ферментов с помощью их ковалентной модификации. Быстрым и широко распространенным способом химической модификации ферментов является их фосфорилирование-дефосфорилирование.
Фосфорилирова-нию подвергаются ОН-группы фермента, которое осуществляется ферментами протеинкиназами(фосфорилирование) ифосфопротеинфосфатазами(дефосфорилирование). Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными (рис. 2.29). Активность протеинкиназ и фосфопротеинфосфатаз регулируется гормонами, что позволяет быстро варьировать активность ключевых ферментов метаболических путей в зависимости от условий внешней среды.

Фосфорилирование ферментов происходит с помощью фермента протеинкиназы. Донором остатка фосфорной кислоты является молекула АТФ. Фосфорилирование фермента изменяет его конформацию и конформацию активного центра, что изменяет сродство фермента к субстрату. При этом некоторые ферменты при фосфорилировании активируются, другие — ингибируются. Обратный процесс — дефосфорилирование — вызывают ферменты фосфопротеинфосфатазы, отщепляющие остаток фосфорной кислоты от фермента и возвращающие фермент в исходное состояние
5. Регуляция каталитической активности ферментов частичным (ограниченным) протеолизом.Некоторые ферменты, которые функционируют вне клеток (в желудочно-кишечном тракте или плазме крови), синтезируются в виде неактивных предшественников и активируются только в результате гидролиза одной или нескольких определенных пептидных связей, который приводит к отщеплению части молекулы. В оставшейся части белковой молекулы происходит конформационная перестройка и формируется активный центр фермента (рис. 2.30). Частичный протеолиз представляет собой пример регуляции, когда активность фермента изменяется

В результате гидролиза одной или нескольких пептидных связей пепсиногена (неактивной молекулы) отщепляется часть молекулы и формируется активный центр фермента пепсина
необратимо. Такие ферменты функционируют, как правило, в течение короткого времени, определяемого временем жизни белковой молекулы. Частичный протеолиз лежит в основе активации пищеварительных протеолитических ферментов (пепсин, трипсин, химотрипсин, эластаза), пептидных гормонов (инсулин), белков свертывающей системы крови и ряда других белков.
Источник




