- Как регулируется активность ферментов?
- Способы регуляции активности ферментов
- 1.Доступность субстрата или кофермента
- 2. Компартментализация
- 3. Генетическая регуляция
- 4. Ограниченный (частичный) протеолиз проферментов
- 5. Аллостерическая регуляция
- 6. Белок-белковое взаимодействие
- 7. Ковалентная (химическая) модификация
- РЕГУЛЯЦИЯ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- РЕГУЛЯЦИЯ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Как регулируется активность ферментов?
Активность ферментов в клетке непостоянна во времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри. Главная цель такой чувствительности ферментов – отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях – предоставить клетке шанс выжить.
Способы регуляции активности ферментов
В клетке имеется несколько способов регуляции активности ферментов – одни способы подходят для любых ферментов, другие более специфичны.
1.Доступность субстрата или кофермента
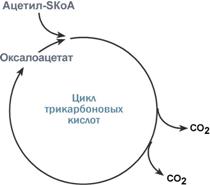
Роль оксалоацетата для работы ЦТК
Здесь работает закон действия масс – фундаментальный закон химической кинетики: при постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. Или упрощенно – скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Таким образом, изменение количества хотя бы одного из субстратов прекращает или начинает реакцию.
Например, для цикла трикарбоновых кислот (ЦТК) таким субстратом является оксалоацетат (щавелевоуксусная кислота). Наличие оксалоацетата «подталкивает» реакции цикла, что позволяет вовлекать в окисление молекулы ацетил-SКоА.
2. Компартментализация
Компартментализация – это сосредоточение ферментов и их субстратов в одном компартменте (одной органелле) – в эндоплазматическом ретикулуме, митохондриях, лизосомах, ядре, плазматической мембране и т.п.
3. Генетическая регуляция
Генетическая регуляция (изменение количества фермента) может происходить в результате увеличения или снижения его синтеза. С этой точки зрения ферменты можно подразделить на три группы:
- Конституитивные – такие ферменты, которые образуются в клетке постоянно, независимо от наличия субстрата (нейрональная NO-синтаза, ферменты гликолиза, β-окисления жирных кислот, репарации ДНК).
- Индуцируемые – синтез этих ферментов возрастает при наличии соответствующих стимулов — индукторов.
- Репрессируемые – образование таких ферментов в клетке при необходимости подавляется.
Изменение скорости синтеза фермента (индукция или репрессия) обычно зависит от количества определенных гормонов или метаболитов процесса.
Примеры индуцируемых ферментов:
- гормоны глюкокортикоиды стимулируют синтез ферментов глюконеогенеза, что обеспечивает стабильность концентрации глюкозы в крови при длительном голоданиии и устойчивость ЦНС к стрессу,
- исчезновение пищеварительных ферментов при длительном голодании и индукция их синтеза в восстановительный период в результате возобновления секреции гормонов ЖКТ,
- при беременности и после родов в молочной железе индуцируется синтез фермента лактозосинтазы под воздействием лактотропного гормона,
- токсические субстраты (например, этанол и барбитураты) стимулируют в печени синтез «своего» изофермента цитохрома Р450, который окисляет и обезвреживает эти вещества,
- при активации цитокинами моноцитов и макрофагов в них начинается синтез индуцируемой NO-синтазы.
Примеры репрессируемых ферментов:
- в печени репрессия фермента синтеза холестеролаГМГ-SKoA-редуктазы под влиянием холестерина и желчных кислот,
- в печени репрессия синтеза ферментов глюконеогенеза под действием инсулина,
- подавление синтеза триптофана бактериями при деятельности триптофанового оперона.
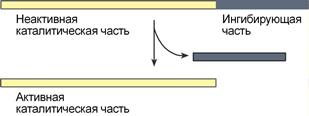
4. Ограниченный (частичный) протеолиз проферментов
Ограниченный (частичный) протеолиз проферментов подразумевает, что синтез некоторых ферментов осуществляется в виде более крупного предшественника и при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов. Подобный механизм защищает внутриклеточные структуры от повреждений.
Схема активации фермента способом
«ограниченного протеолиза»
Примером служит активация протеолитических ферментов желудочно-кишечного тракта (трипсиноген, пепсиноген, прокарбоксипептидазы), факторов свертывающей системы крови, лизосомальных ферментов (катепсины).
Секреция ряда ферментов за пределы клетки в неактивном состоянии позволяет предохранить клетки от повреждения (пищеварительные ферменты) или сохранить белок в плазме крови до наступления определенного момента (факторы свертывания крови, белки системы комплемента, калликреин-кининовой и ренин-ангиотензиновой систем).
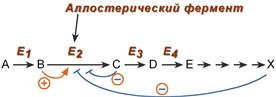
5. Аллостерическая регуляция
Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы.
Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами.
Общий принцип аллостерической регуляции
В качестве отрицательного регулятора может выступать конечный или промежуточный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи . Если регуляторами являются начальный метаболит или субстрат реакции, то говорят о прямой регуляции , она может быть как положительной, так и отрицательной. Также регулятором могут быть метаболиты биохимических путей, каким то образом связанных с данной реакцией.
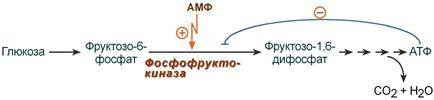
Регуляция фосфофруктокиназы конечным продуктом
Например, фермент энергетического окисления глюкозы, фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада. При этом АТФ, лимонная кислота, фруктозо-1,6-дифосфат являются ингибиторами, а фруктозо-6-фосфат и АМФ – активаторами фермента.
- В большинстве клеток организма (кроме печени) при регуляции синтеза холестерола аллостерическим ингибитором ключевого фермента этого процесса ГМГ-КоА-редуктазы выступает сам холестерол, что быстро и точно регулирует его количество,
- Фермент ЦТК изоцитрат-дегидрогеназа активируется при помощи АМФ и АДФ и ингибируется влияниями АТФ и НАДН.
6. Белок-белковое взаимодействие
Термин белок-белковое взаимодействие обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент.
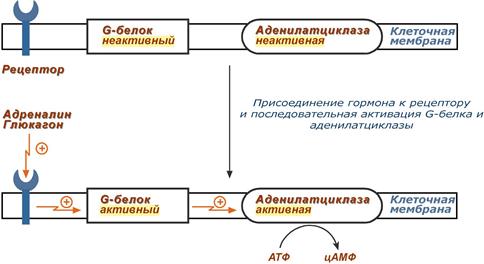
1. К примеру, мембранный фермент аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку некоторых гормонов (например, адреналина и глюкагона).
Упрощенная схема активации аденилатциклазы
Более подробно механизм активации G-белка можно посмотреть здесь.
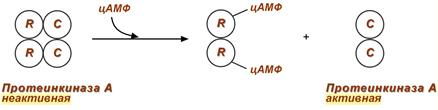
2. Еще примером белок-белкового взаимодействия может быть регуляция активности протеинкиназы А через механизм ассоциации-диссоциации .
Протеинкиназа А является тетрамерным ферментом, состоящим из 2 каталитических (С) и 2 регуляторных (R) субъединиц. Активатором для протеинкиназы А является цАМФ. Присоединение цАМФ к регуляторным субъединицам фермента вызывает их отхождение от каталитических субъединиц. Каталитические субъединицы при этом активируются.
Активация протеинкиназы А при помощи цАМФ
7. Ковалентная (химическая) модификация
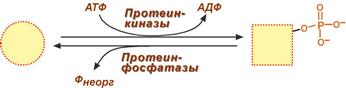
Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы.
Изменение активности фермента
при фосфорилировании-дефосфорилировании
Ферменты могут быть активны как в фосфорилированном , так и в дефосфорилированном состоянии .
Например, в мышцах ферменты гликогенфосфорилаза и гликогенсинтаза
- при нагрузке фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена и сжигание глюкозы, а гликогенсинтаза при этом неактивна.
- во время отдыха при синтезе гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.
Источник
РЕГУЛЯЦИЯ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ



Общая характеристика принципов и механизмов регуляции ферментативных реакций.
Регуляция ферментативных реакций — основа адаптации живых систем к изменяющимся условиям внешней среды.Благодаря возможности изменять скорость протекающих в организме биохимических процессов, создаются условия для поддержания постоянства внутренней среды организма, т.е. гомеостаза.
Основные принципы и механизмы регуляции ферментативных реакций.
1.регулирование скорости реакции путем изменения количества субстрата
2.регулирование скорости ферментативной реакции путем изменения количества фермента
3.регулирование скорости ферментативной реакции путем изменения каталитической активности фермента
Каталитическая активность фермента может быть изменена с помощью следующих механизмов;
а) ковалентная модификация структуры фермента
б) аллостерическое регулирование
в) каскадный механизм регулирования активности поли-ферментной системы.
г) изостерическое или конкурентное ингибирование
Кроме того, на активность фермента могут оказывать влияние следующие факторы, не являющиеся регуляторными, но при определенных условиях изменяющие скорость функционирования ферментов:
Источник
РЕГУЛЯЦИЯ СКОРОСТИ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Особенностью ферментативных реакций является наличие механизмов регуляции их скорости. Благодаря регуляторным механизмам ферментативные реакции протекают со скоростями, соответствующими потребностям организма. Например, при выполнении мышечной работы резко повышается скорость реакций окисления, сопровождающихся выделением энергии, и одновременным снижением скорости реакций синтеза, потребляющих энергию. Во время отдыха после работы наблюдается возрастание скорости реакций синтеза химических соединений, использованных при выполнении физических нагрузок.
К основным механизмам регуляции скорости ферментативных реакций можно отнести следующие:
• Изменение скорости синтеза ферментов.Ферменты, являясь белками, постепенно разрушаются, и поэтому в клетках постоянно синтезируются новые ферментные белки. При повышении скорости образования новых ферментов их содержание в клетках возрастает. При этом скорость ферментативных реакций увеличивается, так как зависимость скорости реакции от концентрации фермента носит прямолинейный характер.
При уменьшении выработки ферментов их концентрация в клетках постепенно снижается, что сопровождается падением скорости катализируемых ими реакций.
Изменение скорости синтеза ферментов обычно происходит под влиянием гормонов, которые ускоряют или замедляют первый этап синтеза ферментных белков — считывание генетической информации -транскрипцию. Поэтому данный механизм регуляции часто называется регуляцией на генетическом уровне.
• Модификация ферментов.Под модификацией понимается не
значительное изменение химического состава молекулы фермента,
приводящее к изменению каталитической активности.
Модификация может быть обратимой и необратимой.
В первом случае изменение строения фермента носит обратимый характер и фермент может многократно менять свою активность.
Например, некоторые ферменты содержат в своей молекуле остаток фосфорной кислоты. При отщеплении фосфатного остатка у одних ферментов каталитическая активность снижается; при включении его снова в состав ферментов активность их возрастает.
У других же ферментов фосфорилированная форма (содержащая фосфат), наоборот, малоактивна. Отщепление фосфорной кислоты от таких ферментов ведет к повышению их активности.
Примером необратимой модификации служит активация пищеварительных ферментов, действующих на пищевые белки. Так, в составе желудочного сока содержится белок пепсиноген, не обладающий каталитической активностью. В полости желудка под действием соляной кислоты от этого белка отщепляется небольшой полипептид и образуется очень активный фермент, расщепляющий в пищевых белках пептидные связи, — пепсин. (Белки, являющиеся предшественниками ферментов, называются проферментами.)
• Изменение конформации ферментов.Изменение конформации, т. е. пространственного строения ферментного белка, происходит под действием неконкурентных ингибиторов и активаторов, которыми могут быть гормоны, промежуточные и конечные продукты фермента тивных реакций, ионы металлов, лекарства. Изменение конформации ферментов возможно и при изменении условий среды,
например при повышении или снижении кислотности.
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ
Как уже отмечалось, в процессе обмена веществ в организме происходят различные реакции окисления, которые объединяют термином биологическое окисление.
Основным типом биологического окисления является тканевое дыхание, протекающее в клеточных митохондриях (в связи с этим тканевое дыхание еще называется митохондриальным окислением).
ТКАНЕВОЕ ДЫХАНИЕ
Тканевое дыхание — это основной способ получения АТФ, используемый всеми клетками организма (кроме красных клеток крови).
В процессе тканевого дыхания от окисляемого вещества отнимаются два атома водорода (два протона и два электрона) и по дыхательной цепи, состоящей из ферментов и коферментов, передаются на молекулярный кислород — О2) доставляемый кровью из воздуха во все ткани организма. В результате присоединения атомов водорода к кислороду образуется вода. За счет энергии, выделяющейся при движении электронов по дыхательной цепи, в митохондриях осуществляется синтез АТФ из АДФ и фосфорной кислоты. Обычно образование одной молекулы воды сопровождается синтезом трех молекул АТФ.
В упрощенном виде тканевое дыхание может быть представлено следующей схемой:
| Окисленное вещество |
 |
3 АДФ + 3 Н3РО4 à ЗАТФ
В качестве субстратов окисления (т. е. веществ, от которых отнимается водород) в тканевом дыхании используются разнообразные промежуточные продукты распада белков, углеводов и жиров. Однако наиболее часто окислению подвергаются промежуточные продукты цикла трикарбоновых кислот (ЦТК) — цикла Кребса (изолимонная, а-кетоглутаровая, янтарная и яблочная кислоты). Цикл Кребса — это завершающий этап катаболизма, в ходе которого происходит окисление остатка уксусной кислоты, входящей в ацетилкофермент А, до СО2 и Н2О.
В свою очередь, ацетилкофермент А — это универсальный метаболит организма, в который при своем распаде превращаются главные органические вещества — белки, углеводы и жиры.
Тканевое дыхание представляет собой сложный ферментативный процесс.
Все ферменты тканевого дыхания делятся на три группы:
· никотинамидные дегидрогеназы,
· флавиновые дегидрогеназы и
· цитохромы.
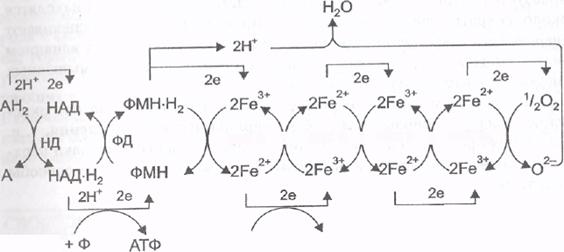
Никотинамидные дегидрогеназы отнимают два атома водорода от окисляемого субстрата и временно присоединяют их к своему коферменту НАД (никотинамидадениндинуклеотид). По строению НАД является динуклеотидом, в котором два нуклеотида соединяются между собой остатками фосфорной кислоты. В состав одного из нуклеотидов в качестве азотистого основания входит амид никотиновой кислоты (никотинамид, витамин РР), вторым нуклеотидом является аденозинмонофосфат (АМФ):
Отнимаемые от окисляемого вещества атомы водорода присоединяются непосредственно к никотинамиду (отсюда название данных ферментов — никотинамидные дегидрогеназы), при этом НАД переходит в свою восстановленную форму НАД Н2:
АН2 + НАД à А + НАД-Н2
Флавиновые дегидрогеназы отщепляют два атома водорода от образовавшегося НАД-Н2 и временно присоединяют их к своему кофер-менту ФМН (флавинмононуклеотид). По строению этот кофермент является мононуклеотидом, содержащим витамин В2 (рибофлавин):
 |
Рибофлавин (витамин В2)
Два атома водорода, отнимаемые флавиновыми дегидрогеназами от восстановленного НАД (НАД-Н2), присоединяются к флавину, выполняющему роль акцептора водорода. В результате этой стадии образуется восстановленная форма кофермента — ФМН-Н2:
НАД-Н2 + ФМН — —> НАД + ФМН-Н2
В некоторых случаях флавиновые дегидрогеназы, подобно никоти-намидным, отнимают два атома водорода непосредственно от окисляе-
мых веществ. Такие флавиновые дегидрогеназы используют кофермент
ФАД (флавинадениндинуклеотид), похожий по строению на ФМН и тоже содержащий витамин В2:
АН2 + ФАД à А + ФАД- Н2
Окисляемое вещество Окисленное вещество
Следующая группа ферментов — цитохромы.Эти ферменты участвуют только в переносе электронов. По строению цитохромы похожи на одну из субъединиц гемоглобина. Молекула цитохрома состоит из полипептида и гема. Но в отличие от гемоглобина железо, входящее в гем цитохромов, имеет переменную валентность. Способность железа обратимо переходить из окисленной формы в восстановленную
(Fе 3+ + е à Fе 2+ ) обеспечивает возможность переноса электронов данными ферментами.
С помощью цитохромов (их имеется несколько: b, с, а, a3) электроны от восстановленных коферментов ФМН-Н2 и ФАД-Н2 передаются на молекулярный кислород (О2), который при этом переходит в активную, анионную, форму — О 2
. Далее активный кислород (О 2
) связывается с ионами водорода (протонами), которые тоже отщепляются от ФМН-Н2 или от ФАД-Н2. Присоединение ионов водорода к аниону кислорода приводят к образованию воды.
Таким образом, на всем протяжении дыхательной цепи наблюдается передвижение электронов. Движение электронов вызвано тем, что все участники дыхательной цепи располагаются по мере возрастания их окислительно-восстановительных потенциалов.
Окислительно-восстановительный потенциал, или редокс-потенциал, характеризует способность вещества принимать и удерживать электроны. Поэтому электроны переносятся от вещества с низким редокс-потенциалом к веществу с более высоким редокс-потенциалом.
Поскольку самое низкое значение редокс-потенциала имеет окисляемое вещество, а самое высокое — кислород, то в итоге электроны от окисляемого вещества поступают на молекулу кислорода.
Как уже отмечалось, движение электронов по дыхательной цепи со- провождается выделением энергии. Около половины энергии движения, электронов аккумулируется в макроэргических связях молекул АТФ. Другая часть энергии выделяется в виде тепла. Синтез АТФ происходит при переносе электронов с НАД-Н2 на ФМН, с цитохрома b на цитохром с и c цитохрома а на цитохром а3. Всего при переносе двух атомов водорода на кислород (г. е. в расчете на одну образовавшуюся молекулу воды) синтезируется три молекулы АТФ.
Некоторые субстраты (жирные кислоты, янтарная кислота и др.) имеют более высокий редокс-потенциал, чем НАД. Поэтому они не могут окисляться ншкотинамидными дегидрогеназами. В этом случае отнятие атомов водорода от таких субстратов осуществляется флавиновыми дегидрогеназами. Из-за отсутствия никотинамидных дегидрогеназ при окислении таких веществ образуется только две молекулы АТФ.
На рис. представлена схема тканевого дыхания, включающая все группы ферментов.
 |  |
АДФ
|
Фн+АДФ АТФ Фн +АДФ АТФ
Образование АТФ в процессе тканевого дыхания часто обозначается терминами: окислительное фосфорилирование, дыхательное фосфорилирование, аэробное фосфорилирование, или аэробный синтез АТФ.
В сутки в организме за счет тканевого дыхания возникает не менее 40 кг АТФ, а у спортсменов еще больше. Поэтому этот процесс потребляет большое количество окисляемых веществ и кислорода.
При незначительной потребности клеток в АТФ тканевое дыхание протекает с низкой скоростью. Если клетка начинает использовать большое количество АТФ, то скорость тканевого дыхания возрастает и может достигнуть максимальных величин. Такой характер изменения скорости обусловлен тем, что активатором ферментов тканевого дыхания является избыток АДФ, который возникает в клетке только при интенсивном использовании АТФ.
Митохондрии, в которых протекает тканевое дыхание, имеются во всех клетках (кроме красных клеток крови) и представляют собою вытянутые палочковидные образования длиной 2-3 мкм* и толщиной около 1 мкм. Количество митохондрий в клетках может достигать тысячи и более. Митохондрии снаружи окружены двойной мембраной. Внешняя мембрана гладкая, а внутренняя складчатая, с большой поверхностью Ферменты тканевого дыхания встроены во внутреннюю мембрану и располагаются в ней в виде отдельных скоплений, называемых дыхательными ансамблями.Каждый дыхательный ансамбль содержит все необходимые ферменты для обеспечения переноса электронов в процессе тканевого дыхания. Благодаря строго упорядоченному расположению ферментов в дыхательных ансамблях передвижение электронов по дыхательной цепи осуществляется с большой скоростью.
В клетках митохондрии часто располагаются в том месте, где используется энергия АТФ. В мышечных клетках митохондрии находятся около сократительных элементов — миофибрилл — и обеспечивают энергией их сокращение в процессе мышечной работы. Под влиянием систематических тренировок количество митохондрий в мышечных клетках значительно увеличивается.
Как выше отмечалось, тканевое дыхание (митохондриальное окисление) является основным способом биологического окисления,т. е. окисления органических соединений в живом организме. Однако наряду с тканевым дыханием в организме еще имеются и другие способы окисления.
АНАЭРОБНОЕ ОКИСЛЕНИЕ
В некоторых случаях отнятие атомов водорода от окисляемых веществ происходит в цитоплазме и здесь же отщепленный водород присоединяется не к кислороду (как в случае тканевого дыхания), а к какому-то другому веществу. Наиболее часто таким акцептором водорода является пировиноградная кислота,возникающая при распаде углеводов и аминокислот. В результате присоединения атомов водорода пировиноградная кислота превращается в молочную кислоту(лактат). Таким образом, при данном типе окисления вместо конечного продукта — воды — образуется другой конечный продукт — молочная кислота, причем это происходит без потребления кислорода, т. е. анаэробно.За счет выделяющейся при этом энергии в цитоплазме осуществляется синтез АТФ, который получил название анаэробное, иди субстратное фосфорилирование,или же анаэробный синтез АТФ.Биологическое назначение данного типа окисления — получение АТФ без участия тканевого дыхания и кислорода.
ОКИСЛЕНИЕ
В некоторых случаях при окислении кислород включается в молекулы окисляемых веществ. Такое окисление протекает на мембранах цитоплазматической сети и носит название микросомальное окисление.За счет включения кислорода в молекуле окисляемого субстрата возникает гидроксильная группа (-ОН), в связи с чем этот вид окисления часто называют гидроксилированием.В гидроксилировании принимает участие витамин С (аскорбиновая кислота).
Микросомальное окисление не сопровождаетсясинтезом АТФ, его биологическая роль заключается в следующем.
Во-первых, за счет микросомального окисления осуществляется включение атомов кислорода в синтезируемые вещества (например, при синтезе белка коллагена, гормонов надпочечников).
Во-вторых, микросомальное окисление участвует в обезвреживании различных токсичных соединений, поступающих в организм извне или образующихся в процессе метаболизма. Включение кислорода в молекулу яда уменьшает его токсичность и делает его более водорастворимым, что облегчает его выведение из организма почками.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Источник