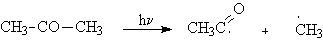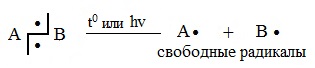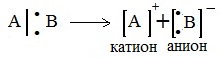Способы разрыва ковалентной химической связи
Теоретические представления в органической химии
Если в ходе реакции один из атомов отдает свой электрон другому атому, то образуются две противоположно заряженные частицы.
Химическая связь, для которой характерно сильное взаимодействие общей электронной пары с ядром только одного из соединяемых атомов, что приводит к образованию противоположно заряженных ионов, которые электростатически притягиваются друг к другу, называется ионной связью. В ионных соединениях молекулы в строгом понимании этого слова отсутствуют и сами ионы располагаются в узлах кристаллической решетки. Таким образом, каждый ион натрия в нашем примере оказывается одновременно связанным с шестью ионами хлора.
В тех случаях, когда атом водорода связан полярной ковалентной связью (активный атом), он может проявлять остаточное сродство к электрону и за счет этого образовывать дополнительную связь с теми атомами, которые имеют неподеленные электронные пары. Образование водородной связи обусловлено тем, что атом водорода может близко подходить к неподеленным электронным парам других атомов, потому что он имеет малые размеры и слабо экранирован. Водородная связь бывает межмолекулярной и внутримолекулярной.
Способы разрыва химической связи
Двухэлектронная связь может быть разорвана двумя способами: гетеролитическим и гомолитическим. При гетеролизе связи пара электронов остается с одним из бывших партнеров, при этом возникает два иона: катион и анион. При этом в случае разрыва связи С-Х соединения R3C-X возможны несколько вариантов:
1. При гетеролитическом разрыве связи Х превращается в положительно заряженную частицу. Тогда органический остаток, приобретя лишний электрон, становится карбанионом
2. При гетеролитическом разрыве связи Х уносит с собой электронную пару и R3C становится обладателем вакантной орбитали и положительного заряда – карбкатион
3. Гомолиз связи приводит к образованию двух нейтральных частиц, каждая из которых обладает неспаренным электроном. Такие частица в органической химии называются радикалами. В неорганической химии неспаренными электронами обладают атомы водорода, галогенов.
Реакционные частицы могут быть выделены в редких случаях, но строение продуктов реакции является свидетельством их участия в реакционных актах.
Центральный атом углерода в карбанионах предельного ряда сохраняет sp 3 -гибридизацию. Электронная пара заселяет вакантную орбиталь и может легко претерпевать инверсию. Карбанионы винильного типа сохраняют sp 2 -гибридизацию и существуют в цис- и транс-конфигурации.
Карбанионы образуются при ионизации металлоорганических соединений и при действии сильных оснований на кислые С-Н-группы.
Их устойчивость и, соответственно, легкость образования зависят от гибридного состояния атома углерода
Карбанион R 3 C: — H2C=CH: — HC≡C: —
рКа сопряженной кислоты 40 36 25,
а также от характера соседних групп: группы с сильным -I-эффектом повышают устойчивость карбанионов, оттягивая электронную пару:
Группы, способные делокализовать электронную пару, также стабилизируют карбанионы:
Геометрия карбкатионов соответствует плоскому атому углерода, имеющему вакантную орбиталь
Образование карбкатионов происходит в результате ионизации соединений содержащих группу с сильным -I-эффектом под действием полярных сред, кислот Льюиса, а также при присоединении протона к этиленовой связи, или координации на карбонильный кислород и т.д.
Стабилизации карбкатионов способствуют соседние группы, обладающие положительным индуктивным и мезомерным эффектом.
Наиболее эффективная стабилизация наблюдается при делокализации p-электронов с участием ароматической p-электронной системы
Геометрия радикалов, как и карбанионов, пирамидальная и может легко претерпевать инверсию.
Для получения радикалов применяют термолиз или фотолиз.
Другой способ генерации радикалов – одноэлектронное восстановление катионов диазония
Факторы, повышающие устойчивость свободных радикалов, индуктивный, мезомерный эффект, сопряжение p-электронов.
Источник
Механизмы реакций в органической химии
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии.
Механизмы разрыва химических связей в органических реакциях
| Гомолитический разрыв связи – это такой разрыв химической связи, когда каждый атом получает при разрыве связи по одному электрону из общей электронной пары. |
Образующиеся при этом частицы — это свободные радикалы.
| Свободные радикалы – это частицы, каждая из которых содержит один неспаренный электрон. A:B → A∙ + ∙B Гомолитический разрыв связи характерен для слабо полярных или неполярных связей. Условия протекания радикальных реакций:
Например , взаимодействие метана с хлором протекает по цепному радикальному механизму. То есть реакция протекает как цепь последовательных превращений с участием свободных радикалов. Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат один или несколько неспаренных электронов. Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом. Этапы радикально-цепного процесса: Стадия 1. Инициирование цепи. Под действием кванта света или при нагревании молекула галогена распадается на радикалы: Cl:Cl → Cl⋅ + ⋅Cl Стадия 2. Развитие цепи. Радикалы взаимодействуют с молекулами с образованием новых молекул и радикалов. Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород. При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с молекулой хлора: CH4 + ⋅Cl → CH3⋅ + HCl Стадия 3. Обрыв цепи. При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами. При этом образуются молекулы, т.е. радикальный процесс обрывается. Могут столкнуться разные радикалы, в том числе два метильных радикала:
При гетеролитическом разрыве связи образуются ионы – положительно заряженный катион и отрицательно заряженный анион. A:B → A: – + B +
Гетеролитический (ионный) механизм характерен для полярных и легко поляризуемых связей. Условия протекания ионных реакций:
Присоединение галогеноводородов (гидрогалогенирование). Например, этилен взаимодействует с бромоводородом: Реакция протекают по механизму электрофильного присоединения в несколько стадий. I стадия. Электрофилом является протон Н + в составе бромоводорода. Катион водорода присоединяется к атому углерода при двойной связи и образуется карбокатион . На втором атоме углерода, который потерял электроны π-связи, образуется положительный заряд: II стадия. Карбокатион взаимодействует с анионом Br – : При присоединении галогеноводородов и других полярных молекул к симметричным алкенам образуется одно вещество. Например , при присоединении бромоводорода к этилену образуется только бромэтан. При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Например , при взаимодействии хлороводорода HCl с пропиленом атом водорода присоединяется преимущественно к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан. При этом 1-хлорпропан образуется в незначительном количестве: В некоторых случаях присоединение к двойным связям происходит против правила Марковникова. Исключения из правила Марковникова: 1) Если в молекуле присутствует заместитель, который оттягивает на себя электронную плотность двойной связи. Например , при взаимодействии 3-хлорпропена с хлороводородом HCl преимущественно образуется 1,3-дихлорпропан. Атом хлора смещает к себе электронную плотность, поэтому π-электронная плотность двойной связи смещена к менее гидрогенизированному атому углерода: 2) Если в реакционной системе присутствуют свободные радикалы или источники свободных радикалов, то реакция присоединения полярных молекул вида НХ к двойной связи протекает по радикальному механизму против правила Марковникова. Например , при присоединении бромоводорода к пропилену в присутствии пероксидов (H2O2 или R2O2) преимущественно образуется 1-бромпропан: Источник Способы разрыва ковалентной химической связиПо способу разрыва ковалентных связей органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные. 1. Свободнорадикальный (гомолитический) разрыв связей Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим: Такому разрыву подвергаются неполярные и малополярные ковалентные связи под действием света или высокой температуры. Образующиеся частицы содержат неспаренные электроны и называются свободными радикалами. Эти частицы обладают большой энергией и очень активны. 2. Ионный (гетеролитический) разрыв связей Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим: В результате образуются разноименно заряженные ионы – катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион — карбанионом. Устойчивы более разветвлённые катионы. Такому разрыву подвергаются полярные ковалентные связи. Образующиеся органические ионные частицы отличаются от неорганических тем, что они возникают в момент реакции. Источник |