Медицинские интернет-конференции
Языки
Апоптоз: молекулярно-клеточные механизмы развития, значение в обеспечении клеточного гомеостаза.
Булудова М.В., Полутов В.Э.
Резюме
В работе представлены современные данные литературы, относительно механизмов развития апоптоза, его принципиальных отличий от некроза, значение в поддержании клеточного гомеостаза в лимфоидной и других пролиферирующих тканях.
Ключевые слова
Статья
Апоптоз — форма гибели клетки, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении цитоплазматической мембраны без выхода содержимого клетки в окружающую среду. (Попков В.М., Чеснокова Н.П., Барсуков В.Ю., 2011).
Апоптоз играет жизненно важную роль в процессе эмбрионального и онтогенетического развития, имеет место при различных морфогенетических процессах, обеспечивает поддержание клеточного гомеостаза как в лимофоидной ткани, так и в других пролиферирующих тканях. Нарушение апоптоза в эмбриогенезе может приводить к внутриутробной гибели плода, врожденным уродствам или различным заболеваниям, в том числе и злокачественным новообразованиям.
Различают два типа гибели клетки: апоптоз и некроз. Принципиальные различия заключаются в следующем: некроз является результатом незапланированного события и происходит спонтанно, апоптоз формируется как четко — регулируемый, генетически-детерминируемый процесс элиминации клетки. Отличительной морфологической чертой апоптоза является коллапс ядра. Хроматин становится суперконденсированным в форме полумесяца по периферии ядра, в этот момент начинается фрагментация ДНК. Характерными признаками апоптоза, позволяющими отличить его от некроза, являются:
а) переход фосфатидилсерина из внутреннего монослоя цитоплазматической мембраны в наружный монослой; выход цитохрома С из межмембранного пространства митохондрий в цитоплазму
б) активация цистеиновых протеиназ (каспаз)
в) образование активных форм кислорода
г) сморщивание (blebbing) цитоплазматической мембраны
д) последующий распад ядра на части
е) фрагментация клеток на везикулы с внутриклеточным содержимым — апоптотические тельца
ж) апоптотические тела захватываются фагоцитирующими клетками микроокружения, как в случае некроза. При развитии апоптоза выброса клеточного содержимого не происходит, воспаление не возникает. Некроз распространяется обычно на группы клеток, в то время как апоптоз носит селективный характер в отношении отдельных клеток (Дмитриева Л.А., Максимовский Ю.М., 2009).
Стадии апоптоза
Стадия инициации. На этой стадии патогенный агент либо сам является информационным сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регуляторным структурам и молекулам. Инициирующие апоптоз стимулы могут быть трансмембранными или внутриклеточными. Трансмембранные сигналы подразделяют на отрицательные и положительные. Отрицательные сигналы обусловливают отсутствие или прекращение воздействия на клетку различных факторов роста, регулирующих деление и созревание клетки. Положительные сигналы генерируют запуск программы апоптоза. Так, связывание TNFα (FasL) с его мембранным рецептором CD95 (Fas) активирует программу смерти клетки. Среди внутриклеточных стимулов апоптоза зарегистрированы избыток Н+, свободные радикалы липидов и других веществ, повышенная температура, внутриклеточные вирусы и гормоны, реализующие свой эффект через ядерные рецепторы (например, глюкокортикоиды).
Стадия программирования. На этой стадии специализированные белки либо реализуют сигнал к апоптозу путём активации исполнительной функции, либо блокируют потенциально летальный сигнал. Выделяют два варианта реализации стадий программирования: 1) путём прямой активации эффекторных каспаз и эндонуклеаз (минуя геном клетки) и 2) опосредованной через геном передачи сигнала на эффекторные каспазы и эндонуклеазы. Прямая передача сигнала осуществляется через адапторные белки, гранзимы и цитохром С. Опосредованная передача сигнала подразумевает репрессию генов, кодирующих ингибиторы апоптоза, и активацию генов, кодирующих промоторы апоптоза.
Стадия реализации программы состоит в собственно гибели клетки, осуществляемой посредством активации протеолитического и нуклеолитического каскадов.
Непосредственными исполнителями процесса «умертвления» клетки являются Ca2+,Mg2+ -зависимые эндонуклеазы и эффекторные каспазы. В результате разрушения белков и хроматина в процессе апоптоза клетка подвергается деструкции, когда в ней формируются и отпочковываются фрагменты клетки, содержащие остатки органелл, цитоплазмы, хроматина и цитолеммы, то есть апоптозные тельца.
Стадия удаления фрагментов погибших клеток. На поверхности апоптозных телец экспрессируются лиганды, с которыми взаимодействуют рецепторы фагоцитирующих клеток. Фагоциты быстро обнаруживают, поглощают и разрушают апоптозные тельца. Благодаря этому содержимое разрушенной клетки не попадает в межклеточное пространство. (Лихтенштейн А.В., Шапот В.С., 1998).
Одно из апоптотических событий реализуется в ядре клетки и заключается в фрагментации ДНК. Деградация ДНК является терминальной фазой апоптоза, связанной с проявлением активности различных эндонуклеаз, последние обусловливают либо появление крупных фрагментов ДНК, или развитие межнуклеосомальной деградации ДНК. Считают, что этот тип деградации обеспечивается активацией Са2+, Mg2+-зависимой эндонуклеазы.
Исследования последних лет привели к формированию принципиально новых представлений о механизме гибели клеток, имеющих повреждения ДНК, как о процессе, осуществляемом в соответствии с определенной генетической программой. В индукции этой программы при наличии повреждений в ДНК клетки важная роль принадлежит белку р53. Этот белок с молекулярной массой 53 кД, локализован в ядре клетки и является одним из транскрипционных факторов. Повышенная экспрессия этого белка приводит к репрессии ряда генов, регулирующих транскрипцию и причастных к задержке клеток в фазе клеточного цикла G1. Если же активность репарационных систем недостаточна и повреждения ДНК сохраняются, то в таких клетках индуцируется программируемая клеточная гибель, или апоптоз, что приводит к защите организма от присутствия клеток с поврежденной ДНК, т.е. мутантных и способных к злокачественной трансформации.
Таким образом, при действии генотоксических агентов р53 не только увеличивает время репарации ДНК. но также защищает организм от клеток с опасными мутациями. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Механизмы индукции апоптоза
Регуляция апоптоза обеспечивается гормонами, цитокинами и в значительной мере особенностями генома. Ослабление или устранение гормональных влияний на клетки- мишени приводит, как правило, к индукции апоптоза.
Цитокины — это обширная группа белков, регулирующих пролиферацию и дифференцировку клеток при связывании со специфическими рецепторами на клетках мишенях. Цитокины подразделяются на 3 большие группы: ростовые, семейство Фактора некроза опухоли и спиральные цитокины. Эффект цитокинов на клетки неоднозначен в связи с гетерогенностью их структуры и функции: для одних клеток ряд цитокинов выступают в роли индукторов апоптоза, а для других — в роли ингибиторов апоптоза. Это зависит от типа клетки, от стадии ее дифференцировки, от функционального состояния клетки. (Goodwin P.J., Ennis M., Pritchard K.I., 2002).
Наиболее хорошо изучена последовательность событий, приводящих клетку к апоптозу в результате взаимодействия белков из семейства TNFα со специфическими рецепторами. Ярким представителем этой группы белков является система Fas/Fas-L. Следует отметить, что для этой системы не известны другие функции, кроме как индукции апоптоза клетки. Взаимодействие Fas с Fas-L (лиганд) или с моноклональными антителами приводит к апоптозу клетки. При связывании лиганда с рецептором происходит олигомеризация цитоплазматических белков: (1) DD (домен смерти), относящийся к рецептору, (2) адапторного белка — FADD (Fas-ассоциированный домен смерти), содержащий DED — эффекторный домен смерти и (3) прокаспазы-8. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Важная роль в регуляции апоптоза клеток иммунной системы принадлежит другим цитокинам -интерлейкинам, интерферонам. Было обнаружено, что интерлейкины являются индукторами апоптоза как в здоровых, так и в малигнизированных клетках и клеточных линиях. Однако не только роль индукторов апоптоза свойственна интерлейкинам, не менее выраженный эффект цитокинов наблюдается в предотвращении апоптоза. При этом один и тот же IL может быть как индуктором апоптоза, так и его ингибитором. Так, например, IL 1 является индуктором апоптоза для клеток мышиной тимомы в случаях ингибирования размножения клеток и ингибитором апоптоза для этих же клеток в случаях их интенсивного размножения. Неоднозначна и роль интерферонов по влиянию на клетки. В одних случаях IFN вызывает апоптоз (клетки костного мозга), в других — является ингибитором апоптогенного сигнала (периферические моноциты человека).
Таким образом, апоптоз является тем механизмом, который обуславливает элиминацию клеток с определенной специфичностью рецепторов. (Миронова С.П., Котельников Г.П., 2013).
В настоящее время складывается впечатление о центральной роли протеаз в запуске и развитии процесса апоптоза. Причем, по-видимому, при апоптозе, в отличие от физиологического ответа клетки, действуют свои, характерные только для апоптоза, специализированные необратимые реакции протеолиза, катализируемые специфическими протеазами, относящихся к классу цистеиновых протеаз.
Роль наследственных факторов в регуляции апоптоза
Выяснение роли белков семейства Вс1-2 занимает центральное место в изучении регуляции процесса апоптоза. К настоящему времени известно, что белки этого семейства относятся либо к индукторам апоптоза (Bad, Bax, Bcl-Xs, Bik, Bid, Bak), либо к ингибиторам (Bcl-2, Bcl-XL). Белки семейства Bcl-2 находятся в постоянном динамическом равновесии, образуя гомо- и гетеродимеры, что в конечном счете влияет на развитие апоптоза клеток. Поэтому считается, что соотношение активных форм этих белков определяют реостат жизни и смерти клетки. (Попков В.М., Чеснокова Н.П., Захарова Н.Б., 2016).
Таким образом, апоптоз является общебиологическим механизмом, ответственным за поддержание постоянства численности клеточных популяций, а также формообразование и выбраковку дефектных клеток. Нарушение регуляции апоптоза приводит к возникновению различных заболеваний, связанных с усилением или, наоборот, ингибированием апоптоза. Следовательно, изучение механизмов регуляции различных этапов данного процесса позволит определенным образом воздействовать на его отдельные этапы с целью их регуляции или коррекции. В настоящее время общепринято: если клетка погибает от апоптоза — подразумевается возможность терапевтического вмешательства, если вследствие некроза — нет. На основе знаний о программированной гибели клетки используется широкий ряд препаратов с целью регуляции этого процесса в различных типах клеток.
Многообещающими являются также подходы, связанные с регуляцией апоптоз- специфических генов и реализующиеся, в частности, в генной терапии — одной из самых перспективных областей современной медицины — при лечении заболеваний, вызванных нарушением функционирования отдельных генов. (Макаренко Н.И., Поддубная И.В., Подрегульский К.Э., 2006).
Литература
1. Дмитриева Л.А., Максимовский Ю.М. — М. : ГЭОТАР-Медиа, 2009. — 912 с. — (Серия «Национальные руководства»)
2. Кочан Е.А. Молекулярно-генетические основы канцерогенеза // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2002. — №3. — С. 32-36.
3. Лихтенштейн А.В., Шапот В.С. Опухолевый рост: ткани, клетки, молекулы // Патологическая физиология. — 1998. — №3. — С. 25-44.
4.Макаренко Н.И., Поддубная И.В., Подрегульский К.Э. Новые возможности лекарственной терапии злокачественных опухолей // — М., 2006. – С.27.
5. Миронова С.П., Котельников Г.П., / Национальное руководство / — 2-е изд., перераб. и доп. — М. : ГЭОТАР-Медиа, 2013. — 944 с.
6. Паукова В.С., Пальцева М.А., Улумбекова Э.Г. Опухолевый рост // 2-е изд., испр. и доп. — М.: ГЭОТАР-Медиа, 2015. — 2500 с.
7. Попков В.М., Чеснокова Н.П., Барсуков В.Ю., / Канцерогенез : патофизиологические и клинические аспекты/ — Саратов : Изд-во: СГМУ, 2011, 600 с.
8. Попков В.М., Чеснокова Н.П., Захарова Н.Б., под общ. ред. В.М. Попкова, Н.П. Чесноковой./ Цитокины: биологическая роль в развитии реакций адаптации и повреждения в условиях нормы и патологии различного генеза/ — Саратов: Изд-во Сарат. гос. мед. ун-та, 2016.-448 с.
Источник
Способы разрушения клеток при апоптозе
• Удаление апоптотических клеток из организма представляет собой активный процесс
Удаление погибающих клеток является заключительным этапом апоптоза; при этом клетки удаляются бесследно. Это достигается за счет фагоцитоза («поедания клеток») или специальными фагоцитами (макрофаги, дендритные клетки), или клетками, выполняющими также и другие функции (например, эпителиальными).
Важность этапа эффективного удаления апоптотических клеток подчеркивается характеристиками апоптотической гибели, способствующими этому процессу, поскольку клетки упаковываются для удаления. Для облегчения переваривания ДНК и клетки нарезаются на небольшие фрагменты. Кроме того, клетки генерируют сигналы, содержащие инструкции для фагоцитов. Эти сигналы могут быть следующих видов: «найди меня», «съешь меня» и «не ешь меня».
Исследования, проведенные на C. elegans, позволили идентифицировать гены, играющие важную роль в удалении апоптотических клеток. Эти гены подразделяются на две комплементарные группы. Первая группа включает гены ced-1, ced-6 и ced-7, которые, вероятно, участвуют в узнавании клеток и формировании сигнала.
Ко второй группе относятся гены ced-2, ced-5 ced-10 и ced-12. Они, скорее всего, участвуют в захвате погибших клеток, а не в их узнавании. Все эти гены функционируют на уровне фагоцитов, влияя на способность этих клеток узнавать или поглощать апоптотические клетки, хотя один из них (ced-7) может также функционировать в погибающей клетке.
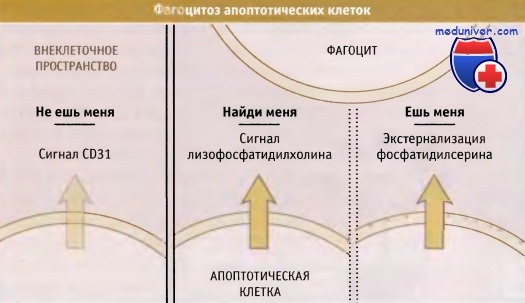
снижают интенсивность сигналов «не ешь меня» (CD31) и экспрессируют сигналы «ешь меня» (экстернализация фосфатидилсерина).
В результате гибнущая клетка быстро «поедается» такими «профессиональными» фагоцитами,
как макрофаги, или другими клетками (например, эпителиальными).
CED-1 представляет собой рецептор, который реагирует на изменения мембраны апоптотических клеток. Он относится к группе рецепторов клеток млекопитающих, которые называются рецепторы-уборщики. Показано, что у млекопитающих два таких рецептора, SREC (англ, scavenger receptor expressed by endothelial cells) и CD91, участвуют в поглощении апоптотических клеток культурой фагоцитов. Единственный ген у Drosophila, который функционирует в удалении апоптотических клеток и называется croquemort, также относится к семейству рецепторов-уборщиков.
Исследованиями на клетках млекопитающих показано, что критический сигнал «ешь меня» (хотя, может быть, и не единственный) возникает при экстернализации фосфатидилсерина, которая происходит при перемешивании (нарушении расположения) плазматической мембраны при функционировании эффекторной каспазы. Как показано на рисунке ниже, фосфатидилсерин обычно локализуется во внутреннем слое плазматической мембраны с участием АТФ-зависимой «флиппазы», которая переворачивает фосфолипид с наружной на внутреннюю сторону мембраны. (Термин «флипп» относится к перемещению липидов снаружи во внутрь. В литературе по апоптозу он часто употребляется неправильно, когда говорят о флиппе фосфатидилсерина. Последний, говоря техническим языком, представляет собой флоп.)
Если транслоказа неактивна (например, из-за дефицита АТФ), фосфатидилсерин медленно появляется на поверхности клеток; однако при апоптозе эта экстернализация происходит быстро и зависит от каспазы с участием процесса активного перемешивания липидов. Идентифицирована «скрамблаза» фосфолипидов, которая активируется ионами кальция, однако неясно, участвует ли она в апоптозе, и если участвует, то каким образом фермент активируется каспазами.
В этом отношении представляет интерес CED-7 C. elegans, поскольку он функционирует не только в фагоцитирующих клетках, но и в апоптотических. Гомологом этого белка является АВСА1, участвующий в реорганизации липидов плазматической мембраны. Предполагается, что этот белок играет важную роль в экстернализации фосфатидилсерина в клетках млекопитающих. Однако, по результатам последних исследований, в этом процессе у С. elegans. белок не участвует.
Фосфатидилсерин, находящийся на поверхности клеток млекопитающих, может связываться с некоторыми молекулами, присутствующими в межклеточной жидкости и играющими роль мостика между погибающей клеткой и фагоцитом. Одной из таких молекул является белок MFG-E8, который присутствует во многих внеклеточных жидких средах организма. Этот белок связывается с фосфатидилсерином погибающих клеток и с интегриновыми рецепторами фагоцитирующих клеток. У мышей с нарушенной функцией MFG-E8 отмечаются дефекты процесса удаления апоптотических клеток.
Экстернализацию фосфатидилсерина в апоптотических клетках легко подтвердить с использованием аннексина V, белка, связывающегося с фосфатидилсерином и содержащего флуоресцентную метку. Аннексин V не участвует в апоптозе, однако родственный белок, аннексии I, может способствовать узнаванию апоптотических клеток фагоцитами.
По-видимому, существуют и другие механизмы удаления апоптотических клеток у млекопитающих, и в ряде случаев они играют важную роль. Культура фагоцитов от мышей, дефектных по рецепторам с тирозинкиназной активностью, MER, обладает нарушенной функцией удаления гибнущих клеток. У таких животных наблюдается накопление апоптотических клеток. Какова роль MER в этих процессах, остается неясным.
Здоровые клетки способны экспрессировать сигналы «ешь меня»; например, повышение уровня кальция может запускать процесс перемешивания фосфолипидов с временной экстернализацией фосфатидилсерина. Однако такие клетки не удаляются, поскольку они также несут сигналы «не ешь меня», которые при апоптозе, вероятно, инактивируются. К числу одного из таких сигналов относится CD31, который присутствует у фагоцитов и у большинства здоровых клеток. Взаимодействие CD31 сигналов между собой может ингибировать удаление здоровых клеток и вызывать появление сигналов «ешь меня».
По мере того как клетки вступают в апоптоз, они могут активировать специализированные фагоциты, например макрофаги, генерируя сигнал «найди меня». Одним из таких сигналов является лизофосфатидилхолин, который образуется при действии активированной фосфолипазой А. Эффекторные каспазы могут активировать фосфолипазу А, расщепляя фермент. Существование этого пути увеличивает вероятность того, что апоптотические клетки будут обнаружены и эффективно удалены из организма.
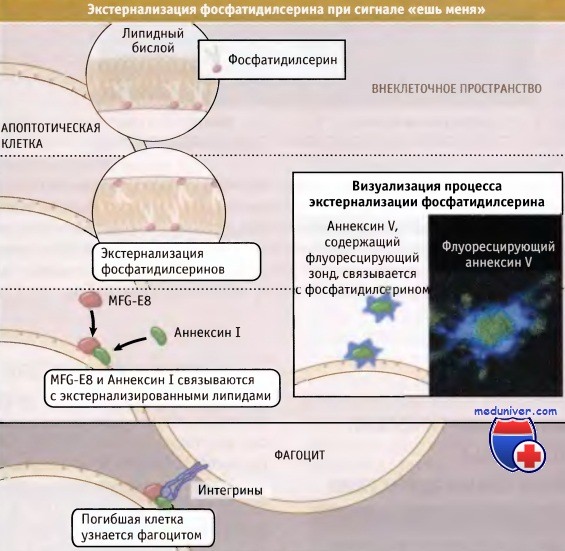
который обычно находится во внутреннем слое, оказывается снаружи.
Там он ассоциируется с такими белками, как Аннексин I и MFG-E8, которые, в свою очередь,
связываются фагоцитирующими клетками, впоследствии захватывающими апоптотические.
Экстернализацию фосфатидилсерина можно наблюдать с помощью Аннексина V, меченного флуоресцентным зондом.
На фотографии показана апоптотическая клетка, окрашенная Аннексином V.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
Источник




