Анализ смесей катионов
ХИМИЧЕСКИЙ АНАЛИЗ
Аналитическая химия. Химический анализ. Задачи и этапы анализа. Аналитический сигнал. Классификации методов анализа. Идентификация веществ. Дробный анализ. Систематический анализ.
Одной из задач при проведении природоохранных мероприятий является познание закономерностей причинно-следственных связей между различными видами человеческой деятельности и изменениями, происходящими в природной среде. Анализ — это главное средство контроля за загрязненностью окружающей среды. Научной основой химического анализа является аналитическая химия. Аналитическая химия — наука о методах и средствах определения химического состава веществ и материалов. Метод — это достаточно универсальный и теоретически обоснованный способ определения состава.
Основные требования к методам и методикам аналитической химии:
1) правильность и хорошая воспроизводимость;
2) низкий предел обнаружения — это наименьшее содержание, при котором по данной методике можно обнаружить присутствие определяемого компонента с заданной доверительной вероятностью;
3) избирательность (селективность) — характеризует мешающее влияние различных факторов;
4) диапазон измеряемых содержаний (концентраций) с помощью данного метода по данной методике;
6) простота в анализе, возможность автоматизации, экономичность определения.
Химический анализ — это сложный многостадийный процесс, представляющий собой совокупность готовых приемов и соответствующих служб.
· Идентификация объекта, т.е. установление природы объекта (проверка присутствия тех или иных основных компонентов, примесей).
· Количественное определение содержания того или иного компонента в анализируемом объекте.
Этапы анализа любого объекта:
1. Постановка задачи и выбор метода и схемы анализа.
2. Отбор проб (грамотный отбор части пробы позволяет сделать правильный вывод о составе всей пробы).
Проба — это часть анализируемого материала, представительно отражающая его химический состав. В отдельных случаях в качестве пробы используют весь аналитический материал. Время хранения отобранных проб должно быть минимальным. Условия и способы хранения должны исключать неконтролируемые потери легколетучих соединений и любые другие физические и химические изменения в составе анализируемого образца.
3. Подготовка проб к анализу: переведение пробы в нужное состояние (раствор, пар); разделение компонентов или отделение мешающих; концентрирование компонентов;
4. Получение аналитического сигнала.
Аналитический сигнал — это изменение любого физического или физико-химического свойства определяемого компонента, функционально связанное с его содержанием (формула, таблица, график).
5. Обработка аналитического сигнала, т.е. разделение сигнала и шумов. Шумы — побочные сигналы, возникающие в измерительных приборах, усилителях и других аппаратах.
6. Применение результатов анализа.
В зависимости от свойства вещества, положенного в основу определения метода анализа подразделяются на:
· Химические методы анализа основаны на химической аналитической реакции, которая сопровождается ярко выраженным эффектом. К ним относится гравиметрический и титриметрический методы.
· Физико-химические методы основаны измерение каких-либо физических параметров химической системы, зависящих от природы компонентов системы и изменяющихся в процессе химической реакции (например: фотометрия — основана на изменении оптической плотности раствора в результате реакции).
· Физические методы анализа не связаны с использованием химических реакций. Состав веществ устанавливается по измерению характерных физических свойств объекта (например: плотность, вязкость).
В зависимости от измеряемой величины все методы делятся:
| Измеряемая физическая величина | Название метода |
| Масса | Гравиметрия |
| Объем | Титриметрия |
| Равновесный потенциал электрода | Потенциалометрия |
| Поляризационное сопротивление электрода | Полярография |
| Количество электричества | Кулонометрия |
| Электропроводность раствора | Кондуктометрия |
| Поглощение фотонов | Фотометрия |
| Испускание фотонов | Эмиссионный спектральный анализ |
Идентификация веществ основывается на методах качественного распознавания элементарных объектов (атомов, молекул, ионов и др.), из которых состоят вещества и материалы.
Очень часто анализируемую пробу вещества переводят в форму, удобную для анализа, путем растворения в подходящем растворителе (обычно это вода или водные растворы кислот) или сплавлением с каким-либо химическим соединением с последующим растворением.
Химические методы качественного анализа основаны на использовании реакций идентифицируемых ионов с определенными веществами – аналитическими реагентами. Такие реакции должны сопровождаться выпадением или растворением осадка; возникновением, изменением или исчезновением окраски раствора; выделением газа с характерным запахом; образованием кристаллов определенной формы.
Реакции, протекающие в растворах, по способу выполнения классифицируются на пробирочные, микрокристаллоскопические и капельные. Микрокристаллоскопические реакции проводят на предметном стекле. Наблюдают образование кристаллов характерной формы. Капельные реакции выполняются на фильтровальной бумаге.
Аналитические реакции, применяемые в качественном анализе, по области применения делятся на:
1)групповые реакции — это реакции для осаждения целой группы ионов (применяется один реагент, который называется групповым);
2) характерные реакции:
а) селективные (избирательные) — дают одинаковые или сходные аналитические реакции с ограниченным числом ионов (2- 5 шт.);
б) специфичные (высокоселективные) — избирательны по отношению к одному компоненту.
Селективных и специфичных реакций немного, поэтому их применяют в сочетании с групповыми реакциями и со специальными приемами для устранения мешающего влияния компонентов, присутствующих в системе наряду с определяемым веществом.
Несложные смеси ионов анализируют дробным методом, т.е. без предварительного отделения мешающих ионов с помощью характерных реакций определяют отдельные ионы. Мешающий ион – это ион, который в условиях обнаружения искомого дает сходный аналитический эффект с тем же реактивом, либо аналитический эффект, маскирующий нужную реакцию. Обнаружение разных ионов в дробном анализе проводят в отдельных порциях раствора. При необходимости устранения мешающих ионов пользуются следующими способами отделения и маскировки:
1. Перевод мешающих ионов в осадок. В основе лежит различие в величине произведения растворимости получающихся осадков. При этом ПР соединения определяемого иона с реагентом должно быть больше, чем ПР соединения мешающего иона.
2. Связывание мешающих ионов в прочное комплексное соединение. Получаемый комплекс должен обладать необходимой устойчивостью, чтобы осуществить полное связывание мешающего иона, а искомый ион – совсем не реагировать с вводимым реагентом, либо его комплекс должен быть непрочным.
3. Изменение степени окисления мешающих ионов.
4. Использование экстракции. Метод основан на извлечении из водных растворов мешающих ионов органическими растворителями и разделении системы на составные части (фазы), чтобы мешающий и определяемый компонент были в разных фазах.
Преимущества дробного анализа:
— быстрота выполнения, т.к. сокращается время на длительные операции последовательного отделения одних ионов от других;
— дробные реакции легко воспроизводимы, т.е. их можно повторять несколько раз.
Однако в случае трудности подбора: селективных (специфических) реакций обнаружения ионов; маскирующих реагентов; расчета полноты удаления ионов и других причин (сложность смеси) прибегают к выполнению систематического анализа.
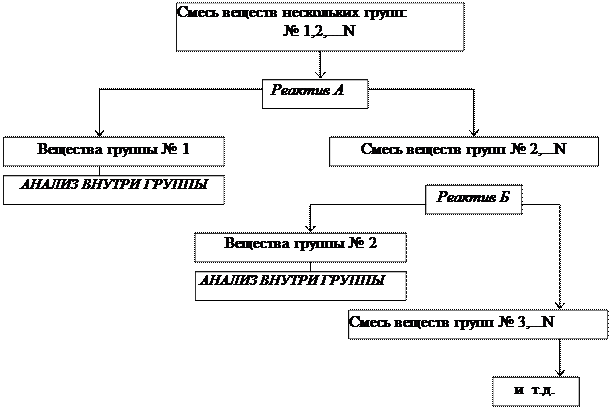
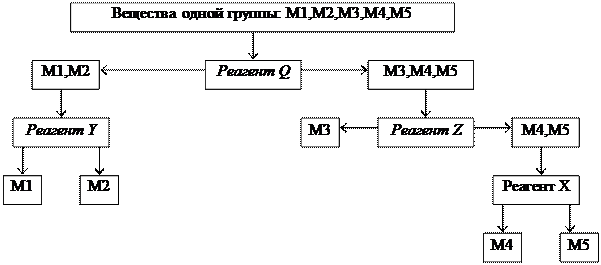
Систематический анализ — это полный (подробный) анализ исследуемого объекта, который проводится путем разделения всех компонентов в пробе на несколько групп в определенной последовательности. Деление на группы идет на основе сходства (внутри группы) и различия (между группами) аналитических свойств компонентов. В выделенной группе анализа применяется ряд последовательных реакций разделения, пока в одной фазе останутся лишь компоненты, дающие характерные реакции с селективными реагентами.
Разработано несколько аналитических классификаций катионов и анионов на аналитические группы, в основе которых лежит применение групповых реагентов (т.е. реагентов для выделения в конкретных условиях целой группы ионов). Групповые реагенты в анализе катионов служат как для обнаружения и разделения, а в анализе анионов – только для обнаружения.
Схема деления на группы:
Схема анализа группы:
 |
Анализ смесей катионов
Групповыми реагентами в качественном анализе катионов являются кислоты, сильные основания, аммиак, карбонаты, фосфаты, сульфаты щелочных металлов, окислители и восстановители. Объединение веществ в аналитические группы основано на использовании сходства и различий в их химических свойствах.
К наиболее важным аналитическим свойствам относятся способность элемента образовывать различные типы ионов, цвет и растворимость соединений, способность вступать в те или иные реакции.
Групповые реагенты выбирают из общих реактивов, поскольку необходимо, чтобы групповой реагент выделял относительно большое число ионов. Основной способ разделения – осаждение, т.е. деление на группы, основано на различной растворимости осадков катионов в определенных средах. При рассмотрении действия групповых реагентов можно выделить следующие группы:
| Группа | Катионы |
| Сульфатная | Ba 2+ , Sr 2+ , Ca 2+ |
| Хлоридная | Ag + , Pb 2+ , Hg 2+ |
| Тиосолей | Sn 2+ , Sn(IV), Sb 3+ , Sb(V), Hg 2+ |
| Гидроксидная | Sn 2+ , Sn(IV), Pb 2+ , Sb 3+ , Sb(V), Cr 3+ , Al 3+ , Zn 2+ |
| Аммиачная | Co 2+ , Ni 2+ , Cu 2+ , Ag + , Zn 2+ , Cd 2+ |
Кроме того, остаются три катиона (Na + , K + , NH4 + ) не образующие осадков с указанными групповыми реагентами. Их также можно выделить в отдельную группу.
Помимо указанного общего подхода, при выборе групповых реагентов исходят из значений произведений растворимости осадков, т.к. варьируя условия осаждения, можно разделить вещества из группы действием одного и того же реагента.
Наибольшее распространение получила кислотно-основная классификация катионов. Достоинства кислотно-основного метода систематического анализа: а) используются основные свойства элементов – их отношение к кислотам, щелочам; б) аналитические группы катионов в большей степени соответствуют группам периодической системы элементов Д.И. Менделеева; в) значительно сокращается время проведения анализа по сравнению с сероводородным методом.
Исследование начинают с предварительных испытаний, в которых устанавливают рН раствора по универсальному индикатору и обнаруживают ионы NH4 + , Fe 3+ , Fe 2+ специфическими и селективными реакциями.
Разделение на группы. Общая схема на группы дана в табл.2. В анализируемом растворе прежде всего отделяют катионы I и II групп. Для этого 10-15 капель раствора помещают в пробирку и добавляют по каплям смесь 2М HCl и 1М H2SO4. Оставляют осадок на 10 мин, затем его центрифугируют и промывают водой, подкисленной HCl. В осадке смесь хлоридов и сульфатов Ag + , Pb 2+ , Ba 2+ , Ca 2+ . Возможно и присутствие основных солей сурьмы. В растворе катионы III-VI групп.
Из раствора отделяют III группу прибавлением нескольких капель 3%-го H2O2 и избытка NaOH при нагревании и перемешивании. Избыток пероксида водорода удаляют кипячением. В осадке — гидроксиды катионов IV-V групп, в растворе – катионы III и VI групп и частично Ca 2+ , который может неполностью осадиться в виде CaSO4 при отделении I и II групп.
Из осадка отделяют катионы V группы. Осадок обрабатывают 2н Na2CO3 и затем избытком NH3 при нагревании. Катионы V группы переходят в раствор в виде аммиакатов, в осадке – карбонаты и основные соли катионов IV группы.
Источник
Качественый химический анализ катионов и анионов
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
КАЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ КАТИОНОВ И АНИОНОВ
Введение.
Под качественным химическим анализом вещества понимают определение его качественного состава, т.е. открытие (идентификацию) атомов, атомных групп, ионов и молекул в анализируемом веществе.
Существует два метода качественного анализа: дробный и систематический. Дробный качественный анализ предполагает обнаружение иона или вещества в анализируемой пробе с помощью специфического реагента в присутствие всех компонентов пробы. Примером такой реакции может служить обнаружение ионов аммония при подщелачивании раствора:
NH4 + + ОН – = NH3↑ + Н2O
Однако специфических реагентов известно немного. Более распространенны групповые реагенты, дающие сходные реакции с целой группой ионов.
Групповые реагенты используются в систематическом качественном анализе, который предусматривает разделение смеси анализируемых ионов по аналитическим группам, после чего внутри каждой группы с помощью тех или иных реакций разделяют и открывают индивидуальные ионы.
I. Качественный анализ катионов.
Аналитическая классификации катионов но группам.
В основу той или иной аналитической классификации катионов по группам положены их сходства или различия по отношению к действию определенных аналитических реагентов и свойства образующихся продуктов аналитических реакций (растворимость в воде, кислотах и щелочах, способность к комплексообразованию, окислительно-восстановительные свойства).
Существует ряд классификаций катионов по группам (или химических методов качественного анализа катионов). Наиболее распространенными среди них являются три классификации: сероводородная, аммиачно-фосфатная и кислотно-основная, причем сероводородный метод анализа в настоящее время практически не используется, т.к. требует применения токсичного сероводорода и довольно продолжителен.
Применение групповых реагентов позволяет подразделить многие катионы по аналитическим группам, однако не существует классификации, охватывающей все известные катионы или, по крайней мере, катионы всех металлов.
В таблицах 1.1, 1.2 и 1.3 представлены катионы в соответствии с сероводородной, аммиачно-фосфатной и кислотно-основной классификациями. В этих таблицах перечислены не все катионы, входящие в группу, а только те из них, которые наиболее часто встречаются в фармацевтическом анализе.
Нужно отметить, что в водных растворах «голые» индивидуальные катионы металлов не существуют, поскольку они термодинамически неустойчивы и образуют комплексы различного состава. Поэтому используемая в дальнейшем форма написания катионов Mg 2+ , Bi 3+ и т.д. означает лишь, что речь идет о соединениях элементов в соответствующих степенях окисления, а не о действительном существовании таких ионов.
Таблица 1.1 Сероводородная классификация катионов.
Группа
Катионы
Групповой реагент
I
Li + , Na + , K + , NH4 + , Mg 2+
II
Са 2+ , Sr 2+ , Ba 2+
II
Al 3+ , Cr 3+ , Zn 3+ , Mn 3+ , Fe 2+ , Fe 3+ , Co 2+ , Ni 2+
IV
Cu 2+ , Cd 2+ , Mg 2+ , Bi 3+ , Sn 3+ , Sn 4+ , Sb 5+ , As 3+ , As 5+
Раствор H2S, pH= 0,5 (HCI)
Ag + , Hg2 2+ , Pb 2+
Таблица 1.2. Аммиачно-фосфатная классификация катионов.
Группа
Катионы
Групповой реагент
I
II
Li + , Mg 2+ , Са 2+ , Sr 2+ , Ba 2+ , Mn 2+ , Fe 2+ , Al 3+ , Bi 3+ , Cr 3+ , Fe 3+ *
III
Cu 2+ , Zn 2+ , Cd 2+ , Mg 2+ , Ni 2+
Раствор (NH4)2HPO4; фосфаты растворимы в водном аммиаке
IV
Sn 2+ , Sn 4+ , As 3+ , As 5+ , Sb 3+ , Sb 5+
V
Ag + , Hg2 2+ , Pb 2+
* Фосфаты двухзарядных катионов растворимы в уксусной кислоте (2 моль/л), трехзарядных — нет.
Таблица 1.3. Кислотно-основная классификация катионов.
Группа
Катионы
Групповой реагент
I
Li + , Na + , K + , NH4 +
II
Ag + , Hg 2+ , Pb 2+
III
Ca 2+ , Sr 2+ , Ba 2+
IV
Zn 2+ , Al 2+ , Sn 2+ , Sn 4+ , As 3+ , As 5+ , Cr 3+
Раствор NaOH в присутствии
H2O2
V
Mg 2+ , Sb 3+ , Sb 5+ , Bi 2+ , Mn 2+ , Fe 2+ , Fe 3+
Раствор NaOH или раствор
аммиака (25 %)
VI
Cu 2+ , Cd 2+ , Hg 2+ , Co 2+ , Ni 2+
Раствор аммиака (25 %)
II. Кислотно-основная классификация катионов.
Систематический анализ катионов по кислотно-основному методу.
2.1. Кислотно-основная классификация катионов.
Данная классификация катионов основана на использовании и качестве групповых реагентов водных растворов кислот и оснований – HCl, H2SO4, NaOH или KOH, NH3*H2O.
Катионы, открываемые в рамках кислотно-основной классификации, подразделяют на шесть аналитических групп (табл. 1.3).
К первой аналитической группе относят катионы Li + , Na + , К + , NH4 + . Групповой реагент отсутствует.
Вторая аналитическая группа представлена катионами Ag + , Hg2 2+ , Pb 2+ . Групповой реагент – раствор НСl (обычно с концентрацией 2 моль/л). Групповой реагент осаждает из водных растворов катионы второй аналитической группы в виде осадков малорастворимых в воде AgCl, Hg2Cl2, РbСl2. Их произведения растворимости при комнатной температуре равны соответственно 1,8*10 -10 , 1,3*10 -18 , 1,6*10 -5 . При действии группового реагента катионы Рb 2+ осаждаются не полностью – частично они остаются в растворе.
К третьей аналитической группе относят катионы Са 2+ , Sr 2+ , Ba 2+ (Рb 2+ иногда). Групповой реагент – раствор H2SO4. Катионы осаждаются в виде малорастворимых CaSO4 (ПР = 2,5*10 -5 ), SrSO4 (ПР = 3,2*10 -7 ), BaSO4 (ПР = 1,1*10 -10 ), PbSO4, (ПР = 1,6*10 -8 ). При действии группового реагента ионы Са 2+ осаждаются не полностью. Для более полнго осаждения ионов кальция в форме CaSО4 к раствору прибавляют этанол, в присутствие которого растворимость сульфата кальция уменьшается. Осадки CaSО4, SrSО4, BaSО4 практически нерастворимы в разбавленных кислотах и щелочах. Сульфат кальция растворим в водном растворе (NH4)2SО4 с образованием комплекса (NH4)2[Ca(SО4)2].
Четвертая аналитическая группа включает катионы Аl 3+ , Cr 3+ , Zn 2+ , As 3+ , As 5+ , Sn 2+ , Sn 4+ . Иногда сюда же относят катионы Sb 3+ . Групповой реагент – водный раствор NaOH (или КОН) в присутствии Н2О2 (обычно избыток 2 моль/л раствора NaOH в присутствии Н2О2(%)), иногда – без Н2О2. При действии группового реагента катионы IV аналитической группы осаждаются из водного раствора в виде амфотерных гидроксидов, растворимых в избытке группового реагента с образованием гидроксомплексов:
| А1 3+ + 3ОН – = А1(ОН)3 | Al(ОН)3 + 3ОН – = [А1(ОН)6] 3- |
| Сг 3+ + 3ОН – = Сг(ОН)3 | Сг(ОН)3 + 3ОН – = [Сг(ОН)6] 3- |
| Zn 2+ + 2ОН – = Zn(OH)2 | Zn(OH)2 + 2OH – = [Zn(OH)4] 2- |
| Sn 2+ + 2ОH – = Sn(OH)2 | Sn(OH)2 + 4OH – = [Sn(OH)6] 4- |
2. Открытие NH4 + :
а) раствор + KOH (NaOH) → NH3↑ (водяная баня) – запах, влажная лакмусовая бумажка синеет
б) раствор + K2[HgJ4], KOH (реактив Несслера) = [(JHg)2NH2]J ↓ – красно-бурый осадок
II. Систематический анализ смеси катионов (см. схему 1).
2.2.2. Анализ смеси катионов второй аналитической группы: Ag + ,Hg 2+ ,Pb 2+ .
Открыть ионы дробно в смеси невозможно, т.к. нет избирательного реагента, поэтому проводят систематический анализ.
К анализируемому раствору прибавляют на холоде групповой реагент-раствор (2 моль/л) HCI до полного выделения осадка, состоящего из AgCl, Hg2CI2, РиСl2 (если раствор остается прозрачным при добавлении 2 капель НCl, осаждение считается полным).
Ход систематического анализа смеси катионов данной группы представлен в схеме 2.
2.2.3. Анализ смеси катионов третьей аналитической группы: Сa 2+ , Sr 2+ , Ba 2+ .
Анализ раствора, содержащего смесь катионов третьей аналитической группы, обычно проводят по следующей схеме.
Вначале проводят предварительные испытания: в отдельных небольших пробах анализируемого раствора дробно открывают катионы, присутствующие в растворе, учитывая их взаимное влияние друг на друга. Часто этим ограничиваются. При необходимости проводят систематический анализ, как описано в схеме 3.
I. Предварительные испытания.
1. Открытие катионов бария (II):
Ва 3+ + К2Сr2O7 (в прис. СН3СОО – ) → ВаСrО4 ↓ – желтый, осадок не растворяется в разбавленной уксусной кислоте;
2. Sr 2+ и Са 2+ может открыть, только если нет Ва 2+ .
Sr 3+ + CaSО4 → SrSO4↓ + Са 2+ (реакция с гипсовой водой);
Са 2+ + K4[Fe(CN)6] + 2 NH4 + → (NH4)2Ca[Fe(CN)6]↓ белый осадок (Sr 2+ не мешает);
3. Если нет Ва 2+ и Sr 2+ , то Са 2+ + Na2C2O4 → СаС2O4 ↓ белый
Осадки гидроксидов не растворяются в полном аммиаке, за исключением Zn(OН)2, который образует аммиачный комплекс [Zn(NH3)4] 2+ . В присутствии H2О2 катионы Cr 3+ , As 3+ , Sn 2+ окисляются соответственно до СrO4 2- , AsO4 3- , [Sn(ОH)6] 2- ионов. Мышьяк (III) и мышьяк (V) считаются катионами As 3+ , As 5+ условно, т.к. в полных растворах они присутствуют и виде ионов AsO3 3- и AsO4 3- соответственно.
В пятую аналитическую группу входят катионы Mg 2+ , Мn 2+ , Sb 3+ , Sb 5+ , Bi 3+ , Fe 2+ , Fe 3+ . Групповой реагент – водный раствор NaOH (обычно 2 моль/л) или 25%-ый водный раствор аммиака. Под действием группового реагента катионы осаждаются в виде соответствующих гидроксидов, которые не растворяются в избытке группового реагента. На воздухе гидроксиды Mn(OH)2 и Fe(ОН)2 постепенно окисляются кислородом до МnО(ОH)2 и Fe(ОН)3.
К шестой аналитической группе относятся катионы Сu 2+ , Cd 2+ , Hg 2+ , Co 2+ , Ni 2+ . Групповой реагент – 25%-ый водный раствор аммиака. При действии группового реагента на водные растворы, содержащие хлориды катионов данной группы, сначала выделяются осадки различного состава: CuOHCl, CoOHCl, NiOHCI, Cd(OH)2, HgNH2CI. Осадки растворяются в избытке группового реагента с образованием соответствующих аммиачных комплексов. Осадки, выпавшие из растворов солей Со 2+ и Hg 2+ , растворяются в избытке аммиака только в присутствии солей аммония. Аммиачный комплекс кобальта (II) грязно-желтого цвета окисляется па воздухе до аммиачного комплекса кобальта (III) вишнево-красного цвета.
2.2. Систематический анализ катионов по кислотно-основному методу.
Сначала будут рассмотрены схемы анализа смесей катионов каждой аналитической группы, а затем – ход анализа смеси катионов всех аналитических групп.
2.2.1. Анализ смеси катионов первой аналитической группы: Li + , Na + , К + , NН + .
Катионы первой аналитической группы не имеют группового реагента. Катионы Li + и NH4 + мешают открытию катионов Na + и К + , поэтому из анализируемого раствора их нужно удалять. Вначале в отдельных пробах анализируемого раствора открывают катионы Li + и NН4 + , после чего эти ноны удаляют, а в остатке открывают К + , Nа + .
I. Предварительные испытания (проводят в отдельной порции анализируемого раствора).
1. Открытие катионов Li + :
а) раствор + Na2РО4 → белый Li3PO4 ↓ (рН=7-8);
б) раствор + NH4F → LiF ↓ (белый)
2.2.4. Анализ смеси катионов четвертой аналитической группы:
Zn 2+ , Аl 3+ , Sn 2+ , Sn 4+ , As 3+ , Cr 3+ , As 5+ .
При анализе раствора, содержащего катионы четвертой аналитической группы, сначала целесообразно провести предварительные испытания, а затем систематический анализ.
I. Предварительные испытания.
1. Открытие Сr 3+ (если они присутствуют, раствор должен быть сине-зеленым):
[Cr(H2О)6] 3+ (зеленый)+ Н2О2(3%) + NaOH изб. → СrО4 2- (желтый)
2. Открытие Sn 2+ :
Sn 2+ + NaOH + Bi(NO3)3 (1-2 капли) → Вi ↓ +[Sn(OH)6] 2-
3. Открытие As 3+ (AsO3 3- в растворе):
AsO3 3- + AgNO3 → Ag3AsO3↓ желтый, аморфный
4. Открытие As 5+ (AsO4 3- в растворе):
AsO4 3- + AgNO3 = Ag3AsO4 аморфный осадок шоколадного цвета
II. Систематический анализ (см. схему 4).
2.2.5. Анализ смеси катионов пятой аналитической группы:
Mg 2+ , Mn 2+ , Sb 3+ , Sb 5+ , Fe 2+ , Fe 3+ , Bi 3+
Некоторые катионы данной аналитической группы удобнее открыть в предварительных испытаниях. Систематический анализ смеси катионов проводят по схеме 5.
1. Предварительные испытания.
1. Открытие ионов Fe 2+ :
4Fe 2+ +3 K3[Fe(CN)6] → Fe4[Fe(CN)6]3 +9K + – темно-синий осадок «турнбуленовой сипи»
2. Открытие ионов Fe 3+ (если ионы присутствуют в растворе, последний имеет желтоватую окраску):
а) 4Fe 3+ + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3 +12K + – темно-синий осадок «берлинской лазури»
б)Fe 3+ + 6SCN – → [Fe(SCN)6] 3- – красное окрашивание раствора
3. Открытие ионов Мn 2+ :
а) Mn 2+ + NaBiO3 +Н + → МnO4 – + Bi 3+ + Na +
б) Мn 2+ + РbO2 + H + → МnО4 – + Рb 2+
МnO4 – – ноны окрашивают раствор в малиновый цвет.
4. Открытие ионов Bi 3+ (реакцию проводят о щелочной среде, рH=10):
Bi(OH)3 +[Sn(OH)4] 2- → Bi↓ + [Sn(OH)6] 2- черный
2.6. Анализ смеси катионов шестой аналитической группы: Сu 2+ , Сd 2+ , Hg 2+ , Cо 2+ , Ni 2+ .
Перед проведением систематического анализа в отдельных пробах анализируемого раствора можно открыть некоторые катионы с помощью характерных для них реакций.
Некоторые выводы можно сделать по окраске анализируемого раствора: так, аквакатионы Ni 2+ придают раствору зеленоватую окраску, Со 2+ – розовую, Сu 2+ – голубую.
Отдельную порцию раствора можно обработать водным раствором аммиака и проанализировать окраску раствора, зная, что водные растворы аммиачных комплексов металлов окрашены следующим образом:
[Cu(NH3)4] 2+ – синий;
[Co(NH3)6] 2+ – сине-фиолетовый;
[Co(NH3)4] 2+ – желтый;
[Cd(NH3)4] 2+ , [Hg(NH3)4] 2+ – бесцветные.
Систематический анализ проводят в соответствии со схемой 6.
2.2.7. Анализ смеси наиболее распространенных катионов всех шести аналитических групп:
Na + , К + , NH4 + , Ag + , Pb 2+ , Ca 2+ , Sr 2+ , Ba 2+ , Zn 2+ , Al 3+ , Sn 2+ , Cr 3+ , Mg 2+ , Bi 3+ , Mn 2+ , Fе 3+ ,
Fе 3+ , Cu 2+ , Cd 2+ , Co 2+ , Ni 2+ .
Примерная схема анализа такого раствора заключается в следущем.
Анализируемый раствор может быть окрашенным или бесцветным. По окраске раствора высказывают предположение о присутствии или отсутствии катионов, имеющих характерную окраску. Например, если раствор прозрачный и бесцветный, можно предположить, что он не содержит катионы Сr 3+ , Fe 3+ , Сu 2+ , Со 2+ , Ni 2+ .
Некоторые предположения можно сделать и на основании измерения рН pacтвора (например, с помощью универсальной индикаторной бумаги). Если значение pН раствора находится в пределах рН = 2 – 4 и раствор не содержит осадка, то о нем отсутствуют Sn(II), Sn(IV), Sb(III), Sb(V), Bi(III), Hg(II), Fe (III), т.к. в противном случае продукты их гидролиза выделились бы в форме осадков.
Анализируемый раствор обычно делят на 3 части. Одну часть используют для предварительных испытании, другую – для проведения систематического анализа, третью оставляют для контроля.
I. Предварительные испытания.
В отдельных небольших порциях анализируемого раствора (объемом примерно 0,3 – 0,5 мл) определяют наличие катионов II – VI аналитических групп действием групповых реагентов.
1. Открытие катионов II аналитической группы (Ag + , Pb 2+ ): анализируемый раствор + HCl → образование осадка белого цвета.
2. Открытие катионов III аналитической группы (Са 2+ , Sr 2+ , Ba 2+ , Pb 2+ ) (свинец (II) относится ко II аналитической группе, но дает осадок PbSO4): анализируемый раствор + H2SO4 → образование осадка белого цвета.
3. Открытие катионов IV, V, VI аналитических групп: анализируемый раствор + NaOH + Н2О2, t°→ образование осадка.
Если при добавлении избытка NaOH осадок полностью растворяется, значит, анализируемый раствор содержит катионы IV аналитической группы (Zn 2+ , Al 3+ , Sn 2+ , Cr 3+ ) и не содержит катионы V и VI аналитических групп. Также в предварительных испытаниях в отдельных порциях раствора открывают некоторые индивидуальные катионы.
4. Открытие катионов NH4 + :
a). NH4 + + КОH → NH3↑ – запах, влажная лакмусовая бумажка синеет.
б) NH4 + + K2[HgJ4], КОН (реактив Несслера) — [(JHg)2NH2]J ↓ – красно-бурый осадок.
6. Открытие ионов Na (если NH4 + удалены):
Na + + K[Sb(OH)6] → ↓ Na[Sb(OH)6] – белый мелкокристаллический
7. Открытие ионов Fe 2+ :
Fe 2+ + K3[Fe(CN)6] → темно-синий осадок «турнбулеповой сини».
8. Открытие ионов Fe 3+ :
Fe 3+ + K4[Fe(CN)6] → темно-синий осадок «берлинской лазури».
9. Открытие ионов Мn 2+ :
Мn 2+ + NaBiO3 → MnO4 – – раствор малиновый.
10. Открытие ионов Сr 3+ :
а) Сr 3+ + H2O2 + NaOH изб. → СrO4 2- синий или зеленый раствор
б) Сr 3+ + КМnO4 + H2SO4 → СrO4 2- + Мn 2+ – желтый раствор
11. Открытие ионов Bi 3+ :
а) Bi 3+ + Sn 2+ → Bi ↓ + Sn 4+ – черный
б) Bi 3+ + Сl – + Н2О → BiOCl ↓, осадок растворяется в избытке HCl – белые хлопья
12. Открытие ионов Сu 2+ :
Сu 2+ + NH3*H2O → ярко-синий раствор (мешает Ni 2+ ).
13. Открытие ионов Ni 2+ :
Ni 2+ + диметилглиоксим → красное окрашивание (мешает Cu 2+ ).
14. Открытие ионов Со 2+ :
Со 2+ + реактив Ильинского (α-нитрозо-β-нафтол) → пурпурно-красный осадок (мешают Fe 3+ , Сu 2+ ).
II. Систематический анализ.
Определив наличие катионов различных групп, приступают к их разделению помощью групповых реагентов. Ход выполнения систематического анализа описан в схеме 7.
2.2.8. Анализ раствора с осадком.
Если анализируемый объект представляет собой раствор с осадком, то вначале эту смесь центрифугируют, отделяют осадок от раствора и обе фазы анализируют отдельно.
Наличие осадка свидетельствует о присутствии в нем малорастворимых в воле соединений, например, хлоридов катионов второй аналитической группы (AgCl, РbСl), сульфатов катионов II и III аналитической группы (CaSO4, SrSO4, SrSO4. BaSO4, PbSO4, Ag2SO4), продуктов гидролиза катионов других групп и т.д.
Осадок испытывают на растворимость в разбавленном растворе уксусной кислоты (растворятся фосфаты двухзарядных катионов: Mg 2+ , Са 2+ , Сr 2+ , Ва 2+ , Мn 2+ ); в разбавленном растворе хлороводородной кислоты (растворятся фосфаты трехзарядных катионов Fe 3+ , Сr 3+ , Bi 3+ , Al 3+ и карбонаты всех катионов); в разбавленной и более концентрированной (1:1) азотной кислоте (растворятся BiOCl, РbС12), в водном растворе винной кислоты (растворится SbOCl), в водном 30%-м растворе ацетата аммония (растворится PbSO4).
III. Качественный анализ анионов. Аналитическая классификация анионов но группам.
Обычно открытие анионов в фармацевтическом анализе осуществляют с использованием разных качественных аналитических реакций в растворах на тот или иной аннон. Разумеется, не исключается применение и других методов анализа (оптических, хроматографических, электрохимических и др.).
Аналитическая классификация анионов по группам, в отличие от аналитической классификации катионов, разработана не столь подробно. Не существует общепризнанной и повсеместно принятой классификации анионов по аналитическим группам. Описаны различные классификации анионов.
Чаще всего принимают во внимание растворимость солей бария и серебра тех или иных анионов и их окислительно-восстановительные свойства в водных растворах. В любом случае удастся логически разделить на группы только часть известных анионов, так что всякая классификация анионов ограничена и не охватывает все анионы, представляющие аналитический интерес.
В табл. 3.1 и 3.2. приведены примеры классификации анионов по аналитическим группам.
По аналитической классификации анионов, основанной на образовании малорастворимых солей бария и серебра, анионы обычно делят на три группы (табл.3.1).
Таблица 3.1. Классификация анионов, основанная на образовании малорастворимых солей бария и серебра.
Группа
Анионы
Групповой реагент
I
Раствор ВаС12 в нейтральной или слабо-щелочной среде
II 1
Сl – , Br – , J – , BrO3 – , CN – , NCS – , S 2- , С6Н5СОО –
Раствор AgNO3 в разб. (2М) азотной кислоте
III
1 – Бромат-ион иногда относится к III группе, так как бромат серебра AgBrO3 растворяется в разбавленной HNО3.
Осадок Ag2S растворяется при нагревании в растворе HNO3.
Если осадок нерастворим во всех вышеперечисленных растворителях, то это указывает на возможное присутствие в нем соединений: AgCl, PbCl2, CaSO4, SrSО4, BaSO4. Осадок РbСl2 растворяют, обрабатывая его кипящей дистиллированной водой, a AgCl – концентрированным раствором аммиака. Сульфаты катионов третьей аналитической группы переводят в карбонаты обработкой раствором соды и растворяют в уксусной кислоте.
Полученный раствор присоединяют к центрифугату и анализируют далее вместе как описано выше (см. п. 2.2.7).
При аналитической классификации анионов, основанной на их окислительно-восстановительных свойствах, анионы обычно делят на три группы (табл. 3.2.): анионы-окислители, анионы-восстановители и индифферентные анионы, т.е. такие, которые не обладают выраженными окислительно-восстановительными свойствами в обычных условиях.
Таблица 3.2. Классификация анионов, основанная на их окислительно-восстановительных свойствах.
Группа
Анионы
Групповой реагент
I
Окислители
Раствор KI в сернокислой среде
II
Восстановители
Раствор J2 в KI
S 2- , SO3 2- , S2O 2- , AsO3 3- , 2 NO2 – , 3 C2O4 2- , 4 CI 3 – , Br – , J – , CN – , SCN –
Раствор КМnО4 в сернокислой среде
III
Индифферентные
1 – NO3 – – ион в слабокислой среде практически не реагирует с KI.
2 – NО2 – – ион относят к I или II группе.
3 – С2O4 – заметно обесцвечивает раствор КМnO4 только при нагревании.
4 – Cl – – ион в обычных условиях медленно реагирует с раствором КМnO4.
3.1. Анализ смеси анионов.
В фармацевтическом анализе систематический анализ смеси анионов с использованием любой классификации никогда не проводится, как и в подавляющем большинстве других случаев аналитической практики. Групповой регент можно использовать для доказательства присутствия или отсутствия в смеси (в растворе) анионов той или иной аналитической группы, после чего намечают и реализуют наиболее целесообразную схему анализа данного конкретного объекта. Лекарственные субстанции и лекарственные формы обычно содержат ограниченное число анионов, причем, как правило, бывает известно, какие анионы могут присутствовать в анализируемом препарате. Поэтому при анализе лекарственных препаратов входящие в их состав анионы открывают дробным методом с помощью тех или иных частных аналитических реакций на соответствующий анион.
Общая логическая схема анализа смеси анионов обычно состоит в следующем. Вначале на первом этапе проводят предварительные испытания, в ходе которых определяют рН раствора, устанавливают с помощью групповых реагентов присутствие или отсутствие анионов первой и второй аналитических групп, выясняют наличие анионов-окислителей, анионов-восстановителей, проводят пробу па выделение газов.
Затем на втором этапе дробным методом открывают отдельные анноны в небольших пробах анализируемого раствора.
Если растворы содержат, наряду с ионами водорода H3O + , только катионы натрия и калия, (остальные катионы отсутствуют), то их непосредственно анализируют на присутствие анионов. Если же в растворах присутствуют катионы II-VI аналитических групп, то их обычно предварительно отделяют, так как они могут помешать открытию некоторых анионов. Удаление катионов II-VI аналитических групп можно осуществить либо обработкой раствором соды (Na2CO3) или поташа (К2СО3), переводя эти катионы (а также катион лития Li + ) в малорастворимые карбонаты, либо методом ионообменной хроматографии.
3.1.1. Первод катионов II – VI аналитических групп о малорастворимые карбонаты.
2СН3СООН + Na2CO3 → 2CH3COONa + H2O + CO2↑.Предварительно в отдельных порциях анализируемого раствора открывают карбонат ион и ацетат – ион (как описано ниже).
Затем к пробе анализируемого раствора (
30 капель) осторожно, по каплям прибавляют разбавленный раствор соды для нейтрализации раствора до слабощелочной реакции, после чего добавляют еще
30 капель раствора соды. Смесь нагревают до кипения и кипятят около 5 минут, периодически добавляя по каплям дистиллированную воду по мере упаривания раствора, поддерживая объем жидкой фазы приблизительно постоянным. Полученную смесь центрифугируют, центрифугат отделяют от осадка (который сохраняют для дальнейшего анализа – в случае необходимости).
К центрифугату осторожно, при перемешивании, по каплям прибавляют разбавленную уксусную кислоту до рН
7 для удаления избытка карбонат – ионов. Полученный раствор анализируют далее на присутствие анионов.
3.1.2. Предварительные испытания (проводятся в отдельной порции раствора).
1. Определение рН анализируемого раствора.
Если рН 2- , S2O3 2- , CO3 2- , S 2- , NO2 – . При рН – и NO2 – , SO3 2- и МnО4 – и так далее, т.к. они взаимодействуют между собой. В щелочной среде могут присутствовать все рассматриваемые анионы.
2. Проба на присутствие анионов неустойчивых кислот.
Если при подкислении анализируемого раствора до рН 2- , S2O3 2- , CO3 2- , S 2- , NO2 – . Желто-бурый цвет газа указывает на присутствие нитрит-ионов. Помутнение раствора при его подкислении свидетельствует о наличии в нем S2O3 2- ионов, разлагающихся с выделением элементарной серы.
3. Проба па присутствие анионов первой аналитической группы (табл.3.1).
Если анионы первой аналитической группы имеются в растворе, то при добавлении к нему раствора ВаСl2 при рН=7-9 выпадает белый осадок. Все малорастворимые соли бария, кроме сульфата бария BaSO4, растворяются при подкислении раствора, поэтому если полученный осадок полностью растворяется при прибавлении раствора НСl, то в растворе отсутствуют ионы SO4 2- .
4. Проба на присутствие анионов второй аналитической группы (табл. 3.1).
Если в анализируемом растворе присутствуют анионы второй аналитической группы, то при добавлении к нему азотнокислого раствора AgNO3 образуется осадок. Если осадок не выпадает, то это означает, что анионы второй аналитической группы в анализируемом растворе отсутствуют (возможно, присутствие ионов BrO3 – ).
5. Проба на присутствие анионов-окислителей.
Наличие анионов-окислителей (NO2 – , NO – , ВrО3 – ) устанавливают реакцией с KJ и сернокислой среде (рН
1) в присутствии раствора крахмала. Окислители переводят ионы J в йод J2, при образовании которого крахмальный раствор окрашивается в синий цвет.
6. Проба на присутствие анионов-восстановителей.
Наличие анионов-восстановителей устанавливают реакцией с йодом (раствор йода обесцвечивается, поскольку йод в нейтральной или слабокислой среде окисляет анионы-восстановители S 2- , SO3 2- , S2O3 2- , С2O4 2- , Br – , J – , SCN – , NO2 – ).
3.1.3. Дробное обнаружение анионов.
После проведения предварительных испытаний, отдельные анноны открывают дробным методом, учитывая их возможное мешающее влияние друг на друга.
Рассматриваемые анионы вступают в многочисленные реакции с различными реагентами. Многие из этих реакций представляют аналитический интерес. Ниже охарактеризованы только некоторые из этих реакций, рекомендуемые чаще других.
1. Открытие сульфат-нона.
SО4 2- – ион обнаруживают по реакции с катионами бария Ва 2+ :
SО4 2- + Ва 2+ → BaSО4 ↓
Образуется белый мелкокристаллический осадок, не растворяющийся в минеральных кислотах.
2. Открытие сульфид-поиа.
S 2- – ион обнаруживают при подкислении раствора разбавленной НCI:
S 2- + 2HCI → Н2S ↑ + 2CI – , фильтровальная бумага, смоченная раствором (СН3СОО)2Pb, чернеет:
Н2S + (СН3СОО)2Рb → PbS + 2СН3COOН.
3. Открытие сульфит – нона.
Если в растворе присутствуют анионы S 2- , S2O3 2- , сульфит-ионы сначала переводят и осадок в виде SrSO3, затем осадок отделяют, растворяют в кислоте и проводят качественную реакцию.
а). В отсутствии ионов S 2- , S2O3 2- , сульфит-ионы обнаруживают по реакции:
SО3 2- + J2 +H2О → SО4 2- + 2J – + 2H + , pH = 5-7. Желтый раствор йода обесцвечивается.
б). Реакция разложения сульфитов кислотами:’
SO3 2- + 2H + → SO2 ↑ + H2O.
Выделяющийся диоксид серы обнаруживают по обесцвечиванию водного раствора йода или перманганата калия (реакцию проводят в приборе для обнаружения газов).
4. Открытие тиосульфат — иона.
Ионы S2O3 2- открывают по помутнению пробы раствора при подкислении серной или хлороводородной кислотой.
S2О3 2- + 2H + ↔ H2S2О3 → S ↓ + SО2 + Н2О.
Примечание: тиосульфаты щелочных металлов, стронция, цинка, кадмия, марганца (II), железа (II), кобальта (II), никеля (II) растворимы в воде; тиосульфаты других металлов малорастворимы в воде.
5. Открытие карбонат-иона.
Если в растворе отсутствуют ионы SO3 2- , S2O3 2- , то карбонат-ион обнаруживают при подкислении раствора по выделению газообразного СО2, который вызывает помутнение известковой воды: СО3 2- + 2Н + → СО2 ↑ + Н2О.
Если же ионы SO3 2- , S2O3 2- присутствуют, то их необходимо предварительно окислить до SО4 2- и S4О6 2- соответственно раствором КМnO4 пли К2Сr2O7. В полученном растворе открывают СO3 2- – ионы.
6. Открытие оксалат – иона.
При отсутствии и растворе карбонат-ионов и анионов-восстановителей, C2O4 2- иона открывают по реакции:
↓Agl +Na2S3О3 → Na[Ag(S2О3)] • Nal. желтый
7. Открытие нитрит – иона.
NO2 – – ион открывают по реакции с реактивом Грисса-Илошвая (смесь сульфаниловой кислоты HSO3C6H4NН2 с 1 – нафтиламином C10Н7NH2):
NO2 – + реактив Грисса → ярко-красное окрашивание.
NO3 – – ион не дает аналогичной реакции.
Если нитрит – ион открыт, то его обычно удаляют, поскольку он мешает открытию нитрат – иона NO3 – :
NО2 – + NH4CI → N2 + 2Н2О
Раствор используют для открытия нитрат – ионов.
8. Открытие нитрат – иона.
NO3 – + 1-дифениламин → синее окрашивание раствора; постепенно окраска изменяется на бурую, а затем на желтую.
9. Открытие ацетат – иона.
а). Ацетат – ион в сернокислой среде (H2SO4 конц.) реагирует со спирт образованием сложных эфиров уксусной кислоты:
СН3СООН + С2Н5ОН → СН3СООС2Н5 + Н2О.
Этилацетат СН3СООС2Н5 обладает характерным приятным запахом.
Реакцию катализируют соли серебра.
б). При растирании твердых проб, содержащих ацетаты, с твердыми NaНSО4, KHSO4 выделяется уксусная кислота, обнаруживаемая по характерному запаху укуса
10. Открытие тартрат-иона – ООС – СН(ОН) – СН(ОН) – СОО –
Тартрат-анион – аннон слабой двухосновной винной кислоты, хорошо растворим в воде. В растворе ионы обнаруживают по реакции с хлоридом калия о присутствии ионов:
С4Н4О6 2- + К + + Н + → ↓ KHC4H4O6. Образуется белый кристаллический осадок, растворимый в минеральных кислотах и щелочах
11. Открытие цитрат-иона – ООССН2 – С(ОН)(СОО – ) – СН2СОО – .
Цитрат-ион – анион слабой трех основной лимонной кислоты, хорошо pacтворяется в воде. Открывают ноны по реакции взаимодействия с катионами кальция в нейтральной среде:
5С2О4 2- + 2MnO4 – + 16H + → 10CO2↑ + 2Mn 2+ + 8H2O.
Раствор KMnO4 обесцвечивается, выделение CO2 фиксируется по помутнению известковой воды за счет образования СаСО3 ↓.
Если исследуемый раствор содержит мешающие ноны, оксалат-ион отделяют в виде осадка оксалата кальция СаС2О4, действуя избытком раствора СаС12 в уксуснокислой среде при нагревании. Полученный осадок обрабатывают разбавленной серной кислотой при нагревании, при этом С2О4 2- – ионы переходят в раствор, где их можно открыть:
↓ СаС2О4 + H2SО4 → CaSО4 + С2SО4 2- ↓ + 2Н + .
12. Открытие ортофосфат – иона.
РO4 3- – ионы можно обнаружить двумя способами:
а) Реакция с магнезиальной смесью (MgCl2 + NH3 + NH4Cl):
HPO4 2- + MgCI2 + NH3 + NH4MgPO4 ↓
Образуется белый мелкокристаллический осадок магнийаммонийфосфат растворяющийся в кислотах.
б) Реакция с молибдатом аммония (NH4) 2MoО4:
PO4 3- + 3NH4 + + 12MoO4 2- +24H + →↓(NH4) 3[PO4(Mo5O10) 12 + 12 H2O
Образуется желтый кристаллический осадок комплексной аммонийной фосфоромолибдеповой гетерополикислоты — фосфоромолибдат аммония.
Мешают анионы-восстановители, восстанавливающие продукт реакции молибденовой сини.
13. Открытие Сl – иона.
Хлорид-ионы осаждают в виде белого осадка хлорида серебра, который, в отличие от AgBr и AgJ, растворяется в насыщенном водном растворе (NH4) 2CО3:
Ag + + Cl – → AgCl,
AgCl + (NH4) 2CO3 → [Ag(NH3) 2]CI + CO2 + H2O.
Раствор отделяют от осадка и доказывают присутствие в нем хлорид-ионов:
[Ag(NH3) 2]CI + 2HNO3 (конц.)→ AgCI ↓ + 2NH4NO3
Открытию Сl – иона мешают SCN – ионы, поэтому их необходимо предварительно удалить.
14. Открытие бромид- и иодид-ионов.
Обычно в присутствии Сl – ионов, бромид – и иодид-ионы открывают одновременно, учитывая, что осадок AgCI растворяется в насыщенном растворе (NH4)2CО3, осадок AgBr в концентрированном водном аммиаке, a AgJ – в растворе тиосульфата натрия:
↓ AgBr + 2NH3 → [Ag(NH3)2]Br,
2 Сit 3- + 3СаС12 → Ca2Cit2 + 6Cl – .
При кипячении раствора из него выпадает белый осадок, растворяющийся при охлаждении смеси, а также в разбавленной соляной кислоте. Мешают С2О4 2-
15. Открытие бензоат-иона С6Н5СОО –
Бензоат-ион – анион слабой одноосновной бензойной кислоты, малорастворимой в воде.
При подкислении растворов, содержащих бензоаты, минеральными кислотам образуется белый осадок бензойной кислоты:
С6Р5СОО – + Н + → ↓C6Н5COOН.
Аналогичный эффект дают салицилат-ионы.
16. Открытие салицилат-иона НО – С6Н4 – СОО – .
Салицилат-ион — анион слабой одноосновной салициловой кислоты, очень плохо растворимой в воде.
Обнаружить его можно в нейтральной среде по реакции:
3 НОС6Н4СОО – + Fе 3+ → [Fe(HOC6H4COO) 3].
Образуется соединение сине-фиолетового или красно-фиолетового цвета, при подкислении раствора минеральными кислотами окраска раствора обесцвечивается.
В аналогичной реакции с бензоат-ионами образуется розово-желтый осадок, растворимый в кислотах.
3.1.4. Систематический анализ смеси анионов.
Не существует такая схема систематического анализа смеси анионов в растворе, которая была бы общепринятой, в отличие от систематического анализа смеси катионов.
Ниже предложен один из вариантов анализа смеси анионов. Последовательность операций в общем случае заключается в следующем. Вначале проводятся предварительные испытания, затем дробно в отдельных порциях раствора открывают некоторые анноны, после чего осуществляют разделение анионов с помощью групповых реагентов с последующим открытием анионов в разделенных осадках и растворах.
Пусть анализируемый раствор содержит наиболее распространенные анионы трех аналитических групп.
SО 2- , SO3 2- , РО4 3- , СО3 2- , NO3 – , NО2 – , CH3СOO – , Сl – , Br – , J – , S2O3 2- , S 2- .
В отдельных порциях раствора проводят предварительные испытания и дробно открывают анионы NO3 – , NO2 – , CH3COO – (обязательно!) и некоторые другие. Затем проводят систематический анализ; один возможных способов описан в схеме 8.
Источник