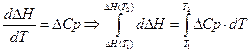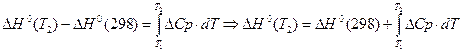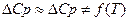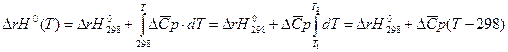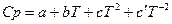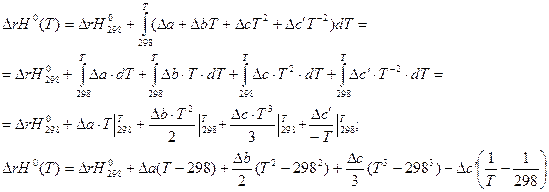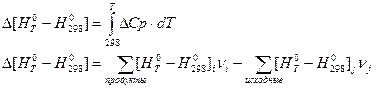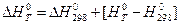- ЗАКОН ГЕССА И СЛЕДСТВИЯ ИЗ НЕГО. МЕТОДЫ РАСЧЕТА ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
- Методы расчета тепловых эффектов химических реакций при различных температурах
- Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции.
- Расчеты теплового эффекта реакции
- Решение:
- Расчёты по термохимическим уравнениям
- Пример 1
- Решение
- Пример 2
- Решение
ЗАКОН ГЕССА И СЛЕДСТВИЯ ИЗ НЕГО. МЕТОДЫ РАСЧЕТА ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
Термохимияпредставляет собой раздел химической термодинамики, в котором рассматривается применение первого закона термодинамики для вычисления тепловых эффектов различных физико-химических процессов: химических реакций, фазовых переходов, растворения.
Любая химическая реакция сопровождается поглощением или выделением теплоты – тепловым эффектом. Термохимическими называют такие уравнения химических реакций, в которых наряду с формулами веществ, участвующих в реакции, указывается тепловой эффект реакции.
Тепловой эффект реакции – теплота, которая выделяется или поглощается в результате химической реакции при соблюдении следующих условий:
1) отсутствие полезной работы;
2) неизменность давления или объема системы;
3) постоянство температуры до и после реакции.
То есть реакция должна протекать в изобарно-изотермических или изохорно-изотермических условиях.
Определить тепловой эффект реакции можно по закону Гесса, который формулируется следующим образом:
Если из одних и тех же веществ получать продукты реакции различными путями, то суммарный тепловой эффект не зависит от пути процесса, а определяется начальным и конечным состоянием системы при постоянстве давления или объема, т. е. энтальпия – функция состояния. В общем виде закон Гесса можно представить при помощи схемы (Рис.1.1.1).
 |
Рис. 1. 1.1.Изменение теплового эффекта процесса в соответствии с законом Гесса (точки 1 и 2 обозначают исходное и конечное состояние системы, тепловой эффект этой реакции будет ∆Н).
Если реакция происходит при постоянном объеме, тепловой эффект отождествляется с изменением внутренней энергии:
Закон Гесса используется для различных термохимических процессов. Он позволяет вычислить тепловые эффекты при отсутствии экспериментальных данных.
За стандартное состояние вещества принимают стабильное состояние вещества при Р = 1 атм, Т = 298,16 К.
Определение тепловых эффектов по теплоте образования. Для определения теплового эффекта в термохимических уравнениях пользуются следствиями из закона Гесса.
Первое следствие: тепловой эффект химической реакции равен разности теплот образования продуктов реакции и теплот образования исходных веществ, взятых с учетом стехиометрических коэффициентов.
Тепловой эффект химической реакции будет иметь вид:

где– 
Стандартная теплота образования (энтальпия образования) в расчете на один моль вещества обозначается через 
В большинстве случаев теплоту образования определяют в изобарных условиях и вместо понятия «теплота образования» используют термин энтальпия образования – теплота, необходимая для образования соединения из простых веществ. Теплота образования простых веществ принята равной нулю.
Стандартная теплота образования зависит от агрегатного состояния и аллотропной модификации веществ.
Итак, для расчетов тепловых эффектов реакций необходимо знать теплоты образования исходных веществ и продуктов реакции. Как же получают данные о теплотах образования? Таких путей два – экспериментальный и расчетный.
Экспериментальные значения теплоты образования определяют в калориметре.
Приведем пример расчетного способа определения теплоты образования и теплового эффекта химической реакции на примере глюкозы С6Н12О6, теплоту образования которой 
используя следующие данные:
1. 6С(графит) + 6О2(г) = 6СО2(г); 

2. 6Н2(г) + 3О2(г) = 6Н2О(ж); = 

3. С6Н12О6(тв.) + 6О2(г) = 6СО2(г) + 6Н2О(ж); = 

Теплота образования глюкозы составит:




+(– 1713,9) – (– 2800,6) = –1270,8 кДж/моль
Определение тепловых эффектов по теплоте сгорания.Теплоту сгорания при стандартных условиях в расчете на 1 моль (стандартную мольную энтальпию сгорания) обозначают через ∆Нсг или ∆Нс (от английского слова conbustion – сгорание).
Теплотой сгорания называется тепловой эффект реакции окисления данного соединения кислородом до образования высших оксидов элементов или соединений этих элементов.
Тепловой эффект реакции можно определить по теплоте сгорания веществ, участвующих в реакции.
Для этой цели пользуются вторым следствиемиз закона Гесса, которое формулируется так: тепловой эффект химической реакции равен разности теплоты сгорания исходных веществ и теплоты сгорания продуктов реакции с учетом стехиометрических коэффициентов:
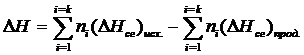
Значения теплот сгорания используют для определения тепловых эффектов реакций, главным образом органических веществ.
Теплоту сгорания, так же как и теплоту образования, измеряют при помощи калориметра.
Третье следствиеиз закона Гесса позволяет рассчитывать тепловые эффекты и гласит: энтальпия химической реакции равна разности энергий разрываемых и образующихся химических связей:

где Qвозг – теплота возгонки.
В этом методе расчета сначала предполагают разложение исходных простых веществ на атомы, а затем образование из них конечного газообразного соединения. Первый этап связан с затратой энергии на разрыв связей в исходных простых веществах, а второй – с выделением энергии образования новых связей.
Энергией связи называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечное расстояние.
При расчете тепловых эффектов химических реакций, протекающих в водных растворах, следует учитывать диссоциацию химических соединений. Для тех химических соединений, которые диссоциирует в растворе, в расчетах нужно брать стандартные теплоты образования соответствующих ионов, а для тех, которые не диссоциируют, — стандартные теплоты образования соединений. Стандартная теплота образования иона в водном растворе – это тепловой эффект образования гидратированного иона из простых веществ.
Ион гидроксония H 3 O + обычно в термохимических уравнениях пишут в виде H+aq. Теплота образования иона H+aq условно принята равной нулю.
Контрольные вопросы
1. Что изучает термохимия? Назовите русских ученых и укажите их вклад в развитие термохимии.
2. Определите понятие «тепловой эффект химической реакции».
3. Приведите термодинамическую и термохимическую формы записи уравнений химической реакции термического разложения карбоната кальция, если при ее протекании при 298 К поглощается 177,4 кДж/моль тепла.
4. Сформулируйте закон Гесса. Укажите его научное и практическое значение. Докажите, что закон Гесса – частный случай первого закона термодинамики. Докажите, при каких условиях этот закон не противоречит первому закону термодинамики.
5. Есть ли противоречие между первым законом термодинамики, утверждающим, что теплота является функцией процесса, и законом Гесса, утверждающим, что теплота от пути процесса не зависит?
6. Объясните, почему в химических реакциях поглощается (выделяется) теплота. Выведите соотношение, связывающее Qp и QV для:
1) идеальных газов;
2) реальных газов;
3) жидких и твердых тел. Может ли Qp равняться QV?
7. Что называется теплотой образования химического соединения?
8. Как рассчитываются тепловые эффекты реакции, которые не могут быть найдены опытным путем? Какие данные для этого необходимы?
9. Какими эмпирическими уравнениями зависимости теплоемкости от температуры пользуются при выводе интегрального уравнения Кирхгофа? Какова область (p и T) применения этих эмпирических уравнений?
10. Что представляет собой энергия разрыва связей? Как, используя энергии разрыва связи и теплоту сублимации углерода, рассчитать тепловой эффект химической реакции?
11. Почему метод расчета тепловых эффектов по энергиям разрыва связей является приближенным? Чем объяснить различия в энергиях разрыва одних и тех же связей, определяемых различными авторами?
12. Напишите формулу для расчета теплового эффекта реакции по теплотам образования химических соединений.
13. Что называется теплотой сгорания химического соединения? Приведите примеры.
Дата добавления: 2018-02-15 ; просмотров: 3903 ; Мы поможем в написании вашей работы!
Источник
Методы расчета тепловых эффектов химических реакций при различных температурах
Все методы расчета тепловых эффектов основаны на уравнении Кирхгоффа в интегральной форме.
Чаще всего, в качестве первой температуры используют стандартную 298,15K.
Все методы расчета тепловых эффектов сводятся к способам взятия интеграла правой части уравнения.
Методы взятия интеграла:
I. По средним теплоемкостям. Данный метод является наиболее простым и наименее точным. В этом случае выражение 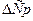
Средние теплоемкости табулированы и измерены для большинства реакций. Их легко рассчитать по справочным данным.
II. По Истинным теплоемкостям. ( С помощью температурных рядов)
В этом методе подынтегральное выражение теплоемкости записывается как температурный ряд:
III. По высокотемпературным составляющим энтальпии. Данный метод получил большое распространение с развитием ракетной техники при расчете тепловых эффектов химических реакций при высоких температурах. Он основан на определении изобарной теплоемкости:
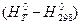
Для химической реакции записываем:
1. II закон термодинамики, определение, математическая запись.
2. Анализ II закона термодинамики
3. Расчет изменения энтропии в некоторых процессах
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции.
Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Расчеты теплового эффекта реакции
Пример типовой задачи на нахождение теплового эффекта реакции:
При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
0,25 моль глюкозы — 700 кДж
1 моль глюкозы — Q
Из этой пропорции следует соответствующее ей уравнение:
Решая которое, находим, что:
Таким образом, тепловой эффект реакции составляет 2800 кДж.
Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
Данной пропорции соответствует уравнение:
4 / 0,667 = 3330 / x
Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
8 моль SO2 — 3310 кДж
x моль SO2 — 1655 кДж
Из которой следует уравнение:
8 / х = 3310 / 1655
Решая которое, находим, что:
Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
Источник