Способы определения молярной массы газов;
Существует ряд методов определения молекулярной массы газов при определенных внешних параметрах: давлении (Р), объеме (V) и температуре (Т).
1. По закону Авогадро и следствиям из него
Закон Авогадро: в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул.
Следствие 1: один моль любого вещества содержит количество структурных единиц данного вещества, равное постоянной Авогадро (Na = 6,02∙10 23 моль -1 ).
Следствие 2: при нормальных условиях (н.у.) (Р = 10 5 Па, Т = 273 К) один моль любого газа занимает объем 22,4 л. Эта величина получила название молярный объем (VM).
Зная массу m (г) какого-либо объема газа при н.у. и его объем V0 (л), можно рассчитать его молекулярную массу.
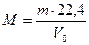 . . | (2.3.1) |
Следствие 3: массы равных объемов двух газов, взятых при одинаковых давлении и температуре, относятся друг к другу, как их молярные массы:
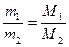 . . | (2.3.2) |
Отношение массы определенного объема первого газа к массе такого же объема второго газа (взятого при тех же условиях) называется относительной плотностью первого газа по второму (D). Тогда:
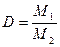 . . | (2.3.3) |
Обычно плотность газа определяют по отношению к водороду (DH2) или воздуху ( 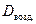
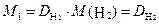 · 2, · 2, | (2.3.4) |
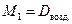 М возд.= М возд.= 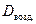 ·29. ·29. | (2.3.5) |
С учётом вышеуказанных условий для расчёта количества вещества используют следующие соотношения:
n 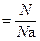 , , | (2.3.6) |
где N – количество структурных единиц в системе;
n 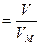 , , | (2.3.7) |
2. По уравнению Клапейрона – Менделеева
Если условия, в которых находится газ, отличны от нормальных, то параметры газа определяют по уравнению Клапейрона – Менделеева:
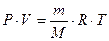 , , | (2.3.8) |
тогда молекулярную массу газа рассчитывают по формуле: 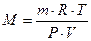 . . | (2.3.9) |
Единицы измерения величин в данном уравнении зависят от того, в каких единицах выражена масса (табл.1.2.1).
Источник
Закон сохранения массы – энергии. Закон Авогадро. Атомные молярные массы. Моль
Закон сохранения массы – энергии. Закон Авогадро. Атомные молярные массы. Моль
З-н сохранения массы— масса в-в, вступающих в реакцию, равна массе в-в, образующихся после р-ии
В изолированных сист. сумма масс и энергии величина постоянная. E=mc*2 – взаимосвязь.
Энергия и масса не исчезают, они просто трансформируются из одного состояния в другое.
Согласно Закону Авогадро, при равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. 1 моль любого газа содержит одинаковое число молекул.Na=6.02х10(23) Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же обьёмV=22.4г/моль
Молярн.масса— масса 1 моль в-ва.Моль — количество в-ва, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12г изотопа углерода 12 С. [Так, относительная молекулярная масса хлора Сl= 70,90. Следовательно, мольная масса молекулярного хлора составляет 70,90 г/моль. Однако мольная масcа атомов хлора вдвое меньше (35,45 г/моль), так как 1 моль молекул хлора С12 содержит 2 моля атомов хлора.]
2.Методы определения молярных масс газообразных веществ. Парциальное давление газа. Закон Дальтона.
Парциальным давлением газа в смеси называетеся давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси.Pпарц=PначVнач/Vсмеси .Закон Дальтонаобщее давление смеси газов, не вступающих друг с другом химическое взаимодействие,равно сумме парциал.давлений газов, составляющих смесь. Чтобы определить молекулярную массу вещества, обычно находят численно равную ей мольную массу вещества в г/моль.||А. Определение молекулярной массы по плотности газа.||Б.Определение молекулярной массы газа по мольному объему.D=m1/m2=M1/M2 ||В. Определение молекулярной массы по уравнению Клапейрона-Менделеева. (уравнение состояния идеального газа) связывает массу (m,кг), теммпературу (Т, К), давление (P, Па) и объем (V, м 3 ) газа с его мольной массой (М,кг/моль): PV=mRT/M
3.Оксиды. Классификация. Свойства, номенклатура. Оксиды-бинарные содинения элементов с кислородом.
оксиды на несолеобр[NO,CO,SiO]. и солеобраз-[основные.Li2O, MgO|кислотныеCO2, B2O3 амфотерные.Al2O3, BeO, ZnO, SnO]
4.Кислоты и основания. Классификац. Св-а. Номенклатур. Основания-хим. Соед., кот в р-ре диссоциируют с образованием гидроксид-инов
Основ трудрастворим.[CrOH3|Mn(OH)2] растворим.[NaOH,KOH]
Кислоты-хим соед, содержащие атомы водорода, способные замещаться атомами металлов.
HCl+NaOH=NaCl+ H2O, 2HCl+BaO=BaCl2+H2O
По мере сниж степ окисл. Измен: оват[ая],новат[ая],новатист[ая], ист[ая]
[HClO +7 4 Хлорная HClO +5 3 хлорноватистая HClO +3 2хлорнистая HClO +1 хлорноватистая]
Соли. Классификация. Свойства. Номенклатура.
Соли-сложные в-ва, котявляются продуктами полного или частичного замещения ионовводородакислоты ионами металла или гидроксид-ионов основания кислотными остатками.
Основ+к-та,средние(полн замещ Н + в к-те на ион металла) [Na2SO4,(NH4)2SO4], основные( неполн замещ ОН — в основании на кислотн остаток) [CuOHCl], кислые ( неполное замещ Н + в кисл на ины металла) [Al(H2PO4)3]
Ат-сульфат.нитрат K2SO4|KNO3высш.степ.окисл. Ит сульфит.нитрит K2SO3|KNO2 нисш.степ.окисл. Ид сульфид K2S соль сероводородной к-ты]
Эквивалент. Закон эквивалентов. Расчет молярных масс эквивалентов простых и сложных в-в.
Эквивалентом в-ва называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.Эквивалентной массой называется масса 1 эквив. в -ва.
Фор-мулы для вычисления эквивалентны-х масс сложных в-в: Моксид-кисл-основ-соли/Число атомов элемента*вал.ентность элемент. |Основность кислоты|Кислотность основания|число атомов металла*валентность. мета._лла М=ММолМасСоед

Закон эк| Массы(обьёмы) реагирующ друг с другом в-в прапорциональны молярным массам эквивал-тов (обьёмам) молярных масс экви-тов.
ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ
Состояние газа характеризуется его температурой, давлением и объемом. Если температура газа равна 0°С, а давление равно нормальному атмосферному (101,325 кПа нлн 760 мм рт. ст.), то условия, при которых находится газ, называют нормальными. Объем, занимаемый газом при этих условиях, принято обозначать через V0, а давление через P0.Согласно закону Бойля-Мариотта, при постоянной температуре давление, производимое данной, массой газа, обратно пропорционально объему газа: Р2/Р1=V1/V2 или PV=const||При постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре P1/T1= P2/T2
Зависимость между объемом газа, давлением и температурой можно выразить общим уравнением, объединяющим законы Бойля — Мариотта и Гей-Люссака:PV/T= P0V0/T0 Здесь Р и V — давление и объем газа при данной температуре T, Р0 и V0 давление и объем газа при нормальных условиях.
Растворы. Молярная концентрация растворенного вещества. Молярная концентрация эквивалентов растворенного вещества. Моляльностъ.
Раствор-одинаковая сис-ма сост-щяя. из нескольких компонентов,кол-во которых может менятся.
Растворы[жидк.тверд,сплавы,растворы].обр. р-ра сложный физико-хим. процесс где растворитель вода.Содержание растворенного вещества в растворе может быть выражено долями или процентами, либо концентрациями: Молярная концентрация (молярность М) (См)-выражатся числоммоль растворенног в-ва в 1 л раствора.
Моляльная концентрация(моляльность) (m)-выражается числом моль раствоенного в-ва в 1 гк растворителя, m=5 моль/кг (Н2О) молярная концентрация эквивалентов в-ва(нормальность)(н.)-выражается числом моль эквивалентов растворенного в-ва в 1л р-ра; например, 0,75 н. раствор или Сн=0,75 моль/л
Массовая и молярная доля растворенного вещества. Плотность раствора, титр раствора вещества.
Массовая доля-процентное отношение массы растворенного вещества к общей массе раствора: например, С = 3,33% (масс.) Молярная доля растворенного в-ва(безразмерная величина) отношение числа моль растворенного в-ва к сумме числа моль рстворенного в-ва и числамоль растворителя. х(хи) =n2/(n1+n2) ,а мольная доля растворителя (N1) равна N1 =n1/(n1+n2) где n1 и n2-соответственно количество вещества растворителя и количество растворенного вещества.
Титр (г/см 3 ) -кол-во в-ва в гр. В 1 мл р-ра T=mВ/Vр-ра.
Скорость хим. реак-й. Средняя и истинная скорость реакций. Зависимость скорости р-ии от концентр. реагир. в-в.
Принцип Ле-Шателье.
При изменении условий протекания реакц-и (тем пературы, давления, концентрации какого-либо из участвующих в реакц-и в-в) скорости прямого я обратного процессов изменяются неодинаково, и хими ческое равновесие нарушается. В результате преимущественного протекания реакц-и в одном из возможны направлений устанавливается состояние нового химического равновесия, отличающееся от исходного. Процес перехода от одного равновесного состояния к новом равновесию называется смещением химического раем весия. Направление этого смещения подчиняемся принципу ЛеШателье:Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в таком направлению, что оказанное воздействие будет ослаблено.Так, повышение темп-ры приводит к смещение равновесия в направлении реакц-и, сопровождающейся поглощением теплоты, те. охлаждением системы; павышение давления вызывает смещение равновесия направлении уменьшения общего числа молей газообразных в-в, те. в направлении, приводящем к по нижению давления; удаление из системы одного из продуктов реакц-и ведет к смещению равновесия в сторону прямой реакц-и; уменьшение концентрации одного иэ исходных в-в приводит к сдвигу равновесия в направлении обратной реакц-и. СОг+СlгóСОС12г T-const/Pув/Vум
Протекание реакц-и в прямом направлении приводит к уменьшению общего числа молей газов, те. к уменьшению давления в системе. согласно принципу Ле Шателье, повышение давления вызывает смещение равновесия в сторону прямой реакц-и.
Константа равновесия Кт хим-кой реакции связана со стандартным изменением энергии Гиббса этой реакции
Δ 0 GT=-2,3RTlgKT при 298 К Δ 0 G298=-5,69RlgK298 Δ 0 GT кДж/моль отриц-й знак Δ 0 GT возможен если lgK>0 K> 1, ”+”если lgK 0 GT равновесие смещено вà(выход продуктов реакции велик)”+”Δ 0 GT равновесие смещено вß (выход продуктов мал). знак AG° указывает на возможность или невозможность протекания реакции только в стандартных условиях, когда все реагирующие в-ва находятся в стандартных состояниях. В общем же случае возможность или невозможность протекания реакции определяется знаком ΔG.
Закон сохранения массы – энергии. Закон Авогадро. Атомные молярные массы. Моль
З-н сохранения массы— масса в-в, вступающих в реакцию, равна массе в-в, образующихся после р-ии
В изолированных сист. сумма масс и энергии величина постоянная. E=mc*2 – взаимосвязь.
Энергия и масса не исчезают, они просто трансформируются из одного состояния в другое.
Согласно Закону Авогадро, при равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. 1 моль любого газа содержит одинаковое число молекул.Na=6.02х10(23) Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же обьёмV=22.4г/моль
Молярн.масса— масса 1 моль в-ва.Моль — количество в-ва, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12г изотопа углерода 12 С. [Так, относительная молекулярная масса хлора Сl= 70,90. Следовательно, мольная масса молекулярного хлора составляет 70,90 г/моль. Однако мольная масcа атомов хлора вдвое меньше (35,45 г/моль), так как 1 моль молекул хлора С12 содержит 2 моля атомов хлора.]
2.Методы определения молярных масс газообразных веществ. Парциальное давление газа. Закон Дальтона.
Парциальным давлением газа в смеси называетеся давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси.Pпарц=PначVнач/Vсмеси .Закон Дальтонаобщее давление смеси газов, не вступающих друг с другом химическое взаимодействие,равно сумме парциал.давлений газов, составляющих смесь. Чтобы определить молекулярную массу вещества, обычно находят численно равную ей мольную массу вещества в г/моль.||А. Определение молекулярной массы по плотности газа.||Б.Определение молекулярной массы газа по мольному объему.D=m1/m2=M1/M2 ||В. Определение молекулярной массы по уравнению Клапейрона-Менделеева. (уравнение состояния идеального газа) связывает массу (m,кг), теммпературу (Т, К), давление (P, Па) и объем (V, м 3 ) газа с его мольной массой (М,кг/моль): PV=mRT/M
3.Оксиды. Классификация. Свойства, номенклатура. Оксиды-бинарные содинения элементов с кислородом.
оксиды на несолеобр[NO,CO,SiO]. и солеобраз-[основные.Li2O, MgO|кислотныеCO2, B2O3 амфотерные.Al2O3, BeO, ZnO, SnO]
4.Кислоты и основания. Классификац. Св-а. Номенклатур. Основания-хим. Соед., кот в р-ре диссоциируют с образованием гидроксид-инов
Основ трудрастворим.[CrOH3|Mn(OH)2] растворим.[NaOH,KOH]
Кислоты-хим соед, содержащие атомы водорода, способные замещаться атомами металлов.
HCl+NaOH=NaCl+ H2O, 2HCl+BaO=BaCl2+H2O
По мере сниж степ окисл. Измен: оват[ая],новат[ая],новатист[ая], ист[ая]
[HClO +7 4 Хлорная HClO +5 3 хлорноватистая HClO +3 2хлорнистая HClO +1 хлорноватистая]

Последнее изменение этой страницы: 2017-03-14; Просмотров: 2228; Нарушение авторского права страницы
Источник




