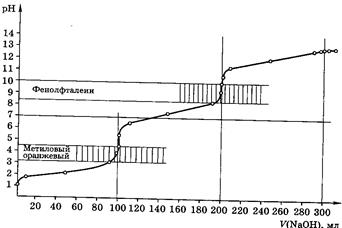
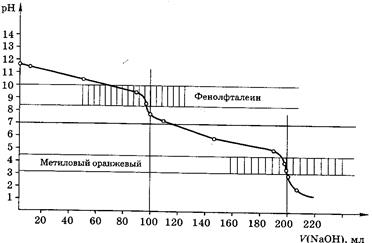
Способы проведения стандартизации приготовленных растворов веществ
Под стандартизацией раствора титранта понимают установление его точной концентрации с относительной погрешностью, не превышающей ± 0,1%.
Различают приготовленные и установленные растворы титрантов. Приготовленные растворы точной концентрации получают растворением точной навески тщательно очищенного исходного вещества в определенном объеме воды или другого растворителя. Так готовят, например, титрованный раствор NaCl .
Однако многие растворы, например титрованный раствор HCl , приготовить этим способом нельзя. В таких случаях готовят раствор титранта, концентрация которого известна лишь приблизительно, а затем его стандартизуют, т.е. устанавливают концентрацию точно. Эти растворы называют установленными. Для стандартизации растворов применяют специальные установочные вещества – первичные стандарты. Эти вещества должны иметь состав, точно отвечающий химической формуле, быть устойчивыми на воздухе и иметь по возможности большую молярную массу эквивалента *. Они должны быть также доступными и легко очищаться от примесей. Реакция титранта с раствором установочного вещества должна отвечать требованиям, которые предъявляются к титриметрическим реакциям, т.е. протекать быстро, количественно и стехиометрически.
Например, растворы NaOH и KOH часто стандартизуют по гидрофталату калия 
Нередко для целей стандартизации используют вторичные стандарты, в качестве которых выступают титрованные растворы веществ, способных взаимодействовать с титрантом.
Как правило, стандартизацию титранта стремятся проводить в тех же условиях, какие будут при выполнении анализа.
Источник
Стандартизация раствора титранта



Под стандартизацией раствора титранта имеют в виду установление его точной концентрации с относительной погрешностью, обычно не превышающей ± 0,1 %. Обязательным условием этой процедуры является высокая точность определения концентрации титранта.
приготовленные
установленныерастворы титрантов.
Приготовленныерастворы получают путем растворения точной навески тщательно очищенного исходного вещества в определенном объеме воды или другого растворителя (например, раствор NaCl, K2Cr2O7). Однако многие растворы таким путем приготовить нельзя, в том числе, NaOH, KMnO4. В таких случаях готовят раствор титранта приблизительной концентрации, а потом его стандартизуют, т. е. устанавливают концентрацию с необходимой точностью. Такие растворы называют установленными. Для стандартизации титрантов применяют специальные установочные вещества, так называемые первичные стандарты.
Первичные стандарты – вещества, имеющие состав, точно отвечающий химической формуле. Они должны удовлетворять следующим требованиям:
быть устойчивы на воздухе и иметь, по возможности, большую молярную массу эквивалента;
быть доступными, легко очищаться от примесей;
реакция вещества титранта с установочным веществом должна протекать быстро, количественно и стехиометрически.
Растворы NaOH и КОН часто стандартизуют по дифталату калия КНС8Н4О4 или дигидрату щавелевой кислоты Н2С2О4 · 2Н2О.
Растворы HCl и H2SO4 стандартизуют по карбонату натрия Na2СО3 или декагидрату тетрабората натрия Na2В4О7 ·10 Н2О.
Иногда для стандартизации используют вторичные стандарты. В качестве вторичных стандартов выступают титрованные растворы веществ, способных взаимодействовать с титрантом. Например, стандартизацию раствора HCl можно сделать по титрованному раствору NaOH.
Основное правило, которое необходимо помнить: стандартизация титранта и последующее выполнение анализа необходимо проводить в одних и тех же условиях, а для стандартизации использовать то же вещество, которое будет анализироваться в дальнейшем.
Стандартные растворы готовят в мерных колбах из фиксаналов, которые содержат точно фиксированное количество вещества, обычно 0,1 моль эквивалента.
При стандартизации растворов используют: 1) метод отдельных навесок; 2) метод пипетирования.
Метод отдельных навесок
Рассчитывают массу навески стандартного вещества при условии, что расход титранта на её титрование составляет не более 20 мл. На аналитических весах взвешивают в бюксах три навески, которые могут отличаться от рассчитанной на ± 10 %. Затем их переносят точно в конические колбы для титрования, добавляют индикатор и титруют. Рассчитывают молярную концентрацию титранта для каждой навески стандартного вещества и расхождение между наибольшим и наименьшим результатами. Если расхождение не превышает 0.2 – 0.3 %, то берут среднее значение из всех трех результатов. В случае большего расхождения взвешивают еще одну навеску стандартного вещества, титруют её, находят четвертый результат и снова проверяют сходимость значений молярной концентрации
Метод пипетирования
При стандартизации растворов этим методом рассчитывают навеску стандартного вещества, необходимую для приготовления заданного объема раствора первичного стандарта с концентрацией, как правило. близкой к молярной концентрации титранта. Взвешенную на аналитических весах навеску твердого вещества количественно переносят в мерную колбу, растворяют, тщательно перемешивая. Аликвоту полученного раствора отбирают пипеткой, предварительно промытой этим раствором, в коническую колбу для титрования и титруют стандартизуемым раствором. Аликвота – порция вещества, содержащаяся в растворе, отобранном с помощью пипетки.
При стандартизации раствора титрование проводят не менее трех раз. Если объемы, затраченные на титрование, совпадают между собой в пределах 0,2 – 0,3 %, то берут из них среднее значение и рассчитывают молярную концентрацию титранта. В случае большего расхождения проводят повторное титрование.
Для приготовления стандартных растворов используют также «фиксаналы» (стандарт-титры). Фиксанал представляет собой стеклянную или пластиковую ампулу, содержащую точную навеску стандартного твердого вещества (или определенный объем титрованного раствора), необходимую для приготовления 1 литра точно 0.1 N раствора.

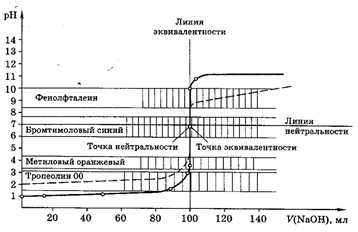
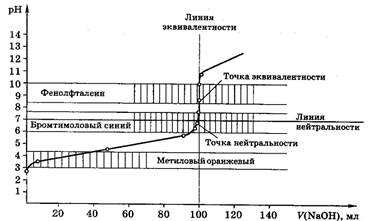
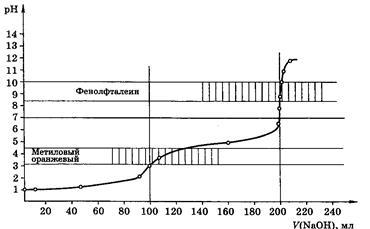
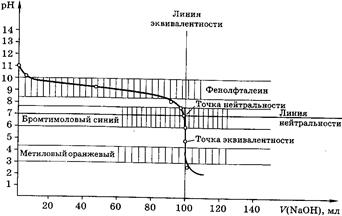
Кривые титрования
Кривые титрования являются важной характеристикой титриметрического метода. Они показывают графическую зависимость логарифма концентрации участника реакции, протекающей при титровании, или какого-то свойства раствора от объема добавленного титранта (или от степени оттитрованности). Например, для реакции кислотно-основного титрования: рН – V (объем титранта).
Кривая титрования служит для подбора индикатора, который позволит определить т.э. и т.к.т.
Рис 1. Кривая титрования 100,0 мл 0,1М НСl 0,1М раствором NaOH
Рис 2. Кривая титрования 100,0 мл 0,1М СН3СООН 0,1М раствором NaOH
Рис 3. Кривая титрования смеси 0,1М НСl и 0,1М СН3СООН 0.1М раствором NaOH
Рис 4. Кривая титрования 100,0 мл 0,1М NН3 0,1М раствором НСl
Рис 5. Кривая титрования 100,0мл 0,1М Н3РО4 0,1М раствором NaOH
Рис 6. Кривая титрования 100,0мл 0,1М Na2СО3 0,1М раствором НСl
Источник
Стандартизация решений в том, что состоит и решаемых упражнений
стандартизация решений это процесс, который позволяет точно определить концентрацию раствора. Вещества, используемые для этой цели, называются первичными стандартами..
Раствор стандартизируют, используя метод объемного титрования (титрование), либо классическими, либо инструментальными методами (потенциометрия, колориметрия и т. Д.)..
Для этого растворенные вещества заранее реагируют с тяжелым первичным стандартом. Поэтому использование объемных баллонов является обязательным условием для этих количественных анализов..
Например, карбонат натрия является основным стандартом, используемым при стандартизации кислот, включая соляную кислоту, которая становится титрантом, поскольку его можно использовать при титровании гидроксида натрия. Таким образом, основность выборки может быть определена.
Объемы титранта добавляются непрерывно, пока он не прореагирует с эквивалентной концентрацией аналита. Это указывает на то, что степень эквивалентности степени была достигнута; другими словами, титрант «нейтрализует» аналит полностью, превращая его в другой химический вид.
Известно, когда добавление титранта должно быть завершено с помощью индикаторов. Момент, в котором индикатор меняет цвет, называется конечной точкой титрования..
- 1 Что такое стандартизация??
- 2 Характеристики первичных стандартов
- 3 Примеры основных стандартов
- 3.1 Стандартизировать базы
- 3.2 Стандартизировать кислоты
- 3.3 Стандартизировать окислительно-восстановительные реагенты
- 4 упражнения
- 4.1 Упражнение 1
- 4.2 Упражнение 2
- 4.3 Упражнение 3
- 5 ссылок
Что такое стандартизация?
Стандартизация — это не что иное, как получение вторичного стандарта, который будет использоваться для количественных определений. Как? Потому что, если вы знаете его концентрацию, вы можете знать, каким будет аналит, как только он будет назван.
Когда требуется большая точность в концентрации растворов, раствор для титрования стандартизируется так же, как и раствор, который она собирается назвать.
Реакции, в которых используется метод титрования, включают:
-Кислотно-основные реакции. Концентрация многих кислот и оснований может быть определена объемным методом.
-Реакции восстановления оксида. Химические реакции, включающие окисление, широко используются в объемном анализе; как например, йодометрические определения.
-Реакции осадков. Катион серебра осаждается вместе с анионом группы галогенов, таким как хлор, с получением хлорида серебра, AgCl.
-Реакции комплексообразования, например реакция серебра с цианид-ионом.
Характеристики первичных стандартов
Вещества, используемые в качестве основных стандартов, должны соответствовать ряду требований для выполнения их функции стандартизации:
-Имеют известный состав, так как в противном случае не будет точно известно, сколько следует взвесить из стандарта (не говоря уже о расчете его последующей концентрации).
-Быть стабильным при комнатной температуре и сопротивляться температурам, необходимым для сушки на плите, включая температуру, равную или превышающую температуру кипения воды.
-Имейте большую чистоту. В любом случае содержание примесей не должно превышать 0,01-0,02%. Кроме того, примеси могут быть определены качественно, что облегчит удаление возможных помех в анализах (например, ошибочные объемы используемого титранта).
-Быстро сохнет и не может быть настолько гигроскопичным, то есть удерживать воду во время сушки. И при этом они не должны терять вес при воздействии воздуха.
-Не поглощайте газы, которые могут вызвать помехи, а также вырождение рисунка
-Быстро и стехиометрически реагировать с реагентом-титрантом.
-Имеет высокий эквивалентный вес, который уменьшает ошибки, которые могут быть допущены при взвешивании вещества.
Источник
Стандартизация раствора титранта
Под стандартизацией раствора титранта имеют в виду установление его точной концентрации с относительной погрешностью, обычно не превышающей ± 0,1 %. Обязательным условием этой процедуры является высокая точность определения концентрации титранта.
· приготовленные
· установленные растворы титрантов.
Приготовленные растворы получают путем растворения точной навески тщательно очищенного исходного вещества в определенном объеме воды или другого растворителя (например, раствор NaCl, K2Cr2O7).
Однако многие растворы таким путем приготовить нельзя, в том числе, NaOH, KMnO4. В таких случаях готовят раствор титранта приблизительной концентрации, а потом его стандартизуют, т. е. устанавливают концентрацию с необходимой точностью. Такие растворы называют установленными.
Для стандартизации титрантов применяют специальные установочные вещества, так называемые первичные стандарты. Первичные стандарты – вещества, имеющие состав, точно отвечающий химической формуле. Они должны удовлетворять следующим требованиям:
· быть устойчивы на воздухе и иметь, по возможности, большую молярную массу эквивалента;
· должны быть негигроскопичны;
· быть доступными, иметь высокую чистоту (х.ч. или ч.д.а.), либо легко очищаться от примесей;
· реакция вещества титранта с установочным веществом должна протекать быстро, количественно и стехиометрически.
Растворы NaOH и КОН часто стандартизуют по дифталату калия КНС8Н4О4илидигидрату щавелевой кислоты Н2С2О4 · 2Н2О.
Растворы HCl и H2SO4 стандартизуют по карбонату натрия Na2СО3 или декагидратутетрабората натрия Na2В4О7 ·10 Н2О.
Иногда для стандартизации используют вторичные стандарты. В качестве вторичных стандартов выступают титрованные растворы веществ, способных взаимодействовать с титрантом. Например, стандартизацию раствора HCl можно сделать по титрованному раствору NaOH.
Основное правило, которое необходимо помнить: стандартизация титранта и последующее выполнение анализа необходимо проводить в одних и тех же условиях, а для стандартизации использовать то же вещество, которое будет анализироваться в дальнейшем.
Стандартные растворы готовят в мерных колбах из фиксаналов, которые содержат точно фиксированное количество вещества, обычно 0,1 моль эквивалента.
При стандартизации растворов используют: 1) метод отдельных навесок; 2) метод пипетирования.
1. Метод отдельных навесок.
Рассчитывают массу навески стандартного вещества при условии, что расход титранта на её титрование составляет не более 20 мл. На аналитических весах взвешивают в бюксах три навески, которые могут отличаться от рассчитанной на ± 10 %. Затем их переносят точно в конические колбы для титрования, добавляют индикатор и титруют. Рассчитывают молярную концентрацию титранта для каждой навески стандартного вещества и расхождение между наибольшим и наименьшим результатами. Если расхождение не превышает 0,2 – 0,3 %, то берут среднее значение из всех трех результатов. В случае большего расхождения взвешивают еще одну навеску стандартного вещества, титруют её, находят четвертый результат и снова проверяют сходимость значений молярной концентрации.
2. Метод пипетирования.
При стандартизации растворов этим методом рассчитывают навеску стандартного вещества, необходимую для приготовления заданного объема раствора первичного стандарта с концентрацией, близкой к молярной концентрации титранта. Взвешенную на аналитических весах навеску твердого вещества количественно переносят в мерную колбу, растворяют, тщательно перемешивая. Аликвоту полученного раствора отбирают пипеткой, предварительно промытой этим раствором, в коническую колбу для титрования и титруют стандартизуемым раствором. Аликвота – порция вещества, содержащаяся в растворе, отобранном с помощью пипетки.
При стандартизации раствора титрование проводят не менее трех раз. Если объемы, затраченные на титрование, совпадают между собой в пределах 0,2 – 0,3 %, то берут из них среднее значение и рассчитывают молярную концентрацию титранта. В случае большего расхождения проводят повторное титрование.
Для приготовления стандартных растворов используют также «фиксаналы» (стандарт-титры). Фиксанал представляет собой стеклянную или пластиковую ампулу, содержащую точную навеску стандартного твердого вещества (или определенный объем титрованного раствора), необходимую для приготовления 1 литра точно 0,1 моль/л раствора.
Источник