Химическое производство органических веществ
К органическим относятся вещества, в состав которых входит углерод, водород, кислород и азот, значительно реже – сера и фосфор.
Производится до 600 тыс. органических соединений, число которых продолжает быстро расти за счет синтеза новых веществ, в природе не встречающихся, но играющих существенную роль в жизни человеческого общества (пластмасс, каучуков, синтетических волокон, красителей, взрывчатых веществ, пестицидов, лекарственных препаратов).
Наиболее важным источником органических соединений является нефть, состоящая в основном из углеводородов различного строения. Последние содержатся также в природном газе, каменном угле, торфе, горючих сланцах и др.
В работе рассматриваются наиболее крупнотоннажные и экологически опасные технологии переработки жидкого, твердого и газообразного органических веществ природного происхождения.
Коксохимическое производство
Основным сырьем для коксохимического передела является каменный уголь, из которого получают кокс, служащий основным видом топлива в металлургических процессах. Полученные попутно с коксом продукты (газ, смолы, бензолы и т.д.) используют как сырье для производства парфюмерии, лаков, анилиновых красок, пластмассы, медикаментов и т.п.. Химическая продукция современных коксохимических заводов составляет около 60% стоимости кокса.
Коксованию подлежат специальные сорта каменных углей, способные в процессе сухой перегонки превращаться в твердую спекшуюся массу.
Технологический процесс коксования включает подготовку шихты, сухую перегонку (без доступа воздуха) и спекание угля при температурах 1100–1200 0 С, улавливание выделяющихся химических продуктов и обработку коксового пирога.
Подготовка шихты состоит из приема и складирования углей, их усреднения, дозирования компонентов шихты, ее обогащения и последующего обезвоживания. Крупнокусковой уголь перед обогащением предварительно измельчают.
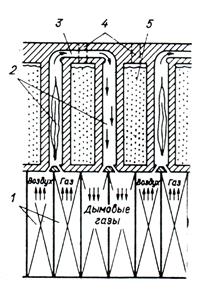
Спекание шихты осуществляют в коксовых печах, которые представляют собой камеры в форме вытянутого параллелепипеда с габаритами по высоте, длине, ширине до 8×18×0,65 м и вмещают свыше 22 т сухой шихты. Группа из 45–70 камер составляет одну коксовую батарею. Между камерами расположены обогревательные простенки, в которых движутся продукты горения доменного газа. Простенки в верхней части соединены переходными каналами. Воздух для сжигания газа предварительно нагревают до 900–1100 0 С в регенераторах. На каждую камеру приходится два регенератора, один из которых нагревается продуктами горения, а в другом, ранее разогретом регенераторе, происходит подогрев доменного газа, сгорающего в нижней части простенка (рисунок 10.1). Через некоторое время направление движения газов меняется.
1 – регенераторы; 2 – обогреваемые вертикалы; 3 – обводной канал;
4 – отверстия для загрузки шихты; 5 – камера коксования
Рисунок 10.1 – Схематический разрез коксовой батареи
В камерах коксования, работающих периодически, по мере роста температуры из шихты удаляются пары воды и летучие вещества. При 350 0 С начинается разложение угля с выделением смол. При 350–500 0 С шихта переходит в пластическое состояние. При повышении температуры до 1000–1100 0 С получают кокс (спекшуюся массу). Спекание коксующегося угля сопровождается усадкой и появлением пор. Выделяющиеся смола и летучие вещества отсасываются для химической переработки.
Продолжительность коксования составляет 15–17 часов, современные батареи производят до 20 тыс. т. кокса в сутки.
Загрузка коксовой камеры производится через люки, расположенные в своде печи. Для выдачи кокса открывают две противоположные дверцы, закрывающие оба конца сквозной коксовой камеры, и раскаленный кокс при помощи коксовыталкивателя выдавливается из нее.
Кокс из камеры передается в тушильную башню для мокрого (водой) или сухого (азотом) тушения. Операция предотвращает горение раскаленного кокса. После тушения кокс подвергается грохочению, куски классом 25–60 мм направляют в доменную плавку. Более мелкий кокс используют как восстановитель в различных металлургических процессах.
Основными химическими продуктами коксования являются коксовый газ, бензол, фенолы, нафталин, каменноугольная смола, сульфат аммония и каменноугольный пек.
В экологическом отношении коксохимическое производство является одним из наиболее опасных. На всех его стадиях выделяется значительная масса загрязнителей.
Крупным источником токсичных веществ служат цеха коксохимического производства, перерабатывающие продукты коксования: бензол, каменноугольную смолу и др. На долю коксохимического производства приходится более 70% канцерогенов от их общего количества, образующегося в металлургии.
Дефицитностью коксующихся углей инициируются разработки по бескоксовой металлургии, внедоменных способов производства железа и его сплавов, а также замене части кокса в доменной плавке углем и природным газом, вдуваемыми через фурмы.
Переработка нефти
На современном этапе развития промышленного производства ориентируются на глубокую переработку нефти, при которой получают искусственное топливо (жидкое и газообразное), смазочные масла, нефтяные битумы и пеки, сырье для производства пластмассы, химических волокон, синтетических каучуков, моющих средств и т.д. Глубина переработки нефти в передовых странах достигает 90%, в нашей стране она составляет 62–64%. По объему потребления наибольшее значение для народного хозяйства имеют искусственные жидкие топлива (горючее), смазочные масла и консистентные смазки.
Жидкие топлива в зависимости от их назначения классифицируются на карбюраторные (авиационный и автомобильный бензин) и дизельное, отличающееся высокой теплотой сгорания, превышающей 40 тыс. кДж/кг.
Карбюраторное топливо используют в двигателях внутреннего сгорания с зажиганием от электрической искры.
Дизельное топливо используют в поршневых двигателях внутреннего сгорания с воспламенением его от сжатия при 550–600 0 С. К дизельному топливу относятся керосин и соляровое масло.
После отгонки моторного топлива из нефти остается вязкая черная жидкость – мазут. Его используют как топливо или перерабатывают в смазочные масла и бензин.
Вторая группа нефтепродуктов (смазочные масла) применяется для уменьшения трения во всех движущихся деталях и отвода от них тепла.
Третью группу нефтепродуктов – консистентные (мазеобразные) смазки – получают добавлением к смазочным маслам загустителей (масла, сульфидов, силикатов и др.).
Добытую нефть перед отправкой на переработку подвергают очистке от механических примесей, воды, газов, растворенных веществ, которую ведут физическими и химическими методами, включающими стадию нагревания нефти или нефтепродуктов до высоких температур с разделением на фракции (смеси) или выделением индивидуальных углеводородов.
Перегонка нефти (физический метод) основана на разнице температур кипения и конденсации органических соединений, входящих в состав нефти. Перегонка заключается в разделении исходной сложной по составу жидкости на отдельные фракции (дистилляты).
Средние выходы различных дистиллятов приведены в таблице 10.1.
При переработке нефти выход наиболее ценных продуктов (бензина) недостаточен и обычно не превышает 15%, что не может покрыть все возрастающий спрос народного хозяйства на этот и другие виды моторного топлива. Увеличения их выхода достигают применением химических процессов переработки, резко увеличивающих выход бензина (до 70% массы сырья).
Таблица 10.1 – Выходы дистиллятов при прямой перегонке нефти
| Дистиллят | Температура отбора, 0 С | Выход, % от массы нефти |
| Первая ступень | ||
| Бензиновый | До 170 | 14,5 |
| Лигроиновый | 160–200 | 7,5 |
| Керосиновый | 200–300 | 18,5 |
| Соляровое масло | 300–350 | 5,0 |
| Остаток – мазут | 55,0 | |
| Вторая ступень (Перегонка мазута под вакуумом 6–7 кПа) | ||
| Веретенный | 230–250 | 10–12 |
| Машинный | 260–305 | |
| Легкий цилиндровый | 315–325 | |
| Тяжелый цилиндровый | 350–370 | |
| Остаток – гудрон | 27–30 |
При переработке с применением более высоких, чем при прямой перегонке, температур молекулы органических соединений нефти распадаются на относительно мелкие с меньшим числом атомов углеводороды. Одновременно протекают вторичные процессы, в которых продукты распада образуют молекулы новых соединений, отличающихся от исходных строением и составом. Ко вторичным относятся процессы полимеризации (отщепление водорода от какого-либо соединения) и многие другие. Первичные и вторичные процессы переработки нефти и нефтепродуктов называют крекингом.
При крекинге образуется большее количество газообразных веществ (водород, метан, бутан, пропилен, этилен и др.), являющихся сырьем для органического синтеза.
Добыча, переработка и транспортировка нефти сопряжены с загрязнением окружающей среды. Потенциальным его источником является сеть нефтепроводов. Ежегодно происходит до 700 крупных разрывов нефтепроводов, при этом потери достигают 7–20% добываемой нефти.
На угрожающем уровне находится нефтяное загрязнение Мирового океана. В настоящее время одна треть океанической поверхности покрыта нефтяной пленкой. Межконтинентальная транспортировка нефти, осуществляемая нефтеналивными судами, составляет почти половину общего объема морских перевозок.
Значительным фактором загрязнения окружающей среды являются предприятия нефтехимической и нефтеперерабатывающей отраслей. Зона активного загрязнения почвы составляет 1–3 км от предприятия при общем распространении загрязняющих веществ, в том числе попадающих в сельскохозяйственные культуры, на расстояние не менее 20 км.
Методы очистки от нефти и нефтепродуктов достаточно многочисленны, однако универсального способа нет. Применение того или иного метода определяется свойствами загрязненной среды, ее температурой, составом и свойствами нефти, масштабом загрязнения, его расположением относительно населенных пунктов, предприятий народного хозяйства и многими другими факторами.
Переработка природного газа
Природный газ представляет углеводородное сырье, основным компонентом которого является метан, который используется как высококалорийное экологически чистое топливо во всех отраслях народного хозяйства. Газ ряда месторождений России характеризуется высоким содержанием неуглеводородных компонентов: до 3,6% H2S; 0,2–2,6% СО2; 6–36% суммы азота и редких газов (гелия, неона). Сочетание разнородных по свойствам веществ обусловливает необходимость глубокой комплексной переработки природного газа.
Первая стадия технологии заключается в абсорбционном извлечении из газа основных неуглеводородных соединений (в основном сероводород и диоксид углерода), которые отправляются на установки по выработке серы.
Дальнейшее криогенное разделение природного газа осуществляют низкотемпературной конденсацией с последовательным четырехступенчатым охлаждением газа гелием. Продуктами разделения являются метановая и этановая фракции и гелиевый концентрат, который в дальнейшем очищается до чистоты 99,995%.
Источник
Способы производства органических веществ
В производстве органических веществ существуют два направления:
- основной органический синтез;
- тонкий органический синтез.
Целевые продукты
К целевым продуктам основного органического синтеза относятся синтетическое жидкое топливо, смазочные масла, растворители и экстрагенты, мономеры, пластификаторы полимерных материалов, пестициды, средства защиты растений и другие.
Полупродукты
В качестве полупродуктов используются, как правило, простейшие представители гомологических рядов соответствующих соединений:
- углеводородов – этилен, пропилен, бензол;
- галогензамещенных – дихлорэтан, винилхлорид;
- спиртов – метанол, этанол;
- альдегидов и кетонов – ацетальдегид, ацетон;
- органических кислот – уксусная кислота и т.д.
Продукция основного органического синтеза
Мировое производство двадцати продуктов основного органического синтеза превышает 1 миллион тонн в год, а производство более чем ста продуктов достигает 200 тысяч тонн каждого в год. Масштабы производства продуктов основного органического и нефтехимического синтеза иллюстрирует табл. 4.1.
Основным или тяжелым органическим синтезом называется совокупность производств органических веществ относительно простого строения, получаемых в очень больших количествах и используемых как в качестве целевых продуктов, так и полупродуктов в других отраслях органической технологии. История развития основного органического синтеза представлена в приложении 5.
Тонкий органический синтез объединяет производства органических веществ сложного строения, которые производятся в небольших количествах как целевой продукт. К таким органическим веществам относятся красители, фото- и кинореактивы, фармацевтические препараты, взрывчатые вещества, парфюмерные средства и т.п.
Основной органический синтез объединяет производства продуктов, которые составляют основу сырьевой базы остальной промышленной органической химии. В большинстве случаев основной органический синтез отождествляется с нефтехимическим синтезом. Это связано с изменением структуры сырьевого баланса производств органической технологии в последние десятилетия и переориентацией на нефтяное сырье. Продукция основного органического синтеза исчисляется многими сотнями тысяч и миллионами тонн в год.
Источник
Способы производства органических веществ
Получение органических соединений, относящихся к различным классам, является основной задачей органического синтеза, как основного, так и тонкого. В основе многих методов получения лежат именные реакции, условия проведения которых необходимо запомнить, поскольку в органической химии именно условия определяют образующийся продукт реакции. В целом все реакции, лежащие в основе получения органических веществ, можно условно разделить на следующие типы:
1. Реакции, направленные на удлинение цепи (конструктивные реакции), например, алкилирование, полимеризация, (поли)конденсация
2. Реакции, направленные на укорочение углеродной цепи (реакции расщепления)
3. Реакции введения, удаления или взаимопревращения функциональных групп
4. Реакции образования кратных связей
5. Реакции циклизации и ароматизации
Далее, в виде справочного материала представлены основные методы получения углеводородов и их основных производных — спиртов, альдегидов, кетонов, карбоновых кислот, аминов, нитро- и галогенпроизводных. Подробно методы получения будут рассматриваться по классам соединений в отдельных темах.
Методы получения алканов
1. Синтез симметричных насыщенных углеводородов (наращивание углеводородной цепи) действием металлического натрия на алкилгалогениды (Реакция Вюрца)
2. Восстановление непредельных углеводородов (гидрирование двойной кратной связи) :
3. Получение метана сплавлением солей карбоновых кислот с твердой щелочью :
4. Получение метана — гидролиз карбида алюминия (взаимодействием карбида алюминия с водой):
5. Ректификация (прямая перегонка) нефти подробно разбирается в теме «Принципы переработки и применение горючих ископаемых»
Методы получения алкенов
1. Дегидрогалогенирование (действие спиртовых растворов щелочей на моногалогенпроизводные УВ)
2. Дегидратация спиртов (действие на спирты водоотнимающих средств):
3. Дегалогенирование (действие металлического Zn или Mg на дигалогенпроизводные с двумя атомами галогена у соседних атомов):
4. Гидрирование ацетиленовых углеводородов над катализаторами с пониженной активностью ( Fe)
5. Пиролиз (дегидрирование) алканов (этана) ( см. п. 2 «Методы получения алкинов»)
Методы получения алкинов
1. Пиролиз метана — межмолекулярное дегидрирование (промышленный метод):
H − CH 3 + H 3 C − H → H − C ≡ C − H + 2 H 2
2. Пиролиз (дегидрирование) этана или этилена (промышленный метод)
3. Гидролиз карбида кальция (взаимодействие карбида кальция с водой):
CaC 2 + 2 H 2 O → HC ≡ CH + Ca ( OH )2
Получение гомологов ацетилена
1. Дегидрогалогенирование (действие спиртового раствора щелочи на дигалогеналканы (щелочь и спирт берутся в избытке):
2. Удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами:
Методы получения алкадиенов
Общие способы получения диенов аналогичны способам получения алкенов.
1. Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах:
В промышленности каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен:
2. Синтез бутадиена (дивинила) из этилового спирта (реакция Лебедева):
3. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):
4. Дегидрогалогенирование вицинальных дигалогенпроизводных в присутствии спиртового раствора щелочи:
Методы получения Бензола и его гомологов (ароматических УВ)
Основные методы получения ароматических углеводородов основаны либо на процессах циклизации с последующим дегидрированием, при наличии в УВ-цепи более шести атомов углерода, образуются гомологи безола с боковой цепью. Процесс тримеризации ацетилена используется при синтезе бензола и, тем самым, подтверждает его структуру.
1. Дегидрирование циклогексана (получение бензола)
2. Тримеризация ацетилена (получение бензола) реакция Зелинского
3.Риформинг (ароматизация нефти)
4. Коксование каменного угля — нагрев без доступа воздуха до 1000°С. Образуется смесь летучих веществ, каменноугольной смолы и твердый остаток – кокс. Смола – жидкая смесь органических веществ, из которой выделяют многие органические соединения, в том числе и арены.
Методы получения спиртов:
предельных одноатомных, гликолей, фенолов
1. Щелочной гидролиз моногалогенпроизводных алканов (нуклеофильное замещение)
2. Гидратация этилена и несимметричных алкенов (электрофильное присоединение) по правилу Марковникова
3. Восстановление (гидрирование) альдегидов (первичные спирты) и кетонов (вторичные спирты)
4.Спиртовое брожение растительного сырья, содержащего углеводы:
Получение гликолей (двухатомных предельных спиртов)
1. Окисление двойной кратной связи (только мягкое окисление!) реакция Вагнера:
Обратите внимание, что при действии жестких окислителей (подкисленного раствора пераманганата калия или озона) образуются карбонильные соединения (карбоновые кислоты и альдегиды), поскольку реакция протекает с разрывом и σ — π -связей.
Получение фенола (ароматического спирта)
1. Кумольный способ (основной промышленный способ)
2. Щелочной гидролиз хлорбензола
3. Выделение из каменноугольной смолы — продукта коксования каменного угля.
Методы получения альдегидов и кетонов
В классе кислородсодержащих углеводородов альдегиды занимают промежуточное положение в генетической цепочке: спирты — альдегиды — кислоты. Поэтому основные методы получения основаны на восстановлении кислот или на окислении спиртов.
1. Восстановление (дегидрирование) спиртов: первичных — до альдегидов, вторичных — до кетонов
пропанол-2 пропанон-2 (ацетон)
2. Окисление спиртов (условный окислитель — CuO , KMnO 4 , кислород воздуха в присутствии катализатора — Pt, Cu): первичных — до альдегидов, вторичных — до кетонов
3. Избирательное восстановление карбоновых кислот
4. Восстановление (гидрирование) хлорангидридов кислот по Розенмунду (катализатор — платиновая чернь, палладий)
5. Сухая перегонка кальциевых и бариевых солей одноосновных кислот: для всех кислот — кетоны; для муравьиной кислоты — альдегид.
В промышленности альдегиды получают следующими способами:
а) каталитическим окислением алканов (метана):
б) каталитическим окислением этилена кислородом воздуха (Вакер-процесс):
в) гидратацией ацетилена в присутствии солей ртути (реакция Кучерова):
Методы получения карбоновых кислот
Карбоновые кислоты являются последним звеном окислительной цепочки «спирты — альдегиды — кислоты», поэтому методы их получения основаны на реакциях окисления.
В промышленности карбоновые кислоты получают мягким каталитическим окислением кислородом воздуха алканов, спиртов и альдегидов. В качестве катализатора используют платину, палладий, соли олова и др., реакции проводят при нормальном давлении и 200 0 C . Окисление альдегидов происходит наиболее легко без дополнительного нагревания.
1. Окисление алканов:
2. Окисление спиртов:
3. Окисление альдегидов:
Специфическими методами синтеза простейших карбоновых кислот (муравьиной и уксусной) являются:
1. Синтез уксусной кислоты каталитическим формилированием метанола (катализатор оксид вольфрама, температура 400 ∘ C давление
2. Синтез муравьиной кислоты из окиси углерода и гидроксида натрия при нагревании с последующей обменной реакцией с серной кислотой:

3. Синтез муравьиной кислоты из окиси углерода и паров воды (катализатор соли меди, серная или фосфорная кислота):
CO + H 2 O → HCOOH
4. Получение карбоновых кислот из цианидов (нитрилов) проводится в две стадии и позволяет наращивать углеродную цепь:
Методы получения аминов и анилина
1. Взаимодействие аммиака с алкилгалогенидами (RX):
2. Взаимодействие аммиака со спиртами (катализатор — Al 2 O 3, SiO 2; t =300−500 ∘ C )
3. Восстановление азотсодержащих органических соединений (получение анилина):
В общем виде восстановление нитропроизводных до аминов происходит следующим образом:
где [H] — условный восстановитель: H 2 в присутствии катализатора (Cu, Ni, Pt, Pd); металл (Fe, Zn, Sn) и кислота; соли металлов в низших степенях окисления ( SnCl 2, TiCl 3 )
4. Восстановление нитрилов:
где [H] — восстановитель: H 2/ Ni ; LiAlH 4
5. Восстановление амидов карбоновых кислот:
6. Перегруппировка Гоффмана:
RC ( O ) NH 2 + Br 2 + 2 NaOH → RNH 2 + 2 NaBr + CO 2+ H 2 O
Методы получения нитропроизводных углеводородов: нитроалканов, ароматических нитросоединений
1. Синтез первичных нитроалканов из галогенпроизводных (реакция Мейера):
где Х= Br или I. Условия: абсолютный эфир, t = 0−200 C
2. Реакция Коновалова — нитрование алифатических, алициклических и жирноароматических соединений разбавленной Н N О 3 при повышенном или нормальном давлении (свободнорадикальный механизм) и при температуре 140—150 °C.
2. Нитрование ароматических углеводородов нитрующей смесью — электрофильное замещение:
Реакция электрофильного нитрования лежит в основе синтеза взрывчатых веществ, в том числе тринитротолуола (тротила):
Методы получения галоидпроизводных углеводородов
1. Свободнорадикальное (гомолитическое) галогенирование предельных УВ: замещение атомов водорода, преимущественно у наименее гидрогенизированного атома углерода:
R − H + X 2 → R − X + HX
и далее продолжение цепи до полного замещения. Реакционная способность галогенов по отношению к алканам уменьшается в ряду:
2. Гидрогалогенирование непредельных УВ: присоединение по кратным связям. Для получения дигалогенпроизводных — галогенирование
H 2 C = CH − CH 3 + HCl → H 3 C − CH ( Cl )− CH 3
Источник






.gif)













































