- Получение и применение одноатомных спиртов
- Получение одноатомных спиртов
- Применение одноатомных спиртов
- Способы применения одноатомных спиртов
- Одноатомные спирты — строение, классификация и свойства
- Описание и общая формула одноатомных спиртов
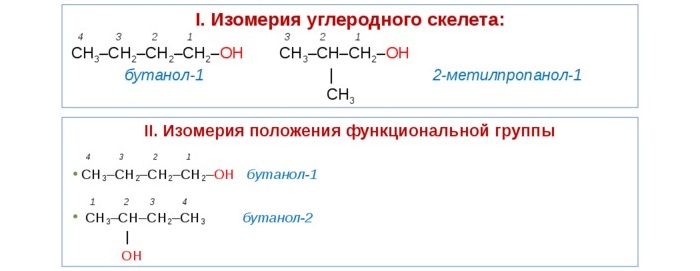
- Изомерия одноатомных спиртов
- Физические свойства
- Химические свойства
- Получение
- Применение одноатомных спиртов
Получение и применение одноатомных спиртов
Одноатомные спирты являются важным сырьем в химическом производстве многих органических соединений. Так, производство только этанола составляет около 130 млн. тонн/год. Пищевой спирт получают из пищевого сырья — картофеля, зерновых культур, корнеплодов, сахарной патоки, ягод и других богатых углеводами культурами. Но существует множество способов их синтеза из непищевого сырья. Рассмотрим каково получение и применение одноатомных спиртов.
Получение одноатомных спиртов
1) Гидролиз галоидпроизводных водой при повышенных температурах протекает медленно:
R-Hal + Н-OH → R-OH + H-Hal
При применении влажной соли серебра замена галоида на гидроксил происходит быстрее:
2R-Hal + Ag2O + Н-OH → 2R-OH + 2Ag-Hal
Еще быстрее реакция протекает при применении щелочей, но осложняется протеканием побочной реакции отщепления галоидводорода с образованием алкенов:
2) Гидрирование окиси углерода в различных условиях позволяет получить как чистый метиловый спирт, так и смесь его первичных гомологов:
3) Восстановление оксосоединений водородом под действием катализаторов – Pt, Ni или других восстановителей. При этом их альдегидов получаются первичные спирты, а из кетонов – вторичные:
4) Восстановление карбоновых кислот и их производных. Широко известен метод Буво – Блана — восстановление сложных эфиров карбоновых кислот действием натрия в кипящем спирте:
5) Присоединение металлорганических соединений (магний-, литий-, цинк-, натрийорганических соединений) к альдегидам и кетонам. Наиболее часто используются магнийорганические соединения, так называемый реактив Гриньяра. При присоединении таких соединений к формальдегиду приводит к образованию первичных спиртов, к другим альдегидам – ко вторичным спиртам, а при присоединении к кетонам образуются третичные спирты:
6) Гидратация алкенов при повышенной температуре, в присутствии кислот. В зависимости от строения алкена можно получить первичные, вторичные или третичные спирты:
При действии BH3 или B2H6 на алкен также получают спирт: 7) Гидроформилирование с восстановлением позволяет получить из пропена бутанол и 2-метилпропанол в соотношении 3:1 соответственно:
При этом возможно протекание реакции димеризации масляного альдегида с получением 2-этилгексанола:
Этот способ получения спирта относится к промышленным способам.
8) Альфол-процесс – синтез высших жирных спиртов в промышленности: 9) Дрожжевое брожение сахаров (глюкозы, фруктозы, мальтозы и после предварительного гидролиза сахарозы) приводит к образованию этанола и углекислого газа:
Применение одноатомных спиртов
Спирты используют в качестве исходного реагента для получения важных органических соединений, необходимых в производстве растворителей, полимерных соединений, красителей и лекарственных препаратов (например, альдегидов, кетонов, карбоновых кислот простых и сложных эфиров).
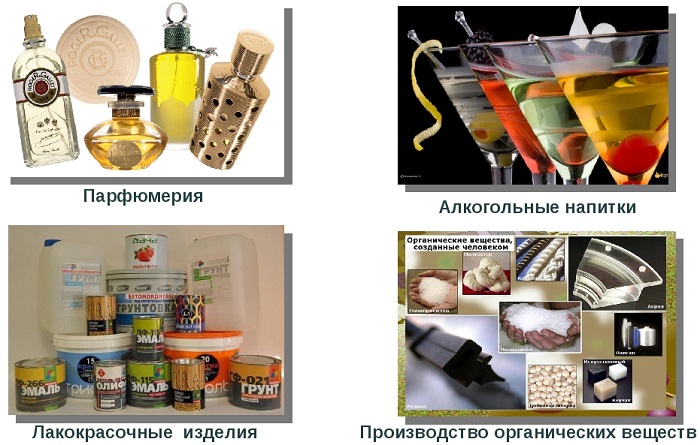
Далее представлены сферы применения наиболее важных представителей класса одноатомных спиртов – метанола, этанола, бутанола, бензилового и фенитилового спиртов.
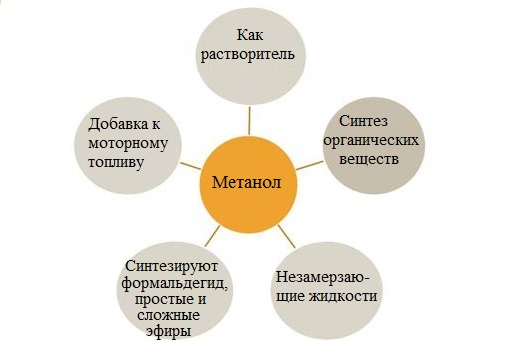
- Метанол – хороший растворитель, его используют в лакокрасочной промышленности, при производстве фенолформальдегидных смол, а также в качестве добавки к незамерзающим жидкостям и моторному топливу.
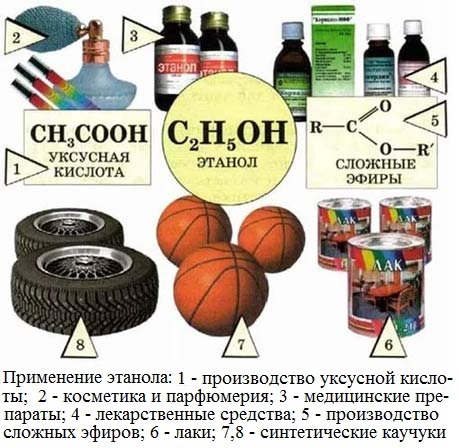
- Этанол широко применяют в медицинской практике в качестве антисептического средства; на его основе готовят различные лекарственные средства (настойки, сиропы, растворы и др.). Кроме этого он используется в производстве алкогольных напитков, в химическом синтезе органических соединений, например, ацетальдегида, уксусной кислоты, сложных эфиров карбоновых кислот.
- Бутанол чаще всего используют в качестве растворителя жиров и смол. Также из него получают сложные эфиры карбоновых кислот, обладающие приятным запахом — бутилацетат, бутилсалицилат и др. душистые вещества. Как добавка в шампунях он способствует повышению их прозрачности.
- Бензиловый и фенетиловый спирты используются в косметических средствах в качестве консерванта, а также душистого вещества. Бензиловый спирт имеет запах жасмина, а фенетиловый спирт – запах розы.
Категории ОРГАНИЧЕСКАЯ ХИМИЯ, Спирты
Источник
Способы применения одноатомных спиртов
Спирты главным образом используются в промышленности органического синтеза. Этанол – важное сырье пищевой промышленности.
Метанол СН3ОН – используют как растворитель, в производстве муравьиной кислоты, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в последнее время метанол рассматривают как перспективное моторное топливо. Большие объемы метанола используют при добыче и транспорте природного газа. Метанол – наиболее токсичное соединение среди всех спиртов, смертельная доза при приеме внутрь – 30-100 мл.
Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство.
Бутанол C4H9OH используют как растворитель жиров и смол, кроме того, он служит сырьем для получения душистых веществ (бутилацетата, бутилсалицилата и др.). В шампунях он используется как компонент, повышающий прозрачность растворов.
Бензиловый спирт С6Н5–CH2–OH в свободном состоянии (и в виде сложных эфиров) содержится в эфирных маслах жасмина и гиацинта. Он обладает антисептическими (обеззараживающими) свойствами, в косметике он используется как консервант кремов, лосьонов, зубных эликсиров, а в парфюмерии — как душистое вещество.
Фенетиловый спирт (фенилэтиловый) С6Н5–CH2–CH2–OH обладает запахом розы, содержится в розовом масле, его используют в парфюмерии.
Источник
Одноатомные спирты — строение, классификация и свойства
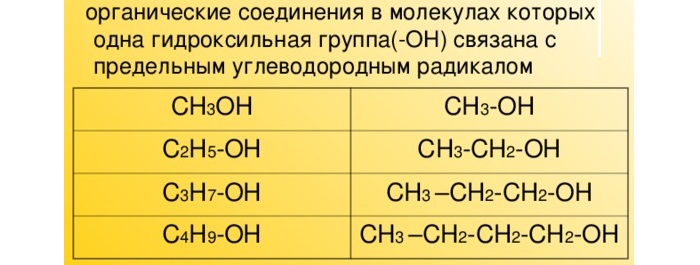
Одноатомные спирты (алкоголи) – это производные алканов, молекула которых имеет одну функциональную гидроксильную группу. Она связана с насыщенным атомом углерода.
В учебниках химии можно встретить определение спиртов – это обширный класс химических соединений, выполняющих важнейшие функции в живых организмах. Рассматриваемые вещества широко применяются в промышленном производстве и повседневной жизни.
Описание и общая формула одноатомных спиртов
В таких спиртах атом водорода замещается гидроксильной группой ОН. Они имеют формулу CnH2n+1OH.
В современной номенклатуре их названия связаны с гомологическим рядом предельных алканов с суффиксом –ол (этанол, пропанол, бутанол, пропанол, гексанол и проч).
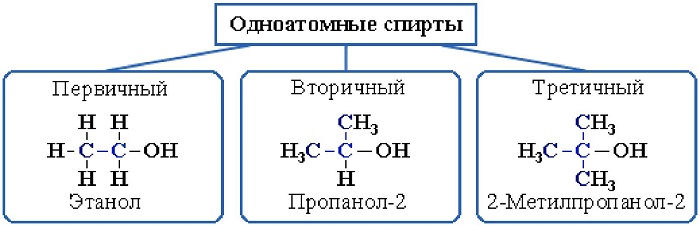
В зависимости от размещения группы ОН, существует классификация алкоголей:
первичные –группа ОН присоединена к первому атому С;
вторичные – гидроксильная группа присоединена ко второму атому этого элемента;
третичные – группа ОН присоединена к третьему атому углерода.
Изомерия одноатомных спиртов
Для этих веществ характерны разные виды изомерии:
Структурная – изменение расположения ОН начиная с соединений, содержащих 3 атома углерода. Так, существует пропанол 1 (н-пропиловый) и пропанол-2 (изопропиловый).
Изомерия углеродного звена – изменение положения гидроксильной группы, начиная с веществ, молекула которых содержит 4 углеродных атома. Так, бутанолу соответствует четыре разных изомера.
Межклассовая изомерия (с эфирами). Этиловому алкоголю с формулой СН3CH2–OH соответствует диметиловый эфир CH3–O–CH3.
Пространственная, или зеркальная изомерия.
Физические свойства
Вещества с количеством атомов углерода до 15 являются летучими жидкостями с резким запахом. Соединения с числом атомов углерода свыше 15 являются твердыми веществами.
Начальный член гомологического ряда (метанол) чрезвычайно токсичен для человека.
Чем выше спирт, тем и выше его температура кипения. Различия между каждым членом гомологического ряда составляет примерно 20 градусов. По мере увеличения размера молекулы и ее массы снижается и их воспламеняемость. Следовательно, легче всех воспламеняется метанол.
Соединения, имеющие в составе молекулы 9 атомов углерода, растворяются в воде (метанол и этанол – в каком угодно соотношении). Хорошо растворяются в растворителях.
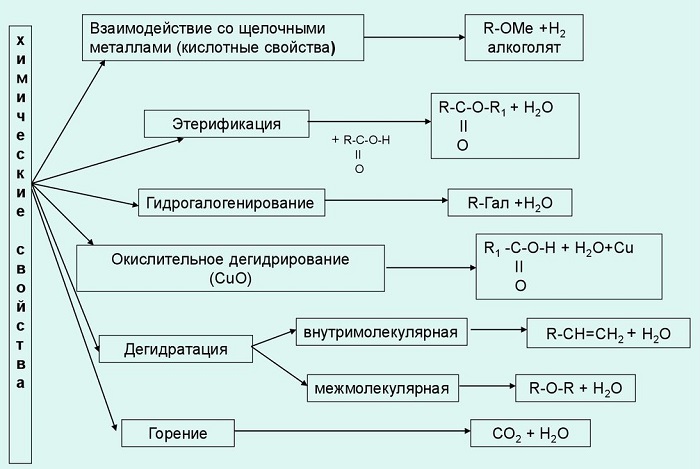
Химические свойства
Рассматриваемые вещества ведут себя и как основания, и как кислоты.
Основные химические свойства одноатомных спиртов:
Взаимодействие с щелочными металлами. При этом образуются алкоголяты или алкоксиды. В воде эти вещества подвергаются гидролизу, образуя спирт и основание.
Взаимодействие с кислотами (органическими и неорганическими). По-другому они называются реакциями этерификации, поскольку конечный их продукт — сложный эфир.
Реакция с хлористым тионилом дает в итоге галогеналкан.
В результате внутримолекулярного обезвоживания получают алкены.
При межмолекулярной дегидратации образуются простые эфиры.
Химическая реакция одноатомного алкоголя с перманганатом калия дает альдегид. Дальнейшим окислением альдегида можно получить одноатомную карбоновую кислоту.
Получение
Известно несколько методов получения простых спиртов:
1. Гидратация алкенов (с присоединением молекулы воды):
2. Гидролиз алкилгалогенидов (с добавлением водных растворов щелочей):
3. Восстановление кетонов:
4. Этанол получают путем разложения глюкозы:
5. Восстановление карбоновых кислот и сложных эфиров.
6. Присоединение металлорганических химических соединений к кетонам и альдегидам.
Применение одноатомных спиртов
Одноатомные спирты широко применяются как исходный реагент для получения альдегидов, кетонов, карбоновых кислот и эфиров. Все эти вещества широко применяются в производстве и быту.
Вот примеры использования наиболее распространенных спиртов:
Метанол является прекрасным органическим растворителем. Его применяют в производстве лаков и красок, органических смол.
Этанол широко используется в медицине как антисептик и растворитель. В пищевой промышленности его используют для получения алкогольных напитков. Он является основой для получения сложных эфиров, уксуса.
Бутанол применяется как растворитель и основа для получения веществ с приятным ароматом.
Бензиловый спирт является основой для получения душистых веществ.
Рассмотренные в статье вещества имеют широкое применение в промышленности. Без них невозможно получение многих веществ, использующихся в быту.
Источник