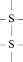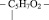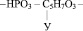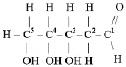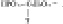Способы применения нуклеиновых кислот
Нуклеиновые кислоты представляют собой высокомолекулярные линейные гетерополимеры, мономерами которых являются нуклеотиды. Нуклеотиды в свою очередь состоят из азотистых оснований, пентозы (рибозы или дезоксирибозы) и остатка фосфорной кислоты. Азотистые основания нуклеиновых кислот относятся к классам пиримидинов и пуринов. Пиримидиновые основания являются производными пиримидина, имеющего в составе своей молекулы одно кольцо.
Главная функция нуклеиновых кислот в организме — поддерживать и стимулировать процессы активации и обновления клеток всех тканей и органов. В настоящее время существует несколько групп препаратов на основе нуклеиновых кислот: «Ферровир», «Полидан», «Натрия нуклеоспермат», «Плацентес-интерго», «Дезокстнат» и др. Наиболее известным препаратом является «Деринат» — натриевая соль низкомолекулярной нативной ДНК, полученной из молок лососевых рыб. «Нуклеинат натрия» — является препаратом микробного происхождения и представляет собой смесь натриевых солей нуклеиновых кислот, получаемую гидролизом дрожжей с последующей очисткой. Препарат может быть назначен при различных заболеваниях, сопровождающихся снижением защитной функции иммунитета. «Ридостин» — препарат рибонуклеиновых кислот, полученный из лизата дрожжей – используется в качестве иммуномодулятора, интерфероногена, противовирусное, противомикробное, противоопухолевое действие.
Синтетические полинуклеотиды представляют собой искусственно синтезированные РНК. Лекарственные средства способны моделировать первичный и повторный иммунные ответы, индуцировать интерфероногенез и противоопухолевый иммунитет. Синтетические препараты ДНК и РНК различного происхождения в настоящее время считаются, несомненно, перспективными терапевтическими и иммуномоделирующими агентами, так как имеют широкий спектр общебиологических эффектов.
Источник
Синтетические нуклеиновые кислоты в лечении психоневрологических заболеваний
Опубликовано чт, 18/07/2019 — 13:12
Концепция использования нуклеиновых кислот в качестве лекарств сложилась в 70-х годах прошлого века ондовременно с разработкой методов синтеза ДНК и РНК-олигонуклеотидов. Синтетические нуклеиновые кислоты обладают способностью специфически связываться с последовательностью РНК-мессенджера (мРНК) и контролировать экспрессию любого гена. Поскольку эти олигонуклеотиды были комплементарны мРНК смысловой цепи, они стали известны как ASO.
Вторая технология для подавления экспрессии генов появилась 20 лет спустя с открытием того , что дуплексные РНК могут блокировать экспрессию генов в клетках человека через путь интерференции РНК. Дуплексные РНК могут быть мощными регуляторными агентами и имеют большие перспективы в качестве платформы для разработки лекарств.
Большинство лекарств представляют собой небольшие молекулы и имеют молекулярную массу менее 500 Да. Маленькие молекулы эффективны при нацеливании на активный сайт фермента или сайт связывания лиганда в рецепторе, потому что они могут плотно вписаться в молекулярные карманы и эффективно блокировать ключевые функции, например , рецептора. Однако некоторые белки имеют множество функций или не имеют соответствующих им связывающих карманов, способных образовывать адекватные взаимодействия. В других случаях недостаток белка является проблемой. Для этих заболеваний использование малых молекул иногда будет проблематичным, поскольку нет четкого обоснования того, почему маленькая молекула должна увеличивать экспрессию или активность определенного гена.
Потенциал ASO в плане их развития в качестве лекарств был сразу очевиден. Однако , исследователи столкнулись с серьезными препятствиями. Синтетические олигонуклеотиды — это крупные (3000 Да), сильно отрицательно заряженные молекулы, которые мало похожи на традиционные лекарства. Кроме того, нуклеиновые кислоты подвержены деградации нуклеазами и могут вызывать иммунный ответ. Синтез олигонуклеотида требует десятков химических стадий, каждая из которых должна быть почти идеально эффективной. Наконец, химический состав ASO необходимо оптимизировать для обеспечения эффективного распознавания мишеней внутри клеток.
Коммерческое развитие проекток ASO началось в 80-х годах прошлого века и характеризовалось многократными колебаниями между оптимизмом и разочарованием, потому что клинические исследования показали определенную перспективу и затем исчезли , когда результаты 3 были опубликованы. Одно из соединений — фомивирсен, было одобрено Управлением по контролю за продуктами и лекарствами США в 1998 году для лечения цитомегаловирусного ретинита после внутриглазного введения. Ещеодин препарат — ломитапид был направлен на экспрессию аполипопротеина В, тем самым снижая уровень холестерина и добился позитивных результатов при системном введенияи пациентам с гомозиготной семейной гиперхолестеринемией.
Синтетические олигонуклеотиды химически модифицируют в целях улучшения биораспределения, фармакокинетики и эффективности своего эффекта внутри клеток. Как правило, ASO имеют фосфоротиоатные связи между нуклеотидами. Эти связи повышают устойчивость к расщеплению нуклеазой и увеличивают биодоступность за счет улучшения связывания с сывороточными белками. Чтобы увеличить сродство связывания с РНК-мишенями, большинство ASO модифицированы в 2 ‘положении рибозы. Блокированная нуклеиновая кислота и аналогичные нуклеотиды нуклеиновой кислоты с мостиковыми связями содержат связи между положениями 2 ‘и 4’ рибозы, которые служат для «блокировки» кольца в конформации, которая идеально подходит для связывания. Лучшая аффинность связывания может быть преобразована в более эффективное распознавание последовательностей-мишеней внутри клеток.
В некоторых случаях разрушение РНК и ингибирование экспрессии генов являются желаемыми результатами. В этих случаях используются «гамперы» ASO. Гапмеры представляют собой синтетические ASO, которые содержат фланкирующие области, содержащие 2′-нуклеотидные модификации и центральную часть ДНК. Фланкирующие области усиливают сродство к комплементарным последовательностям. При связывании разрыв ДНК образует гибрид ДНК-РНК, который может рекрутировать РНКазу Н и вызывать расщепление целевой мРНК.
Другое приложение для ASO — перенаправление альтернативного сплайсинга. Для этого применения ASO не требуется рекрутировать РНКазу H. Вместо этого химически модифицированные нуклеотиды распределяются по всему ASO для увеличения аффинности связывания.Соединения разрабатываются так, чтобы быть специфичными для последовательностей вблизи соединений интрон / экзон.
Успешное развитие ASO выиграет от анализа потенциала конкурирующих технологий. Например, ASO могут не быть предпочтительными, если есть ожидание, что конкурирующая малая молекула или антитело могут быть успешно разработаны. Эти более устоявшиеся технологии, вероятно, будут иметь преимущества, по крайней мере, в ближайшей и среднесрочной перспективе. Были проведены исследования, что ASO могут быть перорально биодоступными, но эффективность здесь оказалось низкой. Отсюда следует, что пероральная биодоступность, вероятно, не совсем подходит для текущего состояния технологии ASO. По крайней мере, в ближайшей перспективе ASO незнакомы пациентам, врачам и регулирующим органам. В качестве альтернативы, показания, при которых возможно местное применение, могут потребовать меньшего количества ASO, снижения его стоимости и отделения ASO от воздействия на органы всего организма, то есть снижения вероятности появления системных токсических эффектов и непредвиденных отрицательных результатов. Для неврологии было показано, что интратекальное введение обеспечивает широкое распространение по всей центральной нервной системе. Исследования эффективности ASO, при которых изменения в белковой мишени или биомаркере может быть определено посредством биопсии или взятия крови, обеспечат раннее доказательство того, что ASO взаимодействует с мишенью и вызывает желаемые молекулярные изменения.
Атаксия Фридрейха
Атаксия Фридрейха — это полиорганная болезнь, которая поражает центральную нервную систему, сердце, поджелудочную железу и другие заболевания.
Атаксия Фридрейха вызвана расширенным тринуклеотидным повторением AAG в гене фратаксина ( FXN ). Примечательно, что этот расширенный повтор AAG находится в интроне и вызывает снижение экспрессии белка FXN, даже если он не находится в кодирующей области. Нормальный белок FXN производится, но уровень не является достаточным. Следовательно, методы лечения, которые восстанавливают уровни FXN, предлагают подход к лечению, который нейтрализует основную причину заболевания.
Как может мутация с интроном, которая обычно сплайсируется из зрелой мРНК перед трансляцией белка, снижать экспрессию белка? Наиболее вероятный механизм включает связывание расширенного тринуклеотидного повтора AAG с хромосомной ДНК посредством образования R-петли, в которой мутантная РНК распознает соответствующую последовательность ДНК путем спаривания оснований Уотсона-Крика. Это связывание препятствует транскрипции в локусе FXN , снижает продукцию РНК и приводит к снижению уровня белка FXN.
Напрашивается вывод, что олигонуклеотиды, которые блокируют расширенный повтор, могут предотвратить образование R-петли и освободить разрыв при транскрипции. Исследователями предлагаются дуплексные РНК или ASO, дополняющие повтор AAG. Оба подхода привели к увеличению экспрессии РНК и белка. Уровни белка FXN были аналогичны уровням, наблюдаемым в клетках дикого типа. Исследование показало, что синтетические нуклеиновые кислоты могут быть использованы для восстановления уровней FXN, обеспечивая отправную точку для терапевтического эффекта. Эти данные предполагают, что механизм действия ASO или дуплексных РНК включает в себя связывание с расширенным повтором и физическое предотвращение его ассоциирования хромосомной ДНК с образованием критической структуры R-петли.
«Антисмысловые олигонуклеотиды» ( ASO) эффективно ингибируют экспрессию генов в печени и центральной нервной системе. Использование их для лечения широкого спектра тканей, необходимых для полного лечения атаксии Фридрейха, потребует более сильнодействующих соединений и более эффективных стратегий доставки олигонуклеотидов во все пораженные ткани.
Спинальная мышечная атрофия
Спинальная мышечная атрофия является аутосомно-рецессивным заболеванием, характеризующимся мышечной атрофией и параличом. Это наиболее частая генетическая причина смерти у детей, затрагивающая спинномозговые нейроны ствола мозга и двигательные нейроны.Спинальная мышечная атрофия вызвана мутацией в гене мотонейрона выживания 1 ( SMN1 ), который снижает уровень активного белка SMN1. У людей также есть второй ген SMN , SMN2 , но этот ген имеет мутацию C to T в экзоне 7, которая влияет на сплайсинг и приводит к нестабильной изоформе. Если бы эту проблему сплайсинга можно было исправить, ген SMN2 мог бы вырабатывать активный белок и облегчать симптомы атрофии мышц позвоночника.
«Антисмысловые олигонуклеотиды» ( ASO) могут влиять на альтернативный сплайсинг, блокируя ключевые последовательности, которые регулируют действие белков-сплайсинговых факторов. «Антисмысловые олигонуклеотиды», которые нацелены на интрон 7 в пределах SMN2, могут увеличивать включение экзона 7 и продукцию функционального белка SMN. Эта коррекция сплайсинга увеличивает белок SMN в моторных нейронах и купирует симптомы у модельных мышей с мышечной атрофией позвоночника. Недавно были опубликованы данные клинических испытаний фазы 1 для корректирующего сплайсинг ASO — нусинерсена (nusinersen), и они выглядят многообещающими.
Источник
Научная электронная библиотека
§ 2.1.11. Аминокислоты. Белки. Нуклеиновые кислоты
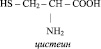
Аминокислотами называются органические соединения, содержащие аминогруппу и карбоксильную группу. Например:
Аминокислоты относятся к веществам со смешанными функциями. Кроме того, они являются азотсодержащими и кислородсодержащими одновременно. Некоторые природные аминокислоты содержат также серу, как, например, цистеин:
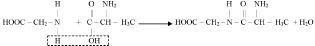
Наиболее характерным химическим свойством аминокислот является способность аминогруппы одной молекулы вступать в реакцию замещения с карбоксильной группой другой молекулы:
В результате образуется новая аминокислота, но уже с пептидной связью, способная взаимодействовать со следующей молекулой аминокислоты и образовать ещё одну пептидную связь. Последовательное увеличение количества пептидных связей в одной молекуле приводит к образованию полимеров, которые называются полипептидами, важнейшими представителями которых являются белки.
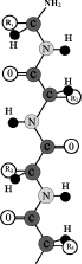
Белки – важнейшая составная часть клеток живых организмов – представляют собой полипептиды, составленные взаимодействием различных α-аминокислот. Таким образом, белки можно рассматривать как полимеры, мономером которых являются α-аминокислоты. Молекулярные массы природных белков колеблются от нескольких десятков тысяч до нескольких сот тысяч а.е.м. Аминокислотные остатки, являющиеся звеньями полипептида называют аминокислотными звеньями. Последовательность аминокислотных звеньев в линейной полипептидной цепи называется первичной структурой белковой молекулы (рис. 2.6).
Рис. 2.6. Первичная структура белков.
R1, R2, R3, R4 – радикалы остатков аминокислот
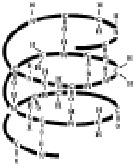
Благодаря многочисленным водородным связям между группами –СО– и –NH– первичная структура белков свёртывается в спираль, которая называется вторичной структурой белковой молекулы (рис. 2.7).
Рис. 2.7. Вторичная структура белков
В свою очередь, вторичная структура также способна свернуться, образовав третичную структуру (рис. 2.8).
Рис. 2.8. Третичная структура белков
Третичная структура поддерживается уже не только водородными связями, но также и ковалентными. В частности между атомами серы различных участков полипептида часто образуется дисульфидный мостик
Некоторые белковые макромолекулы могут соединяться друг с другом, образуя относительно крупные агрегаты. Подобные полимерные образования белков называются четвертичными структурами. Примером такого белка является гемоглобин, который представляет комплекс из четырёх макромолекул (рис. 2.9). Оказывается, что только при такой структуре гемоглобин способен присоединять и транспортировать кислород в организме.
Рис. 2.9. Четвертичная структура белков
Нуклеиновыми кислотами (полинуклеотидами) называют высокомолекулярные органические соединения, повторяющимся звеном которых являются нуклеотиды состоящие из
1. Остатка фосфорной кислоты – НРО3 –
2. Остатка рибозы 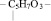
3. Радикалов азотистых оснований, а именно таких как: аденин, тимин, гуанин, цитозин, урацил.
Например, если радикал урацила обозначить У, то молекулярную формулу одного из нуклеотидов можно представить следующим образом:
К нуклеиновым кислотам относятся рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК). Рибонуклеиновые кислоты – это полинуклеотиды, включающие в себя остаток рибозы, радикалы аденина, гуанина, цитозина и урацила. Поскольку различные нуклеотиды РНК отличаются только радикалами азотистых оснований, то нередко каждый нуклеотид обозначают прописной первой буквой названия этого нуклеотида. Поэтому фрагмент какой либо РНК можно представить так
Первичная структура молекулы белка, синтезируемого на информационной (матричной) рибонуклеиновой кислоте (м-РНК) с помощью ферментов[31], определяется именно последовательностью нуклеотидов на этой РНК. Набору из трёх азотистых оснований, который называется триплет нуклеотидов или кодон, соответствует одна и только одна α-аминокислота. В настоящее время насчитывается 20 таких аминокислот (табл. х). Но одной аминокислоте может соответствовать несколько триплетов нуклеотида. Соответствие аминокислоты кодонам называется генетическим кодом. Реакции синтеза белка, у которого последовательность аминокислотных звеньев определяется последовательностью нуклеотидов м-РНК, называются реакциями матричного синтеза.
Последовательность нуклеотидов и-РНК в свою очередь определяется последовательностью азотистых оснований в дезоксирибонуклеиновой кислоте (ДНК), на которой и происходит синтез м-РНК
Дезоксирибонуклеиновые кислоты – это кислоты, состоящие из двух полинуклеотидных цепей, включающих в себя остаток дезоксирибозы, радикалы аденина, гуанина, цитозина, тимина и соединённых между собой по принципу комплементарности (совместимости) водородными связями. То есть, вместо радикала урацила, нуклеотиды ДНК содержат тимил, вместо остатка рибозы, остаток дезоксирибозы,
образующей замкнутый цикл соединением альдегидной группы с гидроксогруппой четвёртого атома углерода.
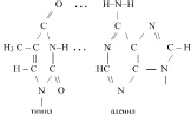
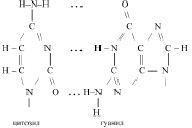
При этом А комплементарен Т, Г комплементарен Ц. То есть, фрагмент первичной структуры ДНК можно представить следующим образом:
Действительно, аденил в ДНК образует водородную связь только с тимилом, а тимил, только с аденилом. Гуанил только с цитозилом, а цитозил только с гуанилом:
Молекулярную формулу одного из нуклеотидов ДНК можно представить так
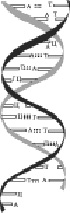
Вторичная структура ДНК представляет собой двойную спираль – две нити ДНК закручены одна вокруг другой (рис. 2.10).
Рис. 2.10. Вторичная структура ДНК
Ферментативный синтез м-РНК осуществляется на одной из цепей ДНК в соответствии с принципом комплементарности. При этом аденин ДНК комплементарен урацилу РНК, тимил ДНК коиплементарен аденину РНК, гуанил ДНК комплементарен цитозилу РНК, цитозил ДНК комплементарен гуанилу РНК. Затем с м-РНК осуществляется матричный синтез белка. К каждому кодону информационной РНК доставляется соответствующая аминокислота с помощью транспортной РНК (т-РНК).
Таким образом, основным хранителем информации о структуре всех белков, вырабатываемых организмом является ДНК.
Отрезок ДНК, содержащий информацию о первичной структуре одного определённого белка, называется геном.
Процесс переписывания информации, содержащейся в гене ДНК на м-РНК называется транскрипцией.
1. Приведите структурные формулы аминокислот, которые Вы знаете. Дайте им названия.
2. Дайте определения понятиям: полипептиды и белки.
3. Что представляют собой первичная, вторичная, третичная и четвертичная структуры белка?
4. В чём сходство и различия химического состава, строения ДНК и РНК? Что такое ген?
5. Каким образом в клетках живых организмов синтезируется м-РНК? Что такое транскрипция?
6. Что такое матричный синтез? Почему в качестве отдельной структурной единицы РНК рассматривают три соседних нуклеотида, а не два или, например, четыре?
Источник