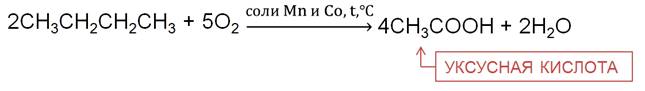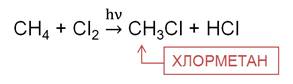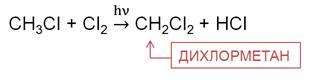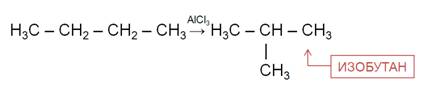- Применение алканов
- Применение алканов
- Применение в промышленности
- Применение в медицине и фармации
- Способы применения алканов 10 класс
- Применение алканов
- Описание
- Применение
- Что мы узнали?
- Алканы: свойства, получение и применение
- Урок 10. Химия 10 класс (ФГОС)
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Алканы: свойства, получение и применение»
Применение алканов
Предельные углеводороды с общей формулой CnH2n+2, основным источником которых служат нефть, газ и каменный уголь, являются сырьевой базой для химической промышленности и основными природным источником энергии.
Применение алканов
Первоначально насыщенные углеводороды использовались как топливо — в результате горения высвобождается энергия:
Области применения алканов связаны с их физико-химическими свойствами:
- Газообразные алканы (метан, пропан и бутан). Горят бледно-голубым или бесцветным пламенем, при этом выделяется большое количество тепла. Применяются для бытовых нужд – как топливо в газовых плитах, зажигалках и газовых баллончиках для туристических горелок. В промышленных объемах — как топливо для газовых электростанций, вырабатывающих тепло и электроэнергию. Метан как часть природного газа — один из лучших природных субстратов, используемых в биотехнологии.
- Жидкие алканы. Являются основной частью горючего для двигателей внутреннего сгорания – от мотоциклетных до ракетных. Изомеры линейных алканов применяют как добавку для повышения качества топлива. Смесь предельных углеводородов с длиной цепочки не более 15 атомов углерода — вазелиновое масло применяют в косметологии и медицине. В промышленности применяют гудрон (остаточный продукт после переработки нефти) для производства строительных кровельных и дорожных битумов и кокса.
- Твердые алканы. Смесь жидких и твердых углеводородов с цепочкой до 25 атомов углерода – вазелин — густая масса, используется в медицине и косметических целях. Смесь алканов С20 -С35 называют парафином и используют для производства свечей, обработки упаковочных материалов и спичек. Парафиновые углеводороды служат основным сырьем для биосинтеза.
Применение в промышленности
Парафины являются основой для производства целого ряда веществ:
- азотной кислоты HNO3;
- насыщенных одноатомных cпиртов СnH2n+1OH;
- сажа (аморфный углерод) — для типографской краски и резины;
- галогензамещенных растворителей и хладонов;
- алкенов;
- альдегидов, которые используются в производстве органических кислот и пластмасс;
- как нефтехимическое сырье для производства ПАВ.
Алканы применяются при производстве синтетических моющих средств.
Исходными веществами для этого служат парафины фракции С41-С44 .
Применение в медицине и фармации
Смесь жидких и твердых парафинов с С Значение алканов
Предельные углеводороды применяются в пищевой и химической промышленности, в энергетике, косметологии и медицине.
Алканы служат растворителями и сырьем для производства лаков, красок, мазей. Их используют в качестве топлива и компонентов для различных битумов.
Химическое производство пластика, ПАВов и синтетических тканей использует в качестве сырья алканы.
С развитием технологий сферы применения насыщенных углеводородов расширяется.
Источник
Способы применения алканов 10 класс
1. Из природного и попутного нефтяного газа
Важнейшим источником алканов в природе является природный газ, минеральное углеводородное сырье — нефть и сопутствующие ей нефтяные газы. Природный газ на 95 процентов состоит из метана. Такой же состав имеет болотный газ, образующийся в результате переработки бактериями (гниения) углеводов. Метан называют ещё и болотным; рудничным газом .
Попутные нефтяные газы состоят в основном из этана, пропана, бутана и частично пентана. Их отделяют от нефти на специальных установках по подготовке нефти. При отсутствии газоконденсатных станций попутные нефтяные газы сжигают в факелах, что является крайне неразумной и разорительной практикой в нефтедобыче. Одновременно с газами нефть очищается от воды, грязи и песка, после чего поступает в трубу для транспортировки. Из нефти при ее разгонке (перегонке, дистилляции) отбирая последовательно все более и более высококипящие фракции получают:
- бензины — т. кип. от 40 до 180 С, (содержит углеводороды С 5 -С 10 ), состоит более, чем из 100 индивидуальных соединений, нормальных и разветвленных алканов, циклоалканов, алкенов и ароматических углеводородов;
- керосин 180-230 C, (С 11 -С 12 );
- легкий газойль (дизельное топливо) 230-305 С (С 13 -С 17 );
- тяжелый газойль и легкий дистиллят смазочного масла 305-405 С (С 18 -С 25 );
- смазочные масла 405-515 С (С 26 -С 38 ).
Остаток после перегонки нефти называется асфальтом или битумом .
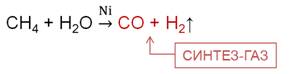
2. Синтезом из водяного газа: n CO + (2n + 1) H2 — t,kat → CnH2n+2 + n H2O
Источник
Применение алканов

Средняя оценка: 4.5
Всего получено оценок: 309.
Средняя оценка: 4.5
Всего получено оценок: 309.
Алканы получают из нефтепродуктов, природного газа, каменного угля. Главное применение алканов – использование в качестве топлива. Из веществ также изготавливают растворители, косметические средства, асфальт.
Описание
Алканы – класс насыщенных или предельных углеводородов. Это значит, что молекулы алканов содержат максимальное количество атомов водорода. Общая формула соединений гомологического ряда алканов – CnH2n+2. Названия веществ составляются из греческого обозначения числительных и суффикса -ан.
Физические и химические свойства алканов зависят от их строения. С возрастанием количества атомов углерода в молекуле происходит переход от газообразных веществ к твёрдым соединениям.
Агрегатное состояние алканов в зависимости от количества атомов углерода:
Газы горят голубым пламенем с выделением большого количества тепла. Алканы содержащие 18-35 атомов углерода – воскообразные, мягкие вещества. Из их смеси изготавливают парафиновые свечи.

С увеличением молекулярной массы в гомологическом ряду повышаются температуры плавления и кипения.
Применение
Алканы выделяют из полезных ископаемых – нефти, газа, каменного угля. На разных этапах переработки получают бензин, керосин, мазут. Алканы используются в медицине, косметологии, строительстве.

В таблице описаны основные области применения предельных углеводородов.
Область
Что используют
Как используют
Бензин, керосин, мазут
В качестве ракетного, моторного топлива
В качестве бытового газа для приготовления пищи
Петролейный эфир (смесь изопентанов и изогексанов),
Изготовление растворителей, смазочных масел, пропитки
Изготовление вазелинового масла (смесь жидких алканов), вазелина (смесь жидких и твёрдых алканов), свечей, моющих средств, лаков, эмалей, мыла. В качестве пропитки спичек. Использование при производстве органических кислот
Изготовление спиртов, альдегидов, кислот
Вазелин, вазелиновое масло
В качестве пропеллентов для изготовления аэрозолей
Изготовление увлажняющих косметических средств
Гудрон (дёготь) – конечный продукт переработки нефти, содержащий смесь алканов, циклоалканов, аренов, металлов, неметаллов
Для изготовления асфальтовых дорог
В качестве пропитки упаковочной бумаги
Производство жевательных резинок
Алканы используются при изготовлении каучука, синтетических тканей, пластмасс, поверхностно-активных веществ. В качестве заправки баллонов для тушения пожаров используются пропан и бутан в сжиженном виде.
Что мы узнали?
Узнали кратко об области применения алканов. Насыщенные углеводороды в газообразном, жидком, твёрдом состоянии используются в химической, пищевой, бумажной, энергетической отраслях, в косметологии и строительстве. Из алканов производят растворители, краски, лаки, мыло, свечи, мази, асфальт. Бензин, керосин, мазут, состоящие из жидких алканов, используют в качестве топлива. Газообразные алканы применяются в быту и для производства аэрозолей. Основные источники алканов – нефть, природный газ, каменный уголь.
Источник
Алканы: свойства, получение и применение
Урок 10. Химия 10 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Алканы: свойства, получение и применение»
Предельные углеводороды – алканы, при обычных условиях достаточно инертны. Для них свойственны реакции замещения атомов водорода и реакции расщепления. Эти реакции требуют жёстких условий: нагревания, действия света, наличия катализаторов. Поэтому алканы ещё называют парафинами, что означает мало сродства.
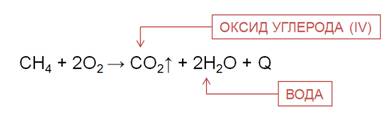
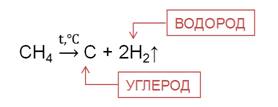
Для алканов характерны реакции окисления. При полном окислении, например, метана образуется углекислый газ, вода и выделяется большое количество теплоты.
По этой причине метан в составе природного газа используют в качестве топлива в домах, на электростанциях, горючего для машин.
Смеси метана с кислородом (1 : 2 по объёму или воздухом 1 : 10) опасны и приводят к взрывам.
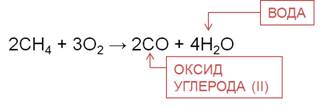
При частичном окислении, например, при недостатке кислорода, образуется оксид углерода (II) и вода.
При частичном окислении бутана в присутствии катализаторов образуется уксусная кислота.
Для алканов свойственны реакции замещения (галогенирования). Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов.
С фтором реакция идёт со взрывом, с йодом алканы не взаимодействуют, а с хлором и бромом в присутствии инициаторов.
В реакции метана с хлором на свету на первой стадии образуется хлорметан. Хлорметан представляет собой газ, легко сжижается, он применяется в холодильных установках.
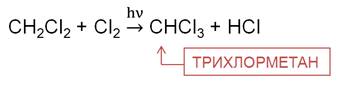
На второй стадии образуется дихлорметан. Это растворитель, его используют для склеивания пластика.
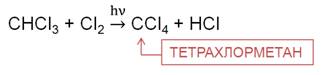
На третьей стадии хлорирования метана образуется трихлорметан. Трихлорметан – бесцветная летучая жидкость с эфирным запахом, используется при производстве фреонового хладагента, в качестве растворителя в фармакологии, для производства красителей и пестицидов.
На четвёртой стадии образуется тетрахлорметан, который применяют как растворитель, а также для получения фреонов, как экстрагент в медицине, тетрахлорметан применялся как наполнитель для переносных огнетушителей в советской бронетехнике.
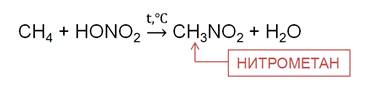
При нагревании алканов до 140 0 C с разбавленной (10 %) HNO3 под давлением идёт реакция нитрирования, то есть замещения атома водорода нитрогруппой. Эту реакцию называют ещё реакцией М. Н. Коновалова. В результате реакции метана с азотной кислотой образуется нитрометан.
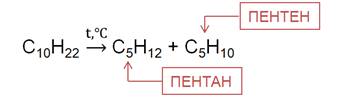
При температуре более 500 0 C в присутствии катализаторов алканы подвергаются расщеплению, то есть крекингу. Это приводит к образованию смеси алкенов и алканов.
При температуре 1000 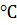
Таким образом, получают технический углерод – пигмент для изготовления типографической краски и наполнителя резины для автомобильных шин.
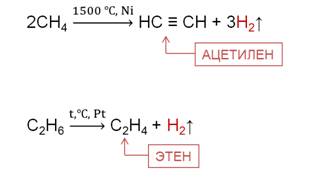
При повышенных температурах алканы образуют, главным образом, непредельные углеводороды. Например, в реакции дегидрирования метана при температуре 1500 0 C образуется ацетилен и водород, в реакции дегидрирования этана образуется этен и водород.
Под влиянием катализаторов и при температуре углеводороды нормального строения подвергаются изомеризации с образование углеводородов разветвлённого строения. Так, в присутствии катализатора хлорида алюминия происходит изомеризация бутана с образованием изобутана.
При конверсии метана образуется синтез-газ, который представляет собой смесь угарного газа с водородом.
Рассмотрим получение алканов.
В промышленности насыщенные углеводороды – алканы получают при переработке нефти.
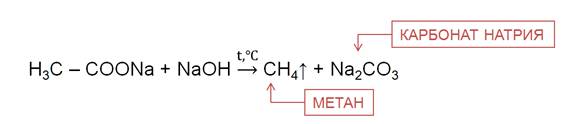
В лаборатории алканы можно получить различными способами. Например, из солей карбоновых кислот при нагревании с твёрдыми щелочами.
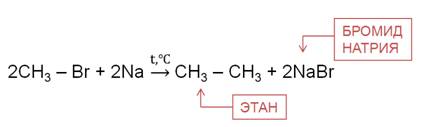
Реакция Вюрца используется для увеличения углеводородной цепи.
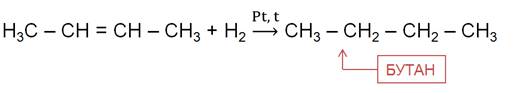
Алканы также можно получить гидрированием ненасыщенных углеводородов.
Алканы имеют широкое применение. Бутан используется для получения бутадиена-1,3, необходимого в производстве синтетического каучука. Метан используется для получения синтез-газа, метанола, ацетилена, как топливо, горючее для двигателей внутреннего сгорания, для получения растворителей.
Таким образом, при облучении светом или при высоких температурах алканы вступают в реакции окисления и замещения. Алканы в промышленности получают из нефти, а в лаборатории реакциями гидрирования ненасыщенных углеводородов, нагреванием солей карбоновых кислот со щелочами, реакцией Вюрца.
Источник