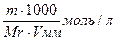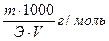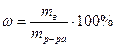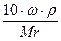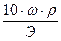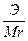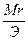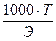Способы приготовления титрованных растворов.
Существуют три способа приготовления титрованных или стандартизированных растворов.
1. Растворением точно взвешенного количества вещества и разбавлением его до известного объёма. Для этого на аналитических весах берут точную навеску вещества, растворяют ее в мерной колбе и доводят объем раствора водой до метки. Зная массу растворенного вещества (Т) и объем полученного раствора (V), нетрудно вычислить его титр:
Титрованные растворы, полученные таким образом, называются растворами с приготовленным титром или первичными стандартами.
Первичные стандарты применяют в титриметрии для количественного определения тех или иных веществ и для установления концентрации стандартного (рабочего) раствора.
Однако такой метод приготовления растворов пригоден лишь тогда, когда вещество отвечает ряду требований.
Требования к первичным стандартам:
1) вещество должно быть химически чистым;
2) состав вещества должен точно соответствовать формуле;
3) вещество должно быть хорошо растворимым в воде;
4) вещество должно быть устойчивым при хранении и в твердом виде или растворе;
5) оно не должно содержать гидратную воду: гигроскопическое или склонное к выветриванию вещество трудно высушить и взвесить;
6) желательна возможно большая величина грамм-эквивалента вещества, что позволяет увеличить точность установления нормальности раствора. Поскольку при увеличении массы относительная ошибка взвешивания уменьшается, высокая эквивалентная масса способствует уменьшению ошибок взвешивания;
7) вещество должно быстро и до конца реагировать с другими веществами. Пользуясь первичными стандартными растворами, устанавливают титр остальных веществ. К первичным стандартам
относятся, например, NaСl, Nа2СОз, Na2B407•10Н2О, K2Cr207, Н2С2О4•2Н2О, КВгОз и другие.
2. Титрованием раствора, содержащего взвешенное количество соединения, раствором реагента точной концентрации. Если
вещество не удовлетворяет перечисленным выше требованиям, то сначала готовят раствор его приблизительно нужной нормальности. Параллельно с этим готовят раствор первичного стандарта.
Далее один из растворов оттитровывают другим и, зная концентрацию стандарта, вычисляют точную концентрацию приготовленного раствора. Титрованные растворы, концентрацию которых находят в результате титрования, называются вторичными стандартными растворами или
растворами с установленным титром; иногда их называют «рабочими» растворами. Процесс определения концентрации стандартного раствора титрованием первичным стандартом называется стандартизацией.
3. Для получения титрованных р-ров на практике часто пользуются «фиксаналами» или стандарт-титрами.
Методы приготовления титрованных растворов:
1) растворы с приготовленным титрантом: навеска на аналитических весах в мерной колбе,
2) с установленным титром: готовят раствор с приблизительной концентрацией, а точно устанавливают титрованием,
3) из фиксаналов: титр рабочего раствора устанавливают через каждые 1-3 недели.
Титр рабочих растворов нужно устанавливать в таких же условиях, как и проводить титрование.
5. Расчёты в титриметрическом анализе.
Методы расчёта в количественном анализе основаны на законе эквивалентов:
Все вещества реагируют между собой в эквивалентных соотношениях.
Молярная концентрация(молярность раствора) — это содержание моль вещества в одном литре раствора.
См=
См= 
0,1 м 0,1 — децимолярная
См=0,1 М 0,001 — сантимолярная
Сн (нормальность) — N =
Эсоли= 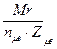
Титр — Т — количество грамм вещества в одном мл раствора:
Т = 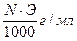
Тх/у= 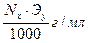
ТНСl=
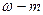
См=
N=
Cм= N
N=Cм
Т= 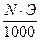
Источник
Способы приготовления титрованных растворов для
МЕТОДЫ ПРИГОТОВЛЕНИЯ ТИТРОВАННЫХ РАСТВОРОВ ДЛЯ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Reagents. Methods of preparation of standard volumetric solutions for acid-base titration
Дата введения 1984-07-01
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности СССР
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 23.05.83 N 2302
3. Стандарт соответствует СТ СЭВ 3674-82
4. ВВЕДЕН ВПЕРВЫЕ
5. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка
Номер пункта, приложения
1.4, 2.1.1, 2.2.1, приложение 2
2.1.1, 2.2.1, приложение 2
6. Ограничение срока действия снято по протоколу N 7-95 Межгосударственного совета по стандартизации, метрологии и сертификации (ИУС 11-95)
7. ИЗДАНИЕ (май 2008 г.) с Изменением N 1, утвержденным в декабре 1990 г. (ИУС 3-91)
Настоящий стандарт распространяется на реактивы и устанавливает методы приготовления следующих титрованных растворов для кислотно-основного титрования и проверки их молярных концентраций:
кислота серная, растворы молярных концентраций:



кислота соляная, растворы молярных концентраций:



натрия гидроокись, растворы молярных концентраций:



1. ОБЩИЕ УКАЗАНИЯ
1.1. Титрованные растворы предназначены для титриметрических определений и содержат в определенном объеме точно известные количества активного вещества.
За основу расчетов при приготовлении и проверке титрованных растворов взято понятие «молярная масса эквивалента». Числовое значение молярной массы эквивалента равно числовому значению ранее применявшегося грамм-эквивалента.
1.2. При приготовлении титрованных растворов должны соблюдаться требования ГОСТ 27025.
При взвешивании применяют лабораторные весы общего назначения типов ВЛР-200 г и ВЛКТ-500 г-М или ВЛЭ-200 г.
Допускается применять другие средства измерения с метрологическими характеристиками и оборудование с техническими характеристиками не хуже, а также реактивы по качеству не ниже указанных.
(Измененная редакция, Изм. N 1).
1.3. Растворы индикаторов готовят по ГОСТ 4919.1. Вспомогательные реактивы и растворы — по ГОСТ 4517.
1.4. Для приготовления растворов гидроокисей используют дистиллированную воду, не содержащую углекислоты, приготовленную по ГОСТ 4517. Для приготовления других растворов и при титровании используют дистиллированную воду по ГОСТ 6709.
1.5. Для приготовления титрованных растворов используют твердые вещества, взвешивая их (результат взвешивания в граммах записывают с точностью до второго десятичного знака), и концентрированные растворы веществ, отмеряя их пипеткой (ГОСТ 29227) или бюреткой (ГОСТ 29251) с ценой деления 0,1 см . Допускается готовить титрованные растворы, используя стандарт-титры (фиксаналы) в ампулах.
При приготовлении больших объемов титрованных растворов твердые вещества взвешивают на весах ВЛКТ-1000 и концентрированные растворы отмеряют цилиндром.
1.4; 1.5. (Измененная редакция, Изм. N 1).
1.6. Приготовленные титрованные растворы тщательно перемешивают.
1.7. Определение точной молярной концентрации вещества в растворе
1.7.1. Точную молярную концентрацию , моль/дм , с коэффициентом поправки вычисляют по формуле

где — заданная молярная концентрация вещества в растворе, моль/дм ;
1.7.2. Точную молярную концентрацию , моль/дм , без коэффициента поправки вычисляют по формуле

где — масса навески установочного вещества, г;
— молярная масса эквивалента установочного вещества, г/моль;
— объем анализируемого раствора, израсходованный на титрование, см .
Точная молярная концентрация вещества в растворе выражается четырьмя значащими цифрами после запятой.
1.8. Определение коэффициента поправки
Коэффициент поправки ( ) определяют по установочным веществам или их растворам.
1.8.1. При применении установочного вещества коэффициент поправки вычисляют по формуле

Источник
Титриметрия. Посуда, титрованные растворы, способы и методы
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
ТИТРИМЕТРИЯ
- 3.1. Основные понятия титриметрии
- 3.2. Химическая лабораторная посуда и ее назначение
- 3.3. Приготовление титрованных растворов
- 3.4. Основные способы и методы титрования
- 3.5. Кислотно-основное титрование
- 3.5.1. Основные понятия кислотно-основного титрования
- 3.5.2. Индикаторы метода кислотно-основного титрования. Теории индикаторов
- 3.5.3. Техника титрования
- 3.6. Оксидиметрия
- 3.6.1. Основные понятия методов оксидиметрии
- 3.6.2. Перманганатометрия
- 3.6.3. Йодометрия
- 3.6.4. Хроматометрия
- 3.7. Комплексонометрия
- 3.8. Осадительное титрование
- 3.9. Методы разделения и концентрирования
Основные понятия титриметрии
Титриметрический анализ основан на точном измерении реактива, израсходованного на реакцию с определяемым веществом. Раньше этот вид анализа называли объемным, так как в расчетах используют объем раствора, пошедшего на реакцию. Титриметрия отличается от гравиметрии малой трудоемкостью, простотой аппаратурного оформления. Титриметрический анализ в отношении скорости выполнения дает огромное преимущество по сравнению с гравиметрическим, являющимся, однако, наиболее точным химическим методом анализа.
Титриметрия возникла в середине XVIII века. Многие ученые внесли вклад в ее развитие. У. Льюис (1767) дал определение понятия «точки насыщения», т. е. точки эквивалентности. Благодаря работам Ж. Гей-Люссака титриметрия превратилась из метода анализа в самостоятельный раздел науки. Э. Мор разработал много методик по данному виду анализа, написал учебник по химико-аналитическому методу титрования (1856); В. Оствальд и А. Ганч развили теорию индикаторов (1894).
Титриметрия широко применяется в настоящее время для научных исследований и при контроле технологических процессов.
Титрованный раствор — раствор, титр которого точно известен. От слова «титр» в титриметрическом анализе происходит ряд терминов, например «титрование». Титр — число граммов или миллиграммов растворенного вещества, содержащееся в 1 мл раствора. Например, выражение «титр H2S04 равен 0,0049 г/мл» означает, что каждый миллилитр данного раствора серной кислоты содержит 0,0049 г H2SO4 . Титр обозначается буквой Т с указанием формулы соответствующего вещества. В данном случае; T H2SO4 = 0,0049 г/мл.
Титруемое вещество — вещество, количество которого определяется непосредственно в процессе титрования.
Титрант — вещество, вступающее в реакцию с титруемым веществом. Концентрация стандартного раствора титранта должна быть определена перед началом анализа с точностью не менее трех значащих цифр после запятой.
Аликвота — объем раствора, точно отмеренный при помощи калиброванной пипетки.
Титрование — прибавление титрованного раствора к анализируемому с целью определения точно эквивалентного его количества. Отсюда ясно, что при титровании необходимо достаточно точно установить момент наступления эквивалентности или, как говорят, фиксировать точку эквивалентности.
Реакция, используемая в титриметрическом анализе, должна протекать количественно, т. е. должны выполняться следующие условия:
- ● константа равновесия должна быть достаточно велика;
- ● реакция должна протекать с большой скоростью;
- ● реакция не должна осложняться побочными реакциями;
- ● должен быть способ определения точки эквивалентности.
Если не выполняется хотя бы одно условие, то метод титриметрии непригоден. Для этого метода необходимо:
- 1) использовать мерную посуду для точного определения объемов растворов;
- 2) использовать титрованный или стандартный раствор;
- 3) подобрать способ фиксации точки эквивалентности.
В титриметрии концентрации растворов веществ выражают в молях эквивалентов вещества в одном кубическом дециметре или в одном литре раствора. Нормальная концентрация, используемая в аналитической химии, учитывает то, что эквиваленты веществ для разных реакций различаются, поэтому следует указывать (в скобках) фактор эквивалентности. Например, 0,1н КМnО4 (f экв = 1/5).
Молярная масса эквивалента имеет размерность г×моль –1 . Молярная масса эквивалента равна молярной массе вещества, умноженной на fэкв. Молярная масса вещества численно равна сумме относительных молярных масс атомов, входящих в его состав.
В полуреакции восстановления участвуют 5 электронов, следовательно, f экв (КМnО4) = 1/5, а эквивалент перманганата калия равен 1/5 молярной массы КМnО4.
Химическая лабораторная посуда и ее назначение
Для точного определения объемов используются бюретки, пипетки и мерные колбы (рис. 3.1).
Рис. 3.1. Мерная посуда а — цилиндры; б — мерные колбы; в — химический стакан; г — бюретки с краном; д — пипетка Мора
Бюретка — цилиндрическая трубка с суженым концом, к которому с помощью резинового шланга присоединена стеклянная трубка с оттянутым кончиком. На резиновый шланг надет зажим, либо вставлен в него стеклянный шарик. Если для титрования применяют агрессивные для резины растворы, то используют полностью стеклянную бюретку (пермангонатометрия). Бюретка градуиронана на миллилитры и десятые их доли. В титриметрии используют бюретки объемами 10, 25 и 50 мл. Заполненная раствором бюретка имеет вогнутую поверхность (мениск). По правилам показания по бюретке берут по нижнему краю мениска; глаз должен находиться на уровне этого нижнего края (рис. 3.2).
Рис. 3.2. Правила определения результатов исследований
Показания по бюретке могут быть с существенными погрешностями. Такие погрешности являются источником ошибок в объемном анализе.
Бюретка должна быть тщательно промыта и обезжирена (хромовой смесью — смесь концентрированной серной кислоты и бихромата калия или смесью раствора перманганата калия со щелочью). Затем бюретку многократно промывают водопроводной водой, 2−3 раза — дистиллированной водой и 2−3 раза — небольшими порциями раствора, которым заполняют бюретку для анализа. Затем заполняют бюретку раствором для титрования через воронку. При промывании бюретки нельзя затыкать ее сверху пальцами, так как пальцы никогда не бывают химически чистыми.
Пипетка используется для измерения точного объема раствора для метода титриметрии. Это стеклянная длинная узкая трубка с расширением или без него в середине. В верхней узкой части пипетки имеется черта, до которой и нужно заполнять пипетку раствором 5, 10, 20, 25, 50, 100 мл. На пипетке указана ее вместимость и температура, при которой градуирована пипетка. При необходимости используют измерительные пипетки (с градуировкой). Такие пипетки особенно необходимы для работы с небольшими объемами растворов (до 5 мл).
Пипетку моют так же, как и бюретку. Заполняют пипетку с использованием груши или специального приспособления. Можно использовать микродозатор для небольших объемов растворов. Однако показания микродозатора нужно время от времени сверять с показаниями стеклянной пипетки. Мерная стеклянная колба (рис. 3.3) — это сосуд с длинным горлом, на котором черта указывает объем раствора в колбе (50 ,100, 500, 1000 мл).
Рис. 3.3. Мерные стеклянные колбы
Используют мерные колбы для приготовления титрованных, стандартных растворов, а также для их разбавления. Моют колбы так же, как пипетки и бюретки, но не споласкивают рабочим раствором. Вначале раствор заливают через воронку в колбу, а затем доводят объем до черты прикапыванием воды из пипетки. Правило заполнения — по нижнему мениску.
Калибровка объемов мерной посуды идет при температуре 20–25 о С, точное значение температуры приготовления растворов указано на ней.
Приготовление титрованных растворов
Большая разница значений температур, при которых идет приготовление растворов, недопустима. Есть вещества, которые можно растворить только в горячей воде. Например, бура Na2B4O7 ∙10H2O. Растворение ее ведут в горячей воде, в половине объема, затем охлаждают до комнатной температуры и доводят объем водой до метки.
Существуют два способа приготовления титрованных растворов.
Первый способ — по точной массе. Берут навеску вещества, взвешивают на аналитических весах, растворяют в мерной колбе, считают титр раствора T = m V, гсм 3 . При этом:
- — вещество должно быть химически чистым;
- — состав должен строго соответствовать формуле;
- — вещество должно быть устойчивым в твердом и растворенном состояниях.
Вещество, удовлетворяющее указанным требованиям, называется первичным стандартом.
Второй способ — с установленным веществом. Если вещество не удовлетворяет требованиям, указанным выше, то используют установочные вещества. Например, для установления точной концентрации раствора NaOH используют в качестве установочного вещества щавелевую кислоту Na2C2O4 ∙2H2O, для соляной кислоты — буру Na2B4O7 ∙10H2O. Очень удобно использовать фиксаналы, выпускаемые промышленностью.
Фиксанал — запаянные ампулы с веществом для приготовления, как правило, 1 л раствора концентрации 0,1 н.
Основные способы и методы титрования
1. Способ прямого титрования. Определяемое вещество непосредственно реагирует с титрантом. Например, для определения концентрации кислоты ее титруют щелочью.
2. Способ обратного титрования (или титрование по остатку). Для этого способа необходимы два рабочих раствора, в раствор определяемого вещества вносят избыток основного рабочего раствора, а остаток оттитровывают вспомогательным рабочим раствором.
Например, в кислый раствор хлорида добавляют
AgNO 3 Ag + + Cl – = AgCl.
Затем избыток серебра оттитровывают роданидом Ag+ + CSN – = AgCSN.
3. Титрование по замещению, или косвенное титрование. К определяемому веществу (например, Cu +2) добавляют специальный реагент (I −) для проведения реакции, образовавшийся йод оттитровывают тиосульфатом натрия. Конец реакции определяют по крахмальному индикатору (исчезновение синей окраски).
Титрование проводят по следующим правилам:
- — титрование раствора проводят медленно;
- — каждое титрование начинают при полном заполнении бюретки;
- — на титрование должно идти 10–20 мл раствора;
- — измерения объемов идет до 0,03 мл, второй знак после запятой оценивается на глаз.
Различают методы титриметрического анализа по типу основной реакции, протекающей при титровании. Выделяют следующие методы титриметрического анализа кислотно-основное взаимодействие, реакция нейтрализации; окисление-восстановление (оксидиметрия); комплексообразование; осаждение.
Расчеты в титриметрии основаны на законе эквивалентов. Вещества реагируют между собой в эквивалентных количествах. Поэтому наиболее удобный способ выражения концентрации — нормальная концентрация. Объемы [V(A) и V(B)] и нормальные концентрации реагирующих веществ [СN(А) и CN(В)] в точке эквивалентности выражается соотношением
СN(А) и V(A) известны, а V(B) был определен после титрования раствором (А). Тогда:
Масса вещества m(B), содержащего в объеме V(B), находится по формуле:
Методы разделения и концентрирования
Процесс разделения состоит в выделении компонентов, составляющих исходную смесь. Процесс концентрирования состоит в увеличении концентрации микрокомпонентов в пробе анализируемого вещества. Концентрирование является частным случаем разделения. Эти методы чрезвычайно многочисленны и разнообразны. Методы разделения гомогенных и гетерогенных систем отличаются друг от друга по своей сущности.
Система — совокупность находящихся во взаимодействии веществ, обособленных мысленно или фактически.
Компонент — составная часть системы.
Фаза — однородная часть системы, отделенная от других частей поверхностью раздела. Гомогенная система состоит из одной фазы (например, истинный раствор). Гетерогенная система состоит из двух и более фаз (например, вода + лед, раствор + осадок).
Разделение гетерогенных систем происходит следующими методами:
- Фильтрация — движение через пористую перегородку жидкости или газа, часто сопровождающееся отложением или осаждением на ней взвешенных твердых частей.
- Центрифугирование — разделение в поле центробежных сил, возникающих при вращении ротора центрифуги.
- Флотация — выделение из суспензий и разделение твердых частиц, основанное на различии в их смачиваемости.
- Седиментация — разделение дисперсных систем под действием силы тяжести с отделением взвешенной фазы в виде осадка или «сливок».
Для разделения гомогенных систем используют следующие методы:
- Осаждение — необходимый компонент выделяется в осадок при протекании химической реакции.
- Испарение — метод построен на различии давления пара компонентов смеси при данной температуре (дистилляция, сублимация, возгонка, ректификация, отгонка).
- Сорбционные методы — основаны на различном поглощении газов, паров или растворенных веществ жидкими или твердыми поглотителями (сорбентами).
- Экстракционные методы — выделение, разделение и концентрирование веществ, заключающиеся в разделении компонентов между двумя несмешивающимися фазами.
Источник