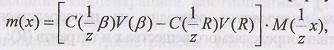Способы приготовления растворов с точно известной концентрацией -титрантов
Существуют следующие способы приготовления растворов с точно известной концентрацией:
1) растворение точно взвешенной массы чистого реагента и разбавление до точно известного объема;
2) приготовление раствора приблизительной концентрации и установление его точной концентрации с помощью первичного стандартного вещества;
3) метод фиксаналов.
Фиксаналы представляют собой запаянные стеклянные ампулы, содержащие определенную массу вещества. Для приготовления титранта ампулу фиксанала разбивают над специальной воронкой с пробивным устройством и содержимое ее смывают растворителем (водой) в мерную колбу объемом 1 литр. Полученный раствор затем разбавляют растворителем до метки. Концентрация полученного раствора указывается на .ампуле.
При использовании первых двух вариантов приготовления титрантов требуется химическое соединение высокой степени чистоты, называемое первичным стандартом. Вещество, которое может рассматриваться как хороший первичный стандарт, должно удовлетворять ряду важнейших требований:
1) быть химически чистым (содержание примесей не должно превышать 0,05 %);
2) быть устойчивым и сохраняться без изменений как на воздухе, так и в растворе (т.е. вещество не должно быть гигроскопичным, окисляться, взаимодействовать с диоксидом углерода, терять кристаллическую воду);
3) быть легкодоступным;
4) иметь достаточно высокую эквивалентную массу (масса вещества, требующегося для определения, тем больше, чем выше молярная масса эквивалента).
Концентрации стандартных растворов (С) выражают в моль/л (М), в моль/л эквивалента вещества (н.), в г/мл (титр ТА).
В методах кислотно-основного титрования и окисления-восстановления удобнее выражать концентрацию стандартных растворов в моль/л эквивалента. Нормальный раствор вещества А — раствор, в 1 л которого содержится количество вещества, равное молярной массе его эквивалента,
соответственно п — нормальный раствор содержит пМ.зка г вещества.

число г вещества В, соответствующее 1 мл раствора титранта А.
Следующие соотношения связывают различные способы выражения концентраций раствора
Расчет навески а при приготовлении V мл раствора стандартного вещества А заданной концентрации СА или НА проводится по формуле
 |
Эти же формулы позволяют рассчитать концентрации стандартных растворов, приготовленных по точной навеске вещества А (а), растворенной в V мд воды.
При определении концентрации раствора А(НА) по результатам титрования стандартного вещества В вычисление производится по формуле
 |
b — навеска стандартного вещества В, Vа количество раствора А, израсходованное на титрование, мл.
Если для определения концентрации раствора А используется стандартный раствор вещества В, концентрация которого равна нв, а на титрование VA мл раствора А расходуется VB мл раствора В, то нА рассчитывается из соотношения
Произведение HV представляет собой число миллимолей эквивалента.
Расчеты в титриметрическом анализе
Титриметрический анализ основан на принципе эквивалентности, согласно которому вещества вступают в реакции друг с другом в эквивалентных количествах, т.е.


Основные расчетные формулы в титриметрии
Так как количество эквивалентов связано с нормальной концентрацией соотношением то из уравнения принципа эквивалентности можно получить уравнение, называемое основным соотношением титриметрического анализа:
где С( 1/z х) — нормальная концентрация определяемого раствора (концентрация, которую необходимо определить); V(x) объем анализируемого раствора
(известная величина); С(1/z R)- нормальная концентрация титранта (известная величина); V(R) — объем титранта (измеряемая величина).
Следовательно
Формула для расчета массы анализируемого вещества:

Приемы титрования
Прямое титрованиеосновано на непосредственном взаимодействии определяемого вещества х и титранта (R):
Массу анализируемого вещества находят по формуле
Если титруется часть раствора, то расчет массы вещества ведут по формуле:
где Vk — объем мерной колбы; VA — объем аликвоты (пипетки).
Титрование по остатку (обратное титрование) проводят, когда невозможно прямое титрование. В этом случае к определяемому веществу добавляют вспомогательный реагент β, взятый в избытке:
Остаток непрореагировавшего вспомогательного реагента оттитровывают стандартным раствором титранта:
В момент эквивалентности все количество вспомогательного реагента р затрачено на реакции с определенным веществом хи титрантом R:
Расчет массы анализируемого веществапроизводят по формуле
где 
Когда точная концентрация вспомогательного реагента неизвестна, проводят дополнительное титрование, устанавливая соотношение между вспомогательным реагентом, взятым в том же объеме, что и при определении анализируемого образца, и титрантом:
В этом случае, учитывая соотношение

где V 1 (R) — объем титранта, пошедший на титрование вспомогательного реагента в отсутствие анализируемого вещества.
Титрование заместителяприменяют, когда нет подходящей реакции или индикатора для прямого титрования. В этом случае к определяемому веществу хдобавляют вспомогательный реагент β, с которым определяемое вещество образует стехиометрическое количество нового соединения, называемого заместителем у. Вспомогательный реагент выбирают с таким расчетом, чтобы получаемый заместитель было удобно определять прямым титрованием:
Так как 
Источник
Способы приготовления растворов
Содержание
Существует несколько способов приготовления растворов. По способу приготовления различают первичные и вторичные стандартные растворы.
Приготовление раствора по точной навеске
По точной навеске готовят первичные стандартные растворы, растворы стандартных установочных веществ, которые должны удовлетворять следующим требованиям:
а) состав их должен строго соответствовать химической формуле;
б) вещества должны быть устойчивыми при хранении в растворе и в сухом виде (не окисляться, не поглощать диоксид углерода, воду, не терять кристаллизационную воду);
в) величина молярной массы эквивалента должна быть по возможности наибольшей для уменьшения погрешности взвешивания и титрования.
При приготовлении растворов по точной навеске задаются концентрацией раствора и его объемом.
Основные этапы работы:
- рассчитывают необходимую навеску для взвешивания с точностью до 0,0001 г;
- взвешивают точную навеску на аналитических весах;
- взвешенную навеску количественно переносят в мерную колбу вместимостью, равной Vр-ра, растворяют вещество, доводят до метки дистиллированной водой и перемешивают;
- если взятая навеска отличается от теоретически рассчитанной, то концентрацию раствора пересчитывают.
Приготовление раствора по приблизительной навеске
По приблизительной навеске готовят растворы нестандартных веществ или растворы приблизительной концентрации. Этапы работы такие же, как и при приготовлении растворов по точной навеске, но навеску рассчитывают с точностью не более, чем до 0,01 г и берут ее на технических весах. Точную концентрацию такого раствора устанавливают титрованием (часто растворами первичных стандартов) и рассчитывают по закону эквивалентов:
Приготовленные таким образом растворы с точно установленной концентрацией называются вторичными стандартами или титрованными.
Приготовление раствора из фиксанала
Из фиксанала (норма-дозы, стандарт-титра) готовят первичные стандартные растворы точной концентрации. Фиксанал – стеклянная ампула, в которой содержится точно известное количество вещества (nэкв) в кристаллическом виде или в виде раствора. Содержимое фиксанала количественно переносят в мерную колбу, доводят уровень раствора до метки, раствор перемешивают. Концентрация раствора должна быть задана, а вместимость мерной колбы рассчитывают, используя формулу:
Приготовление раствора разбавлением концентрированного раствора
Разбавлением концентрированных растворов готовят растворы многих веществ. В этом случае должны быть заданы объем разбавленного раствора, его концентрация и концентрация концентрированного раствора. Рассчитывают необходимый для разбавления объем концентрированного раствора, затем измеряют рассчитанный объем, переносят в мерную колбу или в мерный стакан, доводят уровень жидкости до метки дистиллированной водой и перемешивают. Если исходный раствор имел точную концентрацию и при его разбавлении использовали точную мерную посуду, то получают раствор точной концентрации. В противном случае получают раствор приблизительной концентрации.
Все расчеты ведут с точностью не более чем до 0,01. Точную концентрацию устанавливают титрованием.
Установка титра
Установка титра – одна из важных операций лабораторной техники. От правильности приготовления титрованного раствора зависит и результат анализа. Так как каждый анализ почти всегда сопровождается титрованием, каждый работник лаборатории должен хорошо освоить технику проведения этой операции. Нужно помнить несколько правил, относящихся к титрованным растворам.
1. Титрованные растворы должны быть по возможности свежими. Длительное хранение их не должно допускаться. Для каждого раствора есть свой предельный срок хранения.
2. Титрованные растворы при стоянии изменяют свой титр, поэтому их следует иногда проверять. Если же делают особенно ответственный анализ, проверка титра раствора обязательна.
3. При приготовлении растворов марганцовокислого калия титр их следует устанавливать не ранее, чем через 3—4 дня после приготовления. То же относится ко всём другим растворам, способным изменяться со временем или при соприкосновении с воздухом, стеклом и пр.
4. Титрованные растворы щелочей лучше хранить в бутылях, покрытых внутри парафином, а также защищать их от действия двуокиси углерода воздуха (хлоркальциевая трубка с натронной известью или аскаритом).
5. Все бутыли с титрованными растворами должны иметь четкую надпись с указанием вещества, нормальности, поправки, времени изготовления раствора и даты проверки титра.
Во время титрования колбу нужно держать левой рукой, а правой рукой управлять краном бюретки, давая стекать жидкости равномерно. При титровании очень большое значение имеет скорость, поэтому, при повторном титровании одного и того же раствора, нужно, чтобы скорость добавления раствора из бюретки была по возможности одинаковой, т. е. в одно и то же время вытекало бы определенное количество жидкости. Для перемешивания титруемого раствора очень удобно применять магнитные мешалки. В этом случае титрование можно вести как в обычной конической колбе, так и в специальных, приспособленных для титрования темноокрашенных жидкостей.
Общие рекомендации
Подведем итог сказанному о приготовлении растворов.
1. Все водные растворы следует готовить только на дистиллированной воде. При приготовлении водных растворов солей заданной концентрации нужно учитывать также кристаллизационную воду.
2. Приготовляя точные растворы, нельзя наливать в мерную колбу сразу все нужное количество воды.
3. Мерные колбы калиброваны на определенный объем лишь при температуре, указанной на колбе. Поэтому точный объем жидкости можно получить только при стандартной температуре.
4. Так как приготовить растворы точно заданной концентрации трудно, то, прежде чем пользоваться раствором, надо установить его концентрацию или поправку на нормальность.
5. Необходимо наклеивать этикетки (или делать надпись специальным карандашом) на сосудах с растворами.
6. Все растворы следует готовить только в хорошо вымытой посуде. Надо заботиться о том, чтобы приготовленные растворы не загрязнялись каким-либо образом. Нельзя путать пробки от посуды, содержащей растворы разных веществ.
7. Растворы, которые могут портиться от действия света, такие, как марганцовокислый калий, азотнокислое серебро и др., нужно хранить только в темных склянках. Для некоторых веществ можно употреблять желтые склянки, для других же сосуды необходимо оклеивать черной бумагой, но не покрывать стекло черным лаком: лаковая пленка всегда немного пропускает свет. Если черной бумаги нет, бутыль или другой сосуд следует оклеить плотной бумагой и бумагу покрыть черным лаком.
8. Растворы щелочей нужно хранить так, чтобы на них не действовала двуокись углерода. Для этого в пробку вставляют хлоркальциевую трубку, наполненную натронной известью или другим твердым поглотителем двуокиси углерода.
9. Растворы щелочей следует готовить вначале очень концентрированными и разбавлять их до нужной концентрации только после отстаивания и фильтрования.
10. Надо быть осторожным с растворами, которые могут вредно действовать на кожу рук, одежду или обувь.
11. Все растворы нужно проверять. Точные растворы – путем установки титра, приблизительные – по плотности или иным путем.
12. Растворы (за исключением точных) после приготовления следует обязательно профильтровывать. Это относится одинаково и к водным растворам, и к растворам в органических жидкостях.
13. При приготовлении растворов в органических жидкостях надо применять только чистые растворители и, когда нужно, – безводные. Если растворитель чем-либо загрязнен, его следует перегнать или очистить от примесей каким-либо другим способом.
Источник