Способы приготовления первичных стандартных растворов
1. Из кристаллического стандартного вещества (установочного вещества, исходного вещества, первичного стандарта). Взвешивают на аналитических весах точную навеску стандартного вещества, переносят в мерную колбу, растворяют в дистиллированной воде, затем доводят до метки (рис. 8).
Рис. 8. Приготовление первичного стандартного раствора
из кристаллического стандартного вещества
Ориентировочную массу навески вещества для приготовления раствора рассчитывают по формуле
После взятия навески и ее растворения в мерной колбе рассчитывают точную концентрацию приготовленного раствора по формуле
Например, надо приготовить 100 мл 0,1 н. Na2B4O7 (fэкв = 1/2) из кристаллического препарата Na2B4O7∙10Н2О. Рассчитали ориентировочную массу навески:
Затем провели взятие навески на аналитических весах:
перенесли ее в мерную колбу вместимостью 100,0 мл, растворили и довели дистиллированной водой до метки. Рассчитаем точную концентрацию полученного первичного стандартного раствора:
Кристаллическое вещество для приготовления первичного стандартного раствора должно соответствовать ряду требований (см. дальше). Если взять вещество, удовлетворяющее этим требованиям, взвесить его на аналитических весах и растворить в мерной колбе, то получится первичный стандартный раствор.
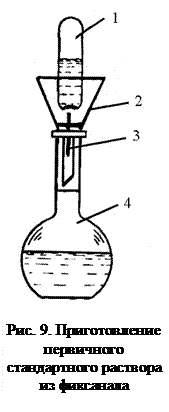
2. Из фиксанала (стандарт-титра). Фиксанал – это точно отвешенная масса твердого вещества квалификации «х. ч.», или точно отмеренный объем его раствора, помещенные в запаянные стеклянные ампулы. Содержимое ампулы 1 переносят через воронку 2 в мерную колбу 4, разбивая бойком 3, разбавляют до метки и получают раствор с точно известной концентрацией (рис. 9). Применение фиксаналов значительно сокращает время на приготовление стандартных растворов.
Поскольку чаще всего в ампуле содержится 0,1 моль-экв вещества, то концентрацию стандартного раствора, приготовленного из фиксанала в мерной колбе вместимостью V, находят по формуле
Вторичный стандартный растворготовят в два этапа.
1. Готовят раствор с примерно известной концентрацией из кристаллического вещества или из более концентрированного раствора, используя технические весы и мерную посуду с ориентировочными делениями (мерные цилиндры, стаканы с делениями).
2. Определяют его точную концентрацию (стандартизируют) путем титрования первичного стандартного раствора.
Например, рабочие растворы HCl и NaOH можно приготовить как вторичные стандарты путем разбавления более концентрированных растворов с последующей стандартизацией по первичным стандартным растворам тетрабората натрия Na2B4O7 ∙ 10H2O и щавелевой кислоты Н2С2O4 ×2H2O.
Концентрацию растворов установочных веществ задают близкой к концентрации рабочих растворов.
Источник
3.2.2. Приготовление стандартных растворов.
Различают первичные и вторичныестандартные растворы.Первичные стандартные растворыготовят:
растворением точной навески установочного вещества (марка х. ч или ч. д. а.), взятой на аналитических весах, в мерной колбе с последующим доведением объема раствора до метки. Ориентировочную массу навески вещества для приготовления раствора рассчитывают по формуле
m(X) = C (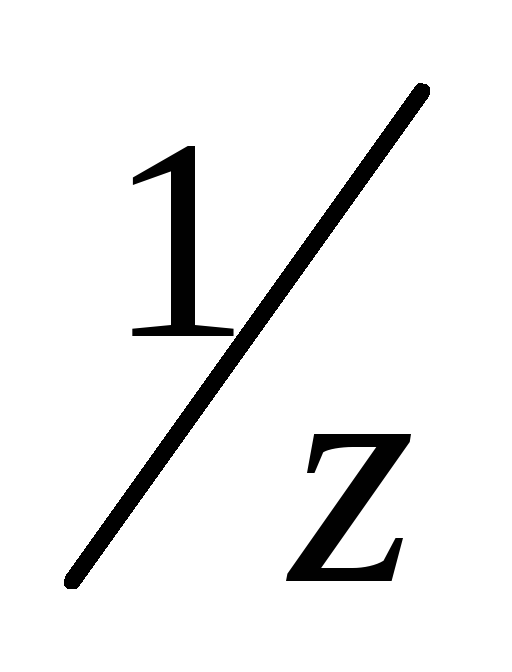

из «фиксанала» (стандарт-титра). «Фиксанал» представляет собой запаянную стеклянную ампулу, содержащую точную навеску стандартного твердого вещества (или определенный объем стандартного раствора), необходимую для приготовления 1 л точно 0,1000 н. раствора. Для приготовления стандартных растворов из «фиксанала» в горлышко мерной колбы вставляют воронку, в нее помещают стеклянный боек, на который устанавливают ампулу «фиксанала». Легким ударом ампулы о боек разбивают стекло и, пробив верхнее отверстие в ампуле другим бойком, переносят вещество в мерную колбу. Ампулу и воронку тщательно промывают дистиллированной водой, убирают воронку, доводят объем колбы до метки и перемешивают.
Вторичные стандартные растворыготовят приблизительной концентрации взвешиванием на технических весах кристаллических веществ с их последующим растворением или разбавлением более концентрированных растворов. При приготовлении вторичных стандартных растворов нет необходимости брать точную навеску вещества, так как при всей тщательности взятия навески нельзя получить раствор с известной концентрацией. Например, твердыйNaOHвсегда содержит неконтролируемое количествоNa2CO3иH2O, поэтому даже взвешивание на аналитических весах не позволяет получить раствор с точно известной концентрацией. Вещество взвешивают на технических весах, растворяют и разбавляют до определенного объема. Если используют концентрированные растворы для последующего разбавления, то необходимый объем отмеряют мерным цилиндром и разбавляют. Затем концентрацию приготовленного раствора уточняют по подходящему первичному стандартному раствору.
Способы приготовления первичных и вторичных стандартных растворов представлены на схеме:
Источник
Способы приготовления растворов
Содержание
Существует несколько способов приготовления растворов. По способу приготовления различают первичные и вторичные стандартные растворы.
Приготовление раствора по точной навеске
По точной навеске готовят первичные стандартные растворы, растворы стандартных установочных веществ, которые должны удовлетворять следующим требованиям:
а) состав их должен строго соответствовать химической формуле;
б) вещества должны быть устойчивыми при хранении в растворе и в сухом виде (не окисляться, не поглощать диоксид углерода, воду, не терять кристаллизационную воду);
в) величина молярной массы эквивалента должна быть по возможности наибольшей для уменьшения погрешности взвешивания и титрования.
При приготовлении растворов по точной навеске задаются концентрацией раствора и его объемом.
Основные этапы работы:
- рассчитывают необходимую навеску для взвешивания с точностью до 0,0001 г;
- взвешивают точную навеску на аналитических весах;
- взвешенную навеску количественно переносят в мерную колбу вместимостью, равной Vр-ра, растворяют вещество, доводят до метки дистиллированной водой и перемешивают;
- если взятая навеска отличается от теоретически рассчитанной, то концентрацию раствора пересчитывают.
Приготовление раствора по приблизительной навеске
По приблизительной навеске готовят растворы нестандартных веществ или растворы приблизительной концентрации. Этапы работы такие же, как и при приготовлении растворов по точной навеске, но навеску рассчитывают с точностью не более, чем до 0,01 г и берут ее на технических весах. Точную концентрацию такого раствора устанавливают титрованием (часто растворами первичных стандартов) и рассчитывают по закону эквивалентов:
Приготовленные таким образом растворы с точно установленной концентрацией называются вторичными стандартами или титрованными.
Приготовление раствора из фиксанала
Из фиксанала (норма-дозы, стандарт-титра) готовят первичные стандартные растворы точной концентрации. Фиксанал – стеклянная ампула, в которой содержится точно известное количество вещества (nэкв) в кристаллическом виде или в виде раствора. Содержимое фиксанала количественно переносят в мерную колбу, доводят уровень раствора до метки, раствор перемешивают. Концентрация раствора должна быть задана, а вместимость мерной колбы рассчитывают, используя формулу:
Приготовление раствора разбавлением концентрированного раствора
Разбавлением концентрированных растворов готовят растворы многих веществ. В этом случае должны быть заданы объем разбавленного раствора, его концентрация и концентрация концентрированного раствора. Рассчитывают необходимый для разбавления объем концентрированного раствора, затем измеряют рассчитанный объем, переносят в мерную колбу или в мерный стакан, доводят уровень жидкости до метки дистиллированной водой и перемешивают. Если исходный раствор имел точную концентрацию и при его разбавлении использовали точную мерную посуду, то получают раствор точной концентрации. В противном случае получают раствор приблизительной концентрации.
Все расчеты ведут с точностью не более чем до 0,01. Точную концентрацию устанавливают титрованием.
Установка титра
Установка титра – одна из важных операций лабораторной техники. От правильности приготовления титрованного раствора зависит и результат анализа. Так как каждый анализ почти всегда сопровождается титрованием, каждый работник лаборатории должен хорошо освоить технику проведения этой операции. Нужно помнить несколько правил, относящихся к титрованным растворам.
1. Титрованные растворы должны быть по возможности свежими. Длительное хранение их не должно допускаться. Для каждого раствора есть свой предельный срок хранения.
2. Титрованные растворы при стоянии изменяют свой титр, поэтому их следует иногда проверять. Если же делают особенно ответственный анализ, проверка титра раствора обязательна.
3. При приготовлении растворов марганцовокислого калия титр их следует устанавливать не ранее, чем через 3—4 дня после приготовления. То же относится ко всём другим растворам, способным изменяться со временем или при соприкосновении с воздухом, стеклом и пр.
4. Титрованные растворы щелочей лучше хранить в бутылях, покрытых внутри парафином, а также защищать их от действия двуокиси углерода воздуха (хлоркальциевая трубка с натронной известью или аскаритом).
5. Все бутыли с титрованными растворами должны иметь четкую надпись с указанием вещества, нормальности, поправки, времени изготовления раствора и даты проверки титра.
Во время титрования колбу нужно держать левой рукой, а правой рукой управлять краном бюретки, давая стекать жидкости равномерно. При титровании очень большое значение имеет скорость, поэтому, при повторном титровании одного и того же раствора, нужно, чтобы скорость добавления раствора из бюретки была по возможности одинаковой, т. е. в одно и то же время вытекало бы определенное количество жидкости. Для перемешивания титруемого раствора очень удобно применять магнитные мешалки. В этом случае титрование можно вести как в обычной конической колбе, так и в специальных, приспособленных для титрования темноокрашенных жидкостей.
Общие рекомендации
Подведем итог сказанному о приготовлении растворов.
1. Все водные растворы следует готовить только на дистиллированной воде. При приготовлении водных растворов солей заданной концентрации нужно учитывать также кристаллизационную воду.
2. Приготовляя точные растворы, нельзя наливать в мерную колбу сразу все нужное количество воды.
3. Мерные колбы калиброваны на определенный объем лишь при температуре, указанной на колбе. Поэтому точный объем жидкости можно получить только при стандартной температуре.
4. Так как приготовить растворы точно заданной концентрации трудно, то, прежде чем пользоваться раствором, надо установить его концентрацию или поправку на нормальность.
5. Необходимо наклеивать этикетки (или делать надпись специальным карандашом) на сосудах с растворами.
6. Все растворы следует готовить только в хорошо вымытой посуде. Надо заботиться о том, чтобы приготовленные растворы не загрязнялись каким-либо образом. Нельзя путать пробки от посуды, содержащей растворы разных веществ.
7. Растворы, которые могут портиться от действия света, такие, как марганцовокислый калий, азотнокислое серебро и др., нужно хранить только в темных склянках. Для некоторых веществ можно употреблять желтые склянки, для других же сосуды необходимо оклеивать черной бумагой, но не покрывать стекло черным лаком: лаковая пленка всегда немного пропускает свет. Если черной бумаги нет, бутыль или другой сосуд следует оклеить плотной бумагой и бумагу покрыть черным лаком.
8. Растворы щелочей нужно хранить так, чтобы на них не действовала двуокись углерода. Для этого в пробку вставляют хлоркальциевую трубку, наполненную натронной известью или другим твердым поглотителем двуокиси углерода.
9. Растворы щелочей следует готовить вначале очень концентрированными и разбавлять их до нужной концентрации только после отстаивания и фильтрования.
10. Надо быть осторожным с растворами, которые могут вредно действовать на кожу рук, одежду или обувь.
11. Все растворы нужно проверять. Точные растворы – путем установки титра, приблизительные – по плотности или иным путем.
12. Растворы (за исключением точных) после приготовления следует обязательно профильтровывать. Это относится одинаково и к водным растворам, и к растворам в органических жидкостях.
13. При приготовлении растворов в органических жидкостях надо применять только чистые растворители и, когда нужно, – безводные. Если растворитель чем-либо загрязнен, его следует перегнать или очистить от примесей каким-либо другим способом.
Источник
Способы приготовления стандартных растворов



Растворы с известной концентрацией, которые служат для определения концентрации других растворов, называются стандартными или рабочими. Это некоторые растворы кислот, щелочей, солей.
1. Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
Растворы точной навески можно приготовить лишь для немногих веществ. Эти вещества должны отвечать следующим требованиям:
— вещество должно быть чистым
— иметь постоянный состав
— быть устойчивым как на воздухе так и в растворе
— иметь достаточно высокую молекулярную массу.
Такие соединения называются установочными. К ним относятся: щавелевая кислота (Н2С2О4 · 2Н2О), тетраборат натрия (бура) (Na2B4O7 · 12H2O), дихромат калия (K2Cr2O7). Для веществ, неудовлетворяющих требованиям, растворы готовят методом неточной навески или разбавлением.
2. Метод неточной или приблизительной навески. Предполагает работу с растворами, которые не соответствуют этим требованиям, например, меняют свою массу на воздухе, например, перманганат калия. Перед применением их в качестве стандартных растворов, необходимо оттитровать другим раствором с точно известной концентрацией.
3. Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
4. Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал — ампула с сухим веществом или раствором с точно известной концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным.
1.5.Решение задач на приготовление растворов с массовой долей (%) концентрации.
Задача 1. Приготовить 500 г раствора С6Н12О6 с массовой долей равной 10% ?
m (р-ра С6Н12О6) = 500 г
__________________ формуле: m (в-ва) =
Найти: m (С6Н12О6) = ? m (С6Н12О6) =
2. Определяем массу воды согласно формуле:
m (р-ра) = m (р-ля) + m (вещ-ва), m (Н2О) = m (р-ра) – m (в-ва),
m (H2O) = 500 – 50 = 450 г.
Согласно формуле: 

Ответ: чтобы приготовить 500 г раствора глюкозы с массовой долей 10%, необходимо отвесить на весах 50 г глюкозы, отмерить любой мерной посудой 450 мл воды, поместить этот раствор в колбу и перемешать.
Задача 2. Приготовить 800 мл раствора NaCl с массовой долей равной 12% и плотностью равной 1,1 г/мл?
V (р-ра) = 800 мл
ρ = 1,1 г/мл 1. Определяем массу р-ра NaCl согласно
__________________ формуле: m (р-ра)= V ∙ ρ = 800 мл · 1,1г/мл = 880 г
2. Определяем массу NaCl согласно формуле: m (в-ва) =
m (NaCl) =
3. Определяем массу воды согласно формуле:
m (Н2О) = m (р-ра) – m (в-ва), ), m (Н2О) = 880 – 105,6 = 774,4 г или 774,4 мл, т.к. плотность воды равна 1 г/мл.
Ответ: для приготовления 800 мл раствора хлорида натрия с массовой долей равной 12 %, необходимо отвесить на весах 105,6 г NaCl, отмерить любой мерным цилиндром 774,4 мл воды, поместить раствор в колбу и перемешать.
Задача 3 Приготовить 100 г ра-ра MgSO4 c ω = 2 % из р-ра MgSO4 c ω = 10 % ?
ω1( MgSO4) = 10 %
ρ = 1,1 г/мл 1. Определяем массу чистого MgSO4
__________________ содержащегося в 100 г 2 % р-ра MgSO4
Найти: m 1 ( MgSO4) = ? m (в-ва) = 
m (H2O) = ? m (MgSO4) =
2. Определяем массу р-ра MgSO4 (исходного) с ω = 10 % содержащего 2 г чистого MgSO4 
3. Определяем объём исходного (первого) р-ра MgSO4 с ω = 10 %
Vр-ра = 
4. Определяем массу Н2О, которая необходима для разбавления исходного раствора MgSO4.
m (H2O) = 100 – 20 = 80 г или для чистой воды 80 мл.
Ответ: для приготовления 100 г раствора MgSO4 с массовой долей равной
2 % из раствора MgSO4 с массовой долей 10 % и ρ = 1,1 г/мл, необходимо отмерить из бюретки 18,2 мл 10 % р-ра MgSO4, поместить их в колбу, добавить туда цилиндром 80 мл воды и перемешать.
Источник