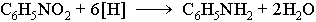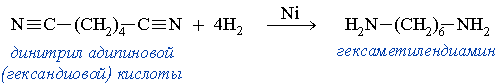- Способы получения вторичных аминов
- Способы получения вторичных аминов
- Амины
- Химия
- Строение аминов
- Классификация аминов
- Номенклатура аминов
- Изомерия аминов
- Способы получения аминов
- Реакции нитросоединений
- Алкилирование (взаимодействие с галогеналканами) аммиака
- Гидрирование нитрилов
- Физические свойства аминов
- Химические свойства аминов
- Основные свойства
- Окисление
- Реакция с азотистой кислотой
- Алкилирование аминов
- Анилин
- Основные свойства анилина
- Аминокислоты
- Применение аминов
- Вредное воздействие аминов
Способы получения вторичных аминов
Восстановление азотистых функций
Метод применим для синтеза первичных аминов как алифатических, так и ароматических. Однако наиболее важное значение он имеет для получения ароматических аминов, поскольку исходные нитроарены – легкодоступные вещества, которые синтезируют прямым нитрованием аренов (см. главу Электрофильное ароматическое замещение). В качестве восстановителей нитросоединений используют различные реагенты: H2/Pt,Pd,Ni; Sn/HCl; SnCl2/HCl; Fe/HCl; Fe/H2O и др. Применение в качестве восстановителя полисульфида натрия позволяет селективно восстановить одну нитрогруппу в полинитроаренах.
Восстановление нитрилов, амидов, азидов, оксимов, иминов. Все вышеназванные азотистые функции достаточно легко восстанавливаются до первичных аминов. Чаше всего восстановление проводят каталитическим гидрированием или с помощью комплексных гидридов металлов (борогидрид натрия или алюмогидрид лития).
Многие альдегиды и кетоны превращаются в амины при обработке аммиаком и водородом в присутствии никеля Ренея. Образующийся на первом этапе реакции имин далее восстанавливается в амин. Весь процесс проводят в одну стадию и называют «восстановительным аминированием».
Превращения производных кислот
Первичные амиды кислот при обработке бромом или хлором в присутствии щелочи превращаются в первичные амины, содержащие на один углеродный атом меньше, чем в исходной кислоте. Это превращение носит название расщепление амидов кислот по Гофману.
Гипогалогениты натрия, образующиеся из галогена и щелочи галогенируют амиды по NH2 группе. Получающийся N-галогенамид при действии избытка щелочи дает ацилнитрен, который перегруппировывается в изоцианат. Из него после присоединения воды образуется карбаминовая кислота, декарбоксилирование которой приводит к первичному амину.
Ацилазиды при нагревании отщепляют азот и углекислый газ и дают первичные амины (Курциус). Несмотря на то, что исходные вещества для перегруппировок Гофмана и Курциуса различны, механизмы этих превращений весьма похожи. Образующийся в обоих случаях неустойчивый ацилнитрен перегруппировывается в изоцианат, который далее гидролизуется и декарбоксилируется, давая амин.
Реакции нуклеофильного замещения
Реакция нуклеофильного замещения действием аммиака или первичных и вторичных аминов на алифатические субстраты протекает неоднозначно – образуется смесь первичных, вторичных и третичных аминов и солей тетраалкиламмония. Остановить процесс на стадии образования одного продукта не всегда удается. Несмотря на это реакция имеет промышленное применение.
Применяются способы получения ароматических аминов из арилгалогенидов и аммиака или аминов (см. главу Галогенарены).
В последние десятилетия все более широкое применение для синтеза труднодоступных ароматических аминов находит нуклеофильное замещение в арилгалогенидах, катализируемое солями переходных металлов.
Синтез Габриэля представляет собой способ получения первичных алифатических аминов исходя из фталимида калия, который алкилируют алкилгалогенидом, а образующийся N-алкилфталимид расщепляют гидразингидратом или гидролизуют.
Источник
Способы получения вторичных аминов
2.5. Получение аминов
В аминах атом азота находится в низшей степени окисления, поэтому многие способы их получения основаны на процессах восстановления азотсодержащих соединений других классов (нитропроизводных углеводородов, амидов, нитрилов).
- Наиболее общим методом получения первичных аминов является восстановление нитросоединений:

Важнейший ароматический амин — анилин — образуется при восстановлении нитробензола (восстановители — водород в присутствии металлических катализаторов, Fe + HCl, сульфиды):
Эта реакция носит имя русского химика Н.Н. Зинина, осуществившего ее впервые

R-C
Этим способом в промышленности получают гексаметилендиамин, который используется в производстве полиамидного волокна найлон.
В основе этих превращений лежит реакция нуклеофильного замещения галогена в галогеналканах. Роль нуклеофила играют молекулы аммиака и аминов, имеющие неподеленную пару электронов на атоме азота.
В промышленности алкилирование аммиака в большинстве случаев проводится не галогеналканами, а спиртами, в молекулах которых происходит нуклеофильное замещение ОН-группы на аминогруппу.
Действием галогеналканов на первичные алифатические и ароматические амины получают вторичные и третичные амины, в том числе, смешанные. 
Источник
Амины
Амины — органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная группой аминов является аминогруппа — NH2.
Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).
Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
Получение
- Нагревание галогеналканов с аммиаком
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.
Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна — нейлон.
В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
Химические свойства аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.
Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.
Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».
Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Химия
Лучшие условия по продуктам Тинькофф по этой ссылке
Дарим 500 ₽ на баланс сим-карты и 1000 ₽ при сохранении номера
. 500 руб. на счет при заказе сим-карты по этой ссылке
Лучшие условия по продуктам
ТИНЬКОФФ по данной ссылке
План урока:
Серотонин улучшает аппетит, повышает настроение и контролирует эмоции человека. Адреналин стимулирует центральную нервную систему. Все эти соединения – амины. Без них невозможно представить жизнь человека.
Амины – углеводородные производные аммиака, в которых вместо водородных атомов располагаются радикалы. Функциональная группа аминов: аминогруппа (-NH2).
Строение аминов
Аммиак и амины схожи по многим параметрам. Для азота в этих соединениях свойственна sp 3 -гибридизация.
Строение аминов определяет свойства. Для представителей этого класса соединений свойственна основность. Это связано с расположением неподеленной электронной пары на азоте.
Классификация аминов
Группировка по количеству радикалов
Основные свойства соотносятся с количеством электронной плотности на азоте. Чем плотность выше, тем основность выше. Но у третичных аминов обилие радикалов создает пространственные затруднения, поэтому их основные свойства ослаблены.
Группировка по строению органического радикала
Номенклатура аминов
Согласно международной номенклатуре название представителей этого класса соединений формируется из радикала и суффикса«-амин». Если в соединении несколько радикалов, то они располагаются в названии согласно алфавиту.
Амины также можно назвать как производные аммиака. Для этого к радикалу прибавляется приставка «амино-».
Изомерия аминов
Для аминов свойственно несколько видов изомерии.
Способы получения аминов
Существует несколько методов получения аминов.
Реакции нитросоединений
С помощью восстановления нитросоединений синтезируются амины.
- Гидрирование (взаимодействие с молекулами водорода) при нагревании
- Реакция с сульфидом аммония
- Взаимодействие с алюминием в щелочи
- Реакции с металлами (железом, оловом, цинком) и кислотой
В результате образуется соль. При ее взаимодействии с щелочью образуется амин.
Алкилирование (взаимодействие с галогеналканами) аммиака
При недостатке аммиака образуется соль. При ее взаимодействии с щелочью получается амин.
При избытке аммиака амин образуется сразу.
Гидрирование нитрилов
Данная реакция протекает при наличии никеля.
Физические свойства аминов
Первые представители всех типов аминов существуют в виде газов с аммиачным ароматом, средние представители гомологического ряда– жидкостей с запахом рыбы, а высшие существуют в твердом агрегатном состоянии. Ароматические амины – это прозрачные жидкости с большими температурами кипения или твердые соединения.
Первичным и вторичным аминам свойственны высокие температуры плавления и кипения. Это связано с тем, что амины формируют свободные связи между молекулами.
Растворимость аминов обусловлена тем, что они создают связи с молекулами воды. Чем выше молекулярная масса соединения, тем ниже растворимость. Молекулы ароматических аминов не растворяются в воде.
Химические свойства аминов
Основные свойства
Из-за неподеленной электронной пары на азоте амины выражают основные свойства. Основность возрастает в следующем ряду:
Ароматические амины>аммиак>алифатические амины
По мере увеличения электронной плотности на азоте основность увеличивается.
- Гидратация (взаимодействие с водой)
- Взаимодействие с кислотами
Амины взаимодействуют с органическими, минеральными кислотами, аминокислотами. В результате образуются соли.
- Взаимодействие с солями
Окисление
Амины при взаимодействии с кислородом (горении) образуют свободный азот.
Реакция с азотистой кислотой
Из первичных спиртов синтезируются спирты.
Из вторичных спиртов синтезируются нитрозосоединения (вещества желтого цвета).
Алкилирование аминов
В результате реакции первичных аминов и галогеналканов синтезируются соли вторичных аминов, а из вторичных – соли третичных аминов.
Анилин
Анилин – прозрачная жидкость с особенным запахом. При взаимодействии с кислородом (окислении) анилин становится красно-бурым. Анилин токсичен и не растворим в воде.
Реакции могут идти как по боковой цепи, так и по ароматическому кольцу.
Основные свойства анилина
У ароматических аминов самые низкие основные свойства. Они также не реагируют с водой, но взаимодействуют с кислотами.
Для анилина характерны реакции замещения. В эти реакции он вступает легче, чем бензол. Реакция идет без катализаторов. Бром замещается в орто- и параположениях. В результате образуется белый осадок.
Аминокислоты
Аминокислоты – элементарная структура белков, из которых состоят все тела животных. Аминокислоты включают две функциональные группы – аминогруппу (-NH2) и карбоксильную группу (-СООН). Эти две группы не соединены между собой непосредственно.
Общая формула аминокислот
Для аминокислот характерна оптическая изомерия. Белки включают только α-аминокислоты. На нашей планете существует только 20 аминокислот, из которых строится все живое.
Аминокислоты – амфотерные соединения, которые могут реагировать как по карбоксильной группе, так и по аминогруппе.
Применение аминов
Амины в свободном виде в природе встречаются редко. Они образуются при гниении органических остатков. В этом процессе синтезируются такие соединения как путресцин и кадаверин.
Путресцин и кадаверин
Для средних представителей гомологического ряда аминов характерен рыбный запах. Запах селедочного рассола определяется триметиламином.
Амины используются также в промышленности. Например, как:
- отвердитель эпоксидной смолы,
- ускоритель реакции в металлургической промышленности,
- исходное вещество для производства полиамидных волокон,
- вещество для синтеза анилина,
- сырье для получения фенолформальдегидных смол,
- вещество для получения пестицидов, инсекцидов, фунгицидов,
- добавка к машинным топливам и маслам и др.
Метиламин – первичный амин. Он применяется в производстве лекарственных препаратов, красителей, пестицидов.
Диэтиламин – вторичный амин. С его помощью получают пестициды, красители, лекарственные препараты, добавки к машинным маслам и т.д. Также он служит сырьем для изготовления веществ от коррозии металлов. Он может отвердевать эпоксидные смолы и играть роль катализатора при вулканизации.
Триэтиламин – третичный алифатический амин. Он применяется при получении резин, эпоксидных смол и пенополиуретанов. Из него также производят лекарственные препараты, минеральные удобрения, краски и т.д.
Анилин – ароматический амин. Он широко применяется в качестве сырья для получения красителей, лекарственных препаратов, взрывчаток и т.д.
Амины образуются в растениях и животных в результате биохимического распада аминокислот под действием ферментов. Они обладают высокой биологической активности.
Амины животного происхождения – серотонин, адреналин, мелатонин, тирамин и др. Амины растительного происхождения – кофеин, кокаин, никотин, хинин и др.
Вредное воздействие аминов
Практически все амины ядовиты. Ароматический амин анилин проникает через кожу, окисляет гемоглобин, угнетает работу центральной нервной системы. Его действие может привести к гибели.
Отравление можно выявить по следующим признакам:
- трудности при дыхании,
- посинение носа, губ, кончиков пальцев,
- сильное сердцебиение,
- обмороки.
- смыть анилин спиртом,
- дать возможность дышать чистым воздухом,
- вызвать медицинских специалистов.
Алифатические амины оказывают негативное влияние на нервную систему, нарушают работу печени, развивают дистрофию. Некоторые ароматические амины — канцерогены, способные вызвать рак мочевого пузыря. Опасны даже пары аминов.
Источник