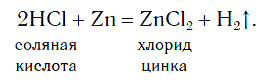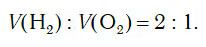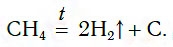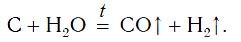- Урок 26. Получение водорода и его применение
- Получение водорода в лаборатории
- Получение водорода в промышленности
- Применение водорода
- Получение водорода
- Получение водорода в лаборатории
- Получение водорода в промышленности
- Водород H2
- Получение
- В промышленности
- В лаборатории
- Физические свойства
- Химические свойства
- Взаимодействие со щелочными и щёлочноземельными металлами
- Взаимодействие с оксидами металлов (как правило, d-элементов)
- Гидрирование органических соединений
- Геохимия водорода
- Применение
- Особенности обращения
- Использование водорода
- Использование водорода в качестве топлива (экономическая эффективность)
Урок 26. Получение водорода и его применение
В уроке 26 «Получение водорода и его применение» из курса «Химия для чайников» узнаем о получении водорода в лабораториях и в промышленности, а также выясним в каких отраслях промышленности его применяют.
Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
Соберем водород методом вытеснения воздуха, располагая пробирку вверх дном (объясните почему), или методом вытеснения воды и проверим его на чистоту. Пробирку с собранным водородом наклоняем к пламени спиртовки. Глухой хлопок свидетельствует о том, что водород чистый; «лающий» громкий звук взрыва говорит о загрязненности его примесью воздуха.
В химических лабораториях для получения относительно небольших объемов водорода обычно применяют способ разложения воды с помощью электрического тока:
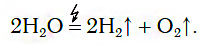
Из уравнения процесса разложения следует, что из 2 моль воды образуются 2 моль водорода и 1 моль кислорода. Следовательно, и соотношение объемов этих газов также равно:
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:
Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:
Существуют и другие промышленные способы получения водорода.
Применение водорода
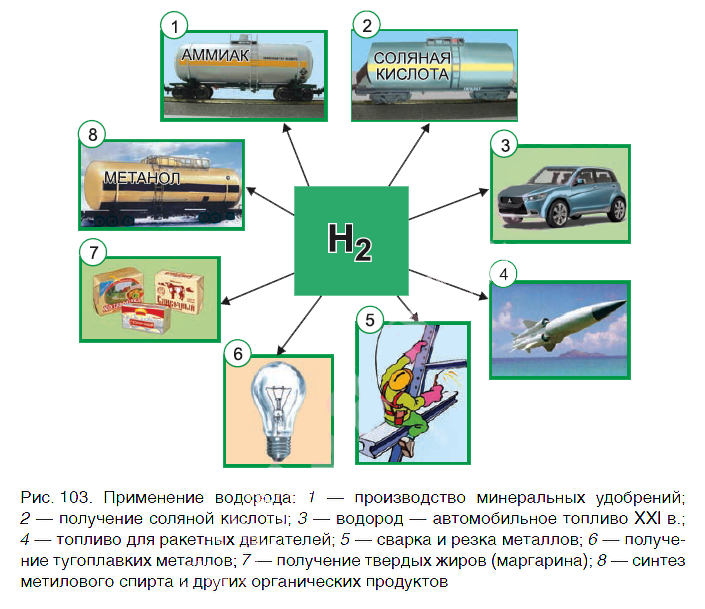
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 о С. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Краткие выводы урока:
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.
Надеюсь урок 26 «Получение водорода и его применение» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Источник
Получение водорода
История открытия водорода История водорода начинается с XVI века, когда было замечено, что при действии кислот на железо и другие металлы выделяется некий неизвестный газ. Первоначально его назвали «горючим воздухом». Такое название газ получил из-за способности гореть. Во второй половине XVIII века английский ученый Генри Кавендиш получил водород при действии соляной кислоты HCl на цинк:
Zn + 2HCl = ZnCl2 + H2
Что же такое кислота с точки зрения химии? Кислота – это сложное вещество, в состав которого всегда входят атомы водорода. В формулах кислот атомы водорода принято писать на первом месте. Атомы, следующие в формуле за водородом, называют кислотным остатком. Так, в соляной кислоте HCl кислотный остаток – Cl.
Например, в серной кислоте H2SO4, кислотный остаток – SO4. Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток Генри Кавендиш изучил свойства «горючего воздуха». Он установил, что этот газ намного легче воздуха, а при сгорании на воздухе образует прозрачные капли жидкости. Этой жидкостью оказалась вода.
Генри Кавендиша считают первооткрывателем водорода. Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 году французским химиком Антуаном Лораном Лавуазье. Антуан Лоран Лавуазье дал этому веществу латинское название (Hydrogenium), которое происходило от греческих слов «хюдор» – вода и «геннао» – рождаю. В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части. Поэтому у химического элемента водорода такое же название, как и у просто вещества H2. Русское слово водород – это точный перевод латинского названия Hydrogenium.
Получение водорода в лаборатории
Современный лабораторный способ получения водорода не отличается от того, которым его получал Генри Кавендиш. Это реакции металлов с кислотами. В лаборатории водород получают в аппарате Киппа (рисунок 152).
Аппарат Киппа изготовляется из стекла и состоит из нескольких частей:
- реакционная колба с резервуаром;
- воронка с длинной трубкой;
- газоотводная трубка.
Реакционная колба имеет верхнюю шарообразную часть с отверстием, в которое вставляется газоотводная трубка, снабженная краном или зажимом, и нижний резервуар в виде полусферы. Нижний резервуар и реакционная колба разделены резиновой или пластиковой прокладкой с отверстием, через которое проходит в нижний резервуар длинная трубка воронки, доходящая почти до дна. На прокладку через боковое отверстие шпателем насыпают твёрдые вещества (мрамор, цинк). Отверстие закрывается пробкой с газоотводной трубкой. Затем при открытом кране или зажиме в верхнюю воронку заливается раствор кислоты. Когда уровень жидкости достигает вещества на прокладке, начинается химическая реакция с выделением газа. При закрытии крана давление выделяющегося газа выдавливает жидкость из реактора в верхнюю часть воронки. Реакция прекращается. Открытие крана приводит к возобновлению реакции. Поместим в реакционную колбу кусочки цинка. В качестве кислоты воспользуемся серной кислотой. При контакте цинка и серной кислоты протекает реакция:
Zn + H2SO4 = ZnSO4 + H2
Водородом можно заполнить мыльный пузырь.
Для этого необходимо опустить газоотводную трубку в мыльный раствор. На конце трубки начнется формирование мыльного пузыря, заполненного водородом; со временем пузырь отрывается и улетает вверх, что доказывает легкость водорода. Соберем выделяющийся водород. С учетом того, что водород намного легче воздуха, для сбора водорода сосуд, в котором собирается газ, необходимо располагать вверх дном, или производить собирание методом вытеснения воды. Как обнаружить водород? Заполним пробирку водородом, держа ее вверх дном, по отношению к газоотводной трубке. Поднесем пробирку отверстием к пламени спиртовки – слышится характерный хлопок.
Хлопок – это признак того, что в пробирке содержится водород. При поднесении пробирки к пламени водород вступает в реакцию с кислородом, содержащимся в воздухе. При малых количествах реакция кислорода и водорода сопровождается хлопком. Более подробно об этой реакции будет рассказано в следующем параграфе.
Получение водорода в промышленности
Одним из промышленных способов получения водорода является реакция разложения воды под действием электрического тока:
2H2O эл.ток → 2H2 + O2.
Данный метод позволяет получить чистый водород и кислород. Процесс превращения химических веществ в другие вещества под действием электричества называется электролизом.
Электролиз – химическая реакция, протекающая под действием электрического тока Проведем электролиз воды. В стакан наполненный водой, опустим металлические электроды. Поверх электродов опустим в стакан пробирки, заполненные водой. Подсоединим электроды к источнику тока – батарейке. В пробирках наблюдается выделение газов – водорода и кислорода, которые вытесняют воду. Наблюдая за процессом электролиза, можно заметить, что в одной из пробирок газа собирается в два раза больше, чем в другой. Проанализировав уравнение реакции электролиза воды, можно сделать вывод, в какой пробирке выделяется водород, а в какой – кислород. Попробуйте это сделать самостоятельно.
Существуют и другие способы получения водорода. Железо-паровой метод долгое время широко применялся в промышленности. Через электрическую трубчатую печь проходит трубка из нержавеющей стали, заполненная железными стружками. Через трубку с железными стружками пропускают водяной пар. При температуре около 800°С пары воды взаимодействуют с железом, образуя оксид Fe3O4 (железную окалину) и газообразный водород:
3Fe + 4Н2О = 4Н2 + Fe3O4.
Можно получить Н2, пропуская Н2О через слой раскаленного угля. При этом образуется смесь двух газов – СО и Н2 (водяной газ):
Н2О + С = CO + Н2
В настоящее время водород получают взаимодействием углеводородов (в основном метана, СН4) с водяным паром или неполным окислением метана кислородом:
2СН4 + О2 = 2СО + 4Н2
Итог статьи:
- В лаборатории водород получают в аппарате Киппа
- Исходными веществами для получения водорода в лаборатории являются некоторые металлы и кислоты
- Собирать водород нужно методом вытеснения воды, или методом вытеснения воздуха, расположив пробирку вверх дном по отношению к газоотводной трубке
- Кислота – сложное вещество, в состав которого входят атомы водорода и кислотный остаток
- Обнаружить водород можно по характерному хлопку при поднесении пробирки с водородом к пламени
- Одним из промышленных способов получения водорода является электролиз воды
- Электролиз – химическая реакция, протекающая под действием электрического тока
Источник
Водород H2
| Главная | | | О компании | | | Каталог | | | Новости | | | Сервисы & Поддержка | | | Контакты |
|
ПолучениеПромышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током. Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит): В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который применяется иногда и в промышленности,- разложение воды электротоком. Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой. В промышленности1.Электролиз водных растворов солей: 2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C: 3.Из природного газа. Конверсияс водяным паром: CH4 + H2O ⇄ CO + 3H2 (1000 °C) Каталитическое окисление кислородом: 2CH4 + O2 ⇄ 2CO + 4H2 4. Крекинг и реформинг углеводородов в процессе переработки нефти. В лаборатории1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и соляную кислоту: 2.Взаимодействие кальция с водой: 4.Действие щелочей на цинк или алюминий: 5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например: 2H3O + + 2e — → H2↑ + 2H2O
Физические свойстваГазообразный водород может существовать в двух формах (модификациях) — в виде орто — и пара-водорода. В молекуле ортоводорода (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны). Разделить аллотропные формы водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно, что даёт возможность изучить свойства отдельных аллотропных форм. Молекула водорода двухатомна — Н₂. При обычных условиях — это газ без цвета, запаха и вкуса. Водород — самый лёгкий газ, его плотность во много раз меньше плотности воздуха. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха. Химические свойстваМолекулы водорода Н₂ довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия: Н2=2Н — 432 кДж Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция: Ca + Н2 = СаН2 и с единственным неметаллом — фтором, образуя фтороводород: F2+H2=2HF С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении. Он может «отнимать» кислород от некоторых оксидов, наприме: CuO + Н2 = Cu + Н20 Записанное уравнение отражает реакцию восстановления. Реакциями восстановления называются процессы, в результате которых от соединения отнимается кислород; вещества, отнимающие кислород, называются восстановителями (при этом они сами окисляются). Далее будет дано и другое определение понятиям «окисление» и «восстановление». А данное определение, исторически первое, сохраняет значение и в настоящее время, особенно в органической химии. Реакция восстановления противоположна реакции окисления. Обе эти реакции всегда протекают одновременно как один процесс: при окислении (восстановлении) одного вещества обязательно одновременно происходит восстановление (окисление) другого. С галогенами образует галогеноводороды: F2 + H2 → 2 HF, реакция протекает со взрывом в темноте и при любой температуре, Cl2 + H2 → 2 HCl, реакция протекает со взрывом, только на свету. С сажей взаимодействует при сильном нагревании: Взаимодействие со щелочными и щёлочноземельными металламиВодород образует с активными металлами гидриды: Гидриды — солеобразные, твёрдые вещества, легко гидролизуются: Взаимодействие с оксидами металлов (как правило, d-элементов)Оксиды восстанавливаются до металлов: Гидрирование органических соединенийПри действии водорода на ненасыщенные углеводороды в присутствии никелевого катализатора и повышенной температуре происходит реакция гидрирования: Водород восстанавливает альдегиды до спиртов: Геохимия водородаВодород — основной строительный материал вселенной. Это самый распространённый элемент, и все элементы образуются из него в результате термоядерных и ядерных реакций. На Земле содержание водорода понижено по сравнению с Солнцем, гигантскими планетами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё. Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах. В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды. В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением. Он мигрирует в верхние слои атмосферы и улетучивается в космос. ПрименениеАтомарный водород используется для атомно-водородной сварки. В пищевой промышленности водород зарегистрирован в качестве пищевой добавки E949, как упаковочный газ. Особенности обращенияВодород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21%. Также водород пожароопасен. Жидкий водород при попадении на кожу может вызвать сильное обморожение. Взрывоопасные концентрации водорода с кислородом возникают от 4% до 96 % объёмных. При смеси с воздухом от 4% до 75(74) % объёмных. Использование водородаВ химической промышленности водород используют при производстве аммиака, мыла и пластмасс. В пищевой промышленности с помощью водорода из жидких растительных масел делают маргарин. Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько ужасных катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют газом гелием. Водород используют также в качестве ракетного топлива. Когда-нибудь водород, возможно, будут широко применять как топливо для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар (правда, само получение водорода приводит к некоторому загрязнению окружающей среды). Наше Солнце в основном состоит из водорода. Солнечное тепло и свет — это результат выделения ядерной энергии при слиянии ядер водорода. Использование водорода в качестве топлива (экономическая эффективность)Важнейшей характеристикой веществ, используемых в качестве топлива, является их теплота сгорания. Из курса общей химии известно, что реакция взаимодействия водорода с кислородом происходит с выделением тепла. Если взять 1 моль H2 (2 г) и 0,5 моль O2 (16 г) при стандартных условиях и возбудить реакцию, то согласно уравнению после завершения реакции образуется 1 моль H2O (18 г) с выделением энергии 285,8 кДж/моль (для сравнения: теплота сгорания ацетилена составляет 1300 кДж/моль, пропана — 2200 кДж/моль). 1 м³ водорода весит 89,8 г (44,9 моль). Поэтому для получения 1 м³ водорода будет затрачено 12832,4 кДж энергии. С учётом того, что 1 кВт·ч = 3600 кДж, получим 3,56 кВт·ч электроэнергии. Зная тариф на 1 кВт·ч электричества и стоимость 1 м³ газа, можно делать вывод о целесообразности перехода на водородное топливо. Например, экспериментальная модель Honda FCX 3 поколения с баком водорода 156 л (содержит 3,12 кг водорода под давлением 25 МПа) проезжает 355 км. Соответственно из 3,12 кг H2 получается 123,8 кВт·ч. На 100 км расход энергии составит 36,97 кВт·ч. Зная стоимость электроэнергии, стоимость газа или бензина, их расход для автомобиля на 100 км легко подсчитать отрицательный экономический эффект перехода автомобилей на водородное топливо. Скажем (Россия 2008), 10 центов за кВт·ч электроэнергии приводят к тому, что 1 м³ водорода приводят к цене 35,6 цента, а с учётом КПД разложения воды 40-45 центов, такое же количество кВт·ч от сжигания бензина стоит 12832,4кДж/42000кДж/0,7кг/л*80центов/л=34 цента по розничным ценам, тогда как для водорода мы высчитывали идеальный вариант, без учёта транспортировки, амортизации оборудования и т. д. Для метана с энергией сгорания около 39 МДж на м³ результат будет ниже в два-четыре раза из-за разницы в цене (1м³ для Украины стоит 179$, а для Европы 350$). То есть эквивалентное количество метана будет стоить 10-20 центов. Однако не следует забывать того, что при сжигании водорода мы получаем чистую воду, из которой его и добыли. То есть имеем возобновляемый запасатель энергии без вреда для окружающей среды, в отличие от газа или бензина, которые являются первичными источниками энергии. Источник | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||