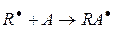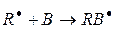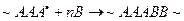- Способы получения ВМС
- Характеристика методов получения ВМС.
- Учебное пособие: Химия высокомолекулярных соединений
- 3. ОСНОВНЫЕ ОТЛИЧИЯ ВМС
- ОТ НИЗКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
- 4. МЕТОДЫ ИЗУЧЕНИЯ СТРУКТУРЫ ПОЛИМЕРОВ
- 6. ИЗОМЕРИЯ ПОЛИМЕРОВ
- 6.1. Структурная изомерия
- R R R R
- 7. СИНТЕЗ МОНОМЕРОВ
- Схема 1
- 8.1.2.3. Ионно-координационная полимеризация
Способы получения ВМС
Высокомолекулярные соединения
ВМС (полимеры) – это вещества с большой молекулярной массой (десятки, сотни тыс.), молекулы которых содержат повторяющиеся группы атомов, называемых мономерами.
1. По способам получения:
2. По свойствам и применению:
Способы получения ВМС
Реакция полимеризации – процесс соединения мономеров в молекулы полимеров, протекающих за счет разрыва кратных связей.
Где n- степень полимеризации, показывает число мономеров.
Реакции полимеризации делятся на
Цепную полимеризацию – реакции ненасыщенных соединений с двойными или двумя сопряженными связями. Протекает с образованием нестойких промежуточных частиц. При ионной полимеризации такими частицами являются ионы, возникающие при действии катализатора. При радикальной полимеризации эти частицы представляют собой радикалы, для образования которых применяются инициаторы.
Разновидностью полимеризации является сополимеризация — совместная полимеризация двух или более мономеров с образованием их сополимера, например, бутадиенстирольный каучук.
— блочный –реакция протекает в среде жидкого или газообразного мономера и мономер, полимеризуясь, образует сплошную массу (блок) полимера;
— эмульсионный – мономер полимеризуется в виде водной эмульсии и образуется суспензия полимера;
— лаковый –мономер растворяют в низкокипящем органическом растворителе, после окончания полимеризации растворитель отгоняют.
Реакция поликонденсации – процесс образования полимера за счет взаимодействия между функциональными группами одинаковых или различных мономеров, в результате которого отщепляется низкомолекулярное вещество (Н2О, NH3, HCl).
Реакция теломеризации – это цепная радикальная реакция, характерным признаком которой является образование веществ в результате присоединения одной молекулы предельного соединения к нескольким молекулам непредельного соединения.
Например, реакция теломеризации четыреххлористого углерода с этиленом: ССl + n CH2 = CH2 → Cl (CH2-CH2)n CCl3
Название теломеризации происходит от греческих слов «телос» — конец и «мер» — часть, что значит размещение частей молекулы предельного соединения по концам молекулы полимера.
Источник
Характеристика методов получения ВМС.
К ВМС относятся вещества сложного химического строения с большой молекулярной массой (порядка 10 4 – 10 6 а.е.м.). ВМС, или полимеры, представляют из себя длинные цепи, состоящие из одинаковых, многократно повторяющихся звеньев. Число звеньев в цепи называется степенью полимеризации и обозначается буквой n. Величина степени полимеризации может варьироваться в широких пределах: от нескольких единиц до 5000–10000 и более.Полимеры с высокой степенью полимеризации называются высокополимерами, с низкой – олигомерами.
Для получения полимеров используют низкомолекулярные соединения, называемыемономерами. Для удобства запоминания все мономеры можно разбить на три группы:
¨ мономеры для получения пластмасс;
¨ мономеры для получения каучуков;
¨ мономеры для получения волокон.
ВМС можно получить методами полимеризации и поликонденсации.
Получение ВМС (полимеров) из мономеров, осуществляемое за счёт разрыва кратных связей и протекающее без выделения побочных продуктов, называется полимеризацией. Реакция полимеризации, как правило, протекает в две стадии. В зависимости от характера первой стадии процесса различают радикальную и ионнуюполимеризацию. Радикальная полимеризация протекает в присутствииинициаторов – веществ, у которых энергия активизации появления свободных радикалов значительно меньше, чем у самих веществ, подвергающихся полимеризации. В качестве инициаторов чаще используются органические перекиси.
Важнейшие мономеры для получения полимерных соединений
| ФОРМУЛА | НАЗВАНИЕ | ФОРМУЛА | НАЗВАНИЕ |
| Для получения пластмасс | (NH2)2CO | Карбамид | |
| СН2 = СН2 | Этилен | Для получения каучуков и волокон | |
| СН2 = СН2Cl | Хлорвинил | CH2 = CH–CH=CH2 | Бутадиен |
| CH2 = CH–CH3 | Пропилен | CH2 = CH–CCl=CH2 | Хлоропрен |
| CH2 = CH–C6H5 | Стирол | CH2 = CH–C(CH3)=CH2 | Изопрен |
| CH2 = CH–CN | Акрилонитрил | H2N(CH2)5COOH | Аминокапроновая кислота |
| CH2 = C(CH3)COOCH3 | Метилметакрилат | H2N(CH2)6COOH | Аминоэнантовая кислота |
| CF2 = CF2 | Тетрафторэтилен | H2N(CH2)6NH2 | Гексаметилендиамин |
| HCOH | Формальдегид | HOOC–(CH2)4–COOH | Адипиновая кислота |
| C6H5OH | Фенол | HOOC–C6H4–COOH | Терефталевая кислота |
| C6H5NH2 | Анилин | HO–(CH2)2–OH | Этиленгликоль |
Примером реакции полимеризации является также получение каучуков. Надо иметь в виду, что при этом происходит перегруппировка связей. Одна p–связь разрывается и идёт на присоединение последующих молекул мономера, а вторая смещается в центр элементарного звена. Таким образом, двойная связь в макромолекуле полимера сохраняется. Так, при получении полибутадиена:
Получение ВМС (полимеров) за счёт взаимодействия различных функциональных групп, протекающее с выделением низкомолекулярных побочных продуктов, называется реакцией поликонденсации.
Взаимодействие карбамида (мочевины) с формальдегидом протекает также в две стадии: сначала образование спирта, затем взаимодействие образовавшегося спирта со следующей молекулой карбамида.
Характеристика методов промышленного производства олефиновых углеводородов
Олефины (от лат. oleum-масло) (алкены, этиленовые углеводороды., ненасыщенные ациклические углеводороды, содержащие одну двойную связь С=С; общая формула СnН2n. Атомы углерода при двойной связи имеют sp 2 -гибридизацию и образуют s- и p-связи. Последняя состоит из двух базисных орбиталей — связывающей и разрыхляющей, образующихся за счет р-орбиталей атомов С. Энергия связи
615 кДж/моль. Простейший олефин — этилен, валентные углы которого практически равны 120°. Для олефинов, начиная с С4Н8, наряду с изомерией углеродного скелета и различного положения двойной связи, возможна геометрическая (цис-, транс-)изомерия, обусловленная большим барьером вращения вокруг двойной связи.
Первое место по масштабам промышленного потребления среди олефинов занимает этилен; во всё возрастающих количествах применяют пропилен и бутены. Из высших олефинов основное значение имеют a-олефины с прямой цепью, получаемые термическим крекингомтвёрдого или мягкого парафина при температуре около 550 °С и каталитической олигомеризацией этилена с помощью алюминийорганическихкатализаторов. Полимеризацией олефинов получают высокомолекулярные продукты — полиэтилен, полипропилен и др. полиолефины. Полиэтилен— самый массовый вид пластмасс. Его производство растет очень быстро, и он широко используется во всех отраслях промышленности. Быстро прогрессирует синтез винилхлорида окислительным хлорированием этилена или смеси этилена с ацетиленом. Винилхлорид широко используется для производства многих полимерных материалов. Из поливинилхлорида изготавливают плёнки, трубы и прочие.
Большое значение в нефтехимическом синтезе приобрели окись этилена и окись пропилена; из них синтезируют гликоли, поверхностно-активные вещества, этаноламины и др. Значительное количество этилена расходуется на алкилирование бензола для производства стирола, окисление вацетальдегид и уксусную кислоту, для производства винилацетата и этилового спирта. Для получения спиртов, альдегидов и некоторых др. соединений используется оксосинтез. Хлорированием олефинов производят многие ценные растворители, инсектициды и др. вещества. Из высшихолефинов синтезируют алкилсульфаты, присадки к нефтепродуктам.
Характеристика процессов ОО и НХС.
Источник
Учебное пособие: Химия высокомолекулярных соединений
| Название: Химия высокомолекулярных соединений Раздел: Остальные рефераты Тип: учебное пособие Добавлен 04:35:53 13 сентября 2011 Похожие работы Просмотров: 12302 Комментариев: 7 Оценило: 0 человек Средний балл: 0 Оценка: неизвестно Скачать |
 |
Полимеры, проявляющие высокую степень стереорегулярности, называются тактическими.
Для стереорегулярных полимеров, полученных из двух замещенных мономеров типа RCH=CHR, предложено название диизотактические. Причем для описания конфигураций последовательности удобно принять номенклатуру, используемую в органической химии для описания стереоспецифического присоединения цис- и транс- олефиновым звеньям:
цис- присоединение к цис- олефину эритро -структура

цис -присоединение к транс- олефину трео- структура
По определению соседние асимметрические центры в эритро- структуре обладают одинаковой конфигурацией, тогда как в трео- структуре конфигурации альтернативны. Таким образом, полимер, полученный из олефина RCH=CHR’ может быть обозначен как эритро- диизотактический или трео- диизотактический. Возможно также существование полимера на основе 1,2-дизамещенного этилена, где асимметрические центры цепи состоят из равного количества эритро- и трео- структур.
Стереорегулярные структуры полимеров дизамещенного этилена












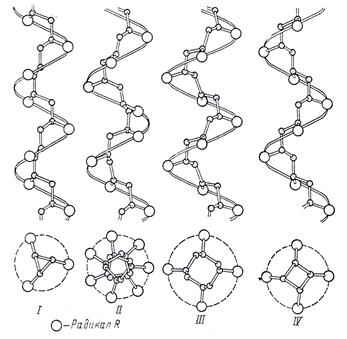
Если бы макромолекулы были действительно построены таким образом, то это соответствовало бы цис- структуре в расположении заместителей, а следовательно, и структура эта обладала бы максимальной потенциальной энергией, поэтому в действительности отдельные группы атомов поворачиваются относительно друг друга на определенный угол. Повороты атомов относительно друг друга приводят к тому, что молекулы стереорегулярных полимеров в пространстве располагаются в виде более или менее сложных спиралей, с разной симметрией, в зависимости от строения (рис. 2).
Стереорегулярная конфигурация энергетически значительно выгоднее, чем атактическая. Это приводит к тому, что даже при химической деструкции в присутствии катализаторов, когда получаются низкомолекулярные обрывки макромолекул, последние все-таки сохраняют стереорегулярность.
Стереорегулярные полимеры более склонны к плотной упаковке макромолекул и максимальному сближению цепей и построены только по типу a,b. Также полимеры обладают способностью кристаллизоваться.
Рис. 2. Спиральные структуры стереорегулярных макромолекул
с различной симметрией
Стереорегулярную структуру имеют, например, природные полимеры, в том числе и натуральный каучук. Получить изопреновый каучук, аналогичный по свойствам природному, – это значит получить искусственный каучук с регулярно построенными макромолекулами. В решении этой задачи приоритет принадлежит нашим ученым.
Стереорегулярность полимера определяет его механические, физические и другие свойства. Например, высококристаллический полипропилен обладает высокими механическими свойствами и прекрасной теплостойкостью. В то же время полипропилен с неупорядоченным строением (атактический) представляет собой мягкий материал, напоминающий каучук. Такой полипропилен не нашел до сих пор существенного практического применения, если не считать его использования в качестве дешевой добавки к дорожному асфальту.
7. СИНТЕЗ МОНОМЕРОВ
Синтез того или иного полимера состоит из двух этапов: получения мономера и превращения его в полимер.
Мономеры – низкомолекулярные вещества, молекулы которых, взаимодействуя между собой, образуют макромолекулы. Для успешного протекания реакций молекула мономера должна содержать кратные связи, неустойчивый цикл или не менее двух реакционноспособных функциональных групп.
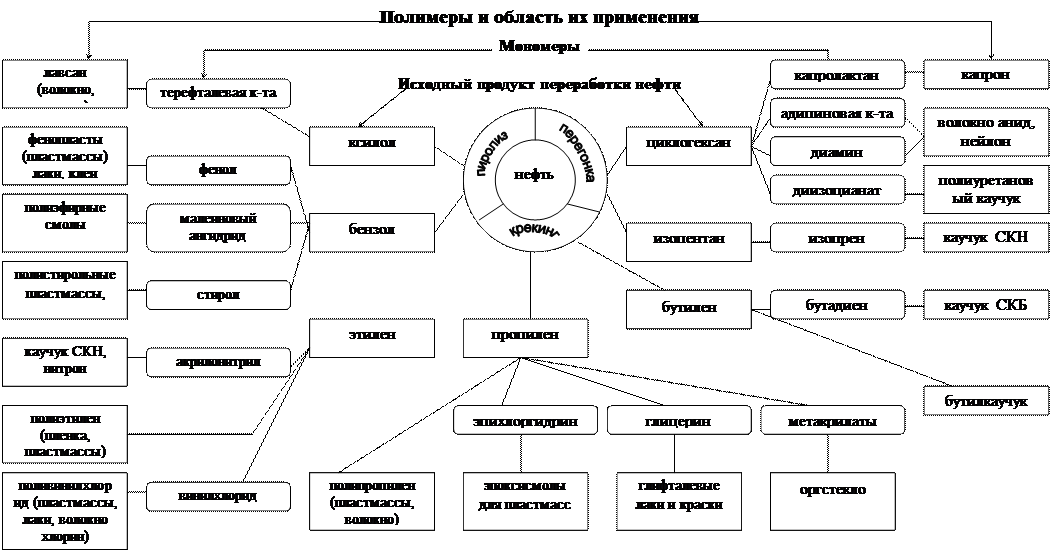
Наиболее важными видами сырья для производства мономеров являются нефть, попутный и природный газы, дающие наиболее чистые соединения (схема 1 и 2).
Несколько меньшее значение имеют продукты сухой перегонки каменного угля и некоторых других видов твердого топлива.
Схема 1
Схема переработки природного и попутного газов в полимеры
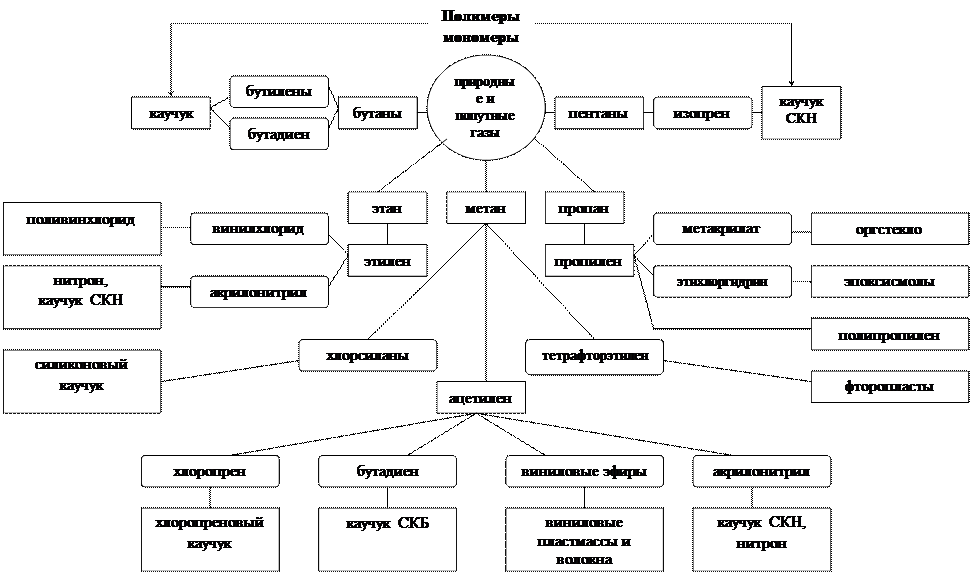
Схема 2
Схема переработки нефти в полимеры
8. ПОЛУЧЕНИЕ ПОЛИМЕРОВ ИЗ НИЗКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
Для синтеза ВМС из мономеров применяются два метода – полимеризация и поликонденсация.
Полимеризация является, по существу, частным случаем реакции присоединения и заключается в соединении между собой большого числа мономерных молекул, содержащих кратные связи или циклы, без выделения существенных количеств побочных продуктов, вследствие этого полимер и мономер имеют один и тот же элементарный состав.
Поликонденсация , которую можно рассматривать как реакцию замещения, представляет собой процесс образования ВМС, сопровождающийся отщеплением низкомолекулярных побочных продуктов (вода, аммиак, НCl и др.). При этом молекула каждого мономера должна содержать не менее двух функциональных групп (–ОН, −СООН, −Cl, –NH2 и т. д.), способных реагировать с функциональными группами таких же или других мономеров. В отличие от продуктов полимеризации ВМС, полученные поликонденсацией, имеют иной элементарный состав по сравнению с исходными мономерами, что объясняется выделением побочных продуктов во время реакции.
Приведенные определения полимеризации и поликонденсации отражают в основном различия в составе и строении мономеров и полимеров. Кроме того, за последние годы все большее значение приобретают так называемые реакции полиприсоединения , напоминающие поликонденсацию, но не сопровождающиеся выделением низкомолекулярных побочных продуктов, и процессы полимеризации, при которых образуются существенные количества побочных продуктов. Поэтому в настоящее время намечается тенденция к делению процессов образования полимеров не на основании структурных признаков или состава, а по механизму реакции.
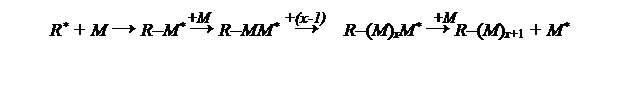
Реакция продолжается до тех пор, пока концевое звено не утратит своей активности, или до полного исчерпания мономера. В самом общем виде процесс может быть представлен схемой Мх + М → Мх+ 1 , откуда видно, что к растущей цепи присоединяются только молекулы мономера.
При поликонденсации рост цепи протекает за счет функциональных групп, присутствующих не только в мономерных молекулах, но и в продуктах их взаимодействия, то есть по схеме Мх + Му → Мх+у , где х и у могут быть единицей или любым другим целым числом. Иначе говоря, в процессе роста цепи участвуют наряду с молекулами мономера, как в процессе полимеризации, еще более крупные частицы, накапливающиеся в ходе реакции.
Характерные особенности механизмов полимеризации и поликонденсации могут быть сведены к следующим признакам:
2. ВМС образуется почти сразу после начала реакции и вплоть до завершения ее, в реакционной смеси находятся мономер и полимер большой молекулярной массы. Промежуточные продукты, как правило, не могут быть выделены.
2. ВМС образуются, как правило, только при практически полном завершении реакции. Почти сразу исчезает мономер вследствие образования небольших полимерных молекул, которые затем реагируют между собой, превращаясь в более крупные частицы. Промежуточные продукты можно в принципе выделить.
3. До достижения сравнительно большой глубины реакции увеличение продолжительности ее практически не влияет на молекулярную массу полимера, растет в основном его качество.
3. Молекулярная масса непрерывно растет в ходе реакции, и лишь при практическом завершении ее образуется высокомолекулярный полимер.
Один и тот же полимер может быть синтезирован при помощи как полимеризации, так и поликонденсации; однако, как показывает практика, в одних случаях целесообразно применять полимеризацию, а в других поликонденсацию. Например, теоретически полиэтилен может быть получен при полимеризации этилена (1) или поликонденсации дихлорэтана с металлическим натрием (2):
x CH2 = CH2 →

Однако практическое значение имеет первый метод. Так как реакции полимеризации и поликонденсации резко отличаются друг от друга, каждая из этих реакций рассматривается отдельно.
Таким образом, реакция полимеризации характерна для многих органических веществ, в молекулах которых имеются двойные и тройные связи. В современной химии термин полимеризация заменен термином полиприсоединение , так как реакция полимеризации имеет более широкий смысл. Активность мономера в реакции полиприсоединения в значительной степени зависит от электронных смещений в его молекуле. Чем меньше эффект сопряжения в мономере, то есть чем меньше его молекула поляризована, тем больше активность образующегося из него радикала. Поскольку эффект сопряжения больше сказывается на активности радикала, чем на реакционной способности мономера, скорость радикальной полимеризации зависит главным образом от активности радикала.
Схема реакции полимеризации в общем виде может быть выражена уравнением
Различают несколько механизмов полимеризации:
3) ионно-координационная (стереоспецифическая);
В реакцию полимеризации вступают в основном ненасыщенные мономеры, у которых двойная связь находится между углеродными атомами:


или между углеродным и любым другим атомом:



В первом случае образуются карбоцепные полимеры, во втором – гетероцепные.
Возможна полимеризация и неустойчивых предельных соединений циклического строения с гетероатомом в цикле. В этом случае полимеризация происходит за счет размыкания цикла с образованием гетероцепных полимеров:
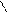
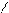
оксид этилена полиэтиленоксид
Как и любая химическая реакция, полимеризация начинается с разрыва одних химических связей и возникновения других. Такой разрыв, как известно, может происходить или по гетеролитическому, или по гомолитическому механизму. В первом случае образуются ионы, а во втором – свободные радикалы. Полимеризация, протекающая с образованием ионов, называется ионной полимеризацией , а идущая с участием свободных радикалов – радикальной. Таким образом, радикальная и ионная полимеризация различаются природой активного центра (частицы) , начинающего и ведущего макромолекулярную цепь.
Радикальная и ионная полимеризация протекают по цепному механизму. Отличительная особенность цепных реакций заключается в том, что энергия, выделяющаяся на отдельных стадиях, не рассеивается в реакционной среде, а расходуется на осуществление следующих стадий.
8.1.1. Радикальная полимеризация
Радикальная полимеризация – один из распространенных способов синтеза полимеров. Активным центром такой полимеризации является свободный радикал. Как и всякий цепной процесс, радикальная полимеризация протекает через три основные стадии.
Инициирование (образование активного центра).
На этой стадии происходит образование свободного радикала (R×), который легко взаимодействует с различными непредельными соединениями (мономерами):
В зависимости от условий образования свободных радикалов, начинающих реакционную цепь, различают несколько видов полимеризации: термическую, фотохимическую, радиационную и инициированную.
При термической полимеризации свободные радикалы образуются из мономеров под действием высоких температур (700–1000 °С). Происходящий при этом разрыв двойной связи в молекуле приводит к появлению бирадикала
CH2 =CHR ® ĊH2 −ĊHR который, взаимодействуя с молекулой мономера, образует более сложный бирадикал
Он, в свою очередь, в последующем превращается в монорадикал. Следует, однако, отметить, что термическая полимеризация не имеет пока широкого применения, так как ее скорость сравнительно невелика.
Фотохимическая полимеризация инициируется при возбуждении молекул мономера излучением света (λ * HR R−CH−CH2 —-CH−СН−R ® CH3 −CHR


Так как образование активных центров при фотополимеризации протекает в результате прямого поглощения квантов энергии, процесс может проводиться при температурах, при которых полимеризация, инициируемая другими методами, не протекает. При фотохимическом инициировании полимеризация продолжается иногда после прекращения светового облучения («темновой» период) за счет активных центров, возникших при облучении.
Радиационная полимеризация протекает при действии на мономеры a-,
b-, g- и R — излучения. Образующиеся при этом свободные радикалы инициируют затем реакцию полимеризации.
Наиболее распространенным и часто применяемым на практике методом полимеризации является инициированная полимеризация . Она активизируется соединениями, которые легко распадаются на свободные радикалы в условиях полимеризации (химическое инициирование). Они содержат в своих молекулах неустойчивые химические связи (О–О, N–N, S–S, O–N и др.), которые разрываются при гораздо меньшей энергии, чем это требуется для образования свободного радикала из молекулы мономера (при ее активации).
Такие соединения называют инициаторами полимеризации. Зачастую в качестве инициаторов могут быть органические пероксиды и гидропероксиды, некоторые азо- и диазосоединения и другие вещества:



пероксид бензоила фенил-радикал
При распаде пероксида бензоила образуются бензоатные и фенильные радикалы. Оба радикала могут соединяться с молекулами мономера, инициируя полимеризацию. Но, наряду с этим, они могут участвовать и в побочных реакциях. Например:
АН – присутствующие в реакционной смеси водородсодержащие вещества, в том числе и мономер.

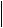

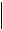



Скорость распада инициатора на свободные радикалы можно увеличить не только повышением температуры, но и добавкой в реакционную среду специальных восстановителей – промоторов и активаторов.
Промоторы возбуждают химическую реакцию, действуя только в начале процесса, а активаторы поддерживают активность катализатора (инициатора) в течение всего процесса. Эти вещества способствуют образованию свободных радикалов из инициаторов при более низких температурах (окислительно-восстановительное инициирование). Роль таких добавок могут выполнять соли Fе 2+ и других металлов, а также пирогаллол, третичные амины, аскорбиновая кислота и другие:
R−O−OH + Fe 2+ ® Fe 3+ + RO + OH
Количество вводимого инициатора обычно невелико (0,1–1 %). Общая скорость радикальной полимеризации возрастает пропорционально корню квадратному из величины концентрации инициатора:
U = k [I], где [I ] – концентрация инициатора.
В тоже время средняя степень полимеризации Р обратно пропорциональна корню квадратному из этой величины:
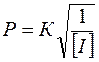
Таким образом, при увеличении концентрации инициатора ускоряется процесс радикальной (инициированной) полимеризации с одновременным снижением средней степени полимеризации (а значит, и молекулярной массы полимера).
Процесс роста цепи заключается в многократном присоединении молекул мономера к усложняющемуся каждый раз промежуточному радикалу с сохранением свободного электрона в концевом звене растущей макромолекулы. Другими словами, растущая макромолекулярная цепь должна оставаться в период ее роста свободным макрорадикалом :

В результате таких последовательных реакций присоединения двойная связь мономера превращается в простую, что сопровождается выделением энергии за счет разности энергии d— и p-связей.
Конец роста цепи связан с исчезновением свободного электрона у последнего звена макромолекулы. Чаще всего это происходит в результате соединения между собой двух радикалов (реакция рекомбинации ), что приводит к возникновению цепи, которая не способна к дальнейшему росту:
Обрыв цепи может протекать и за счет процесса диспропорционирования (см. с. 33).
Свободные радикалы (монорадикалы), являясь исключительно реакционноспособными частицами, взаимодействуют не только с мономерами, но и с растворителем, различными примесями и с образовавшимися макромолекулами. При этом неподеленный электрон (активный центр) может перейти на любую другую молекулу, например молекулу растворителя, которая, превращаясь в радикал, дает начало новой макромолекуле:
Такие реакции называют реакциями передачи цепи или теломеризации. В данном случае передача цепи происходит через растворитель – тетрахлорид углерода. Вероятность такой передачи увеличивается с повышением температуры полимеризации. При этом скорость реакции полимеризации не уменьшается, но, так как реакционная цепь распадается на несколько молекулярных цепей, степень полимеризации образующегося полимера заметно понижается. Изменяя таким образом соотношение количества мономера и растворителя, можно получать полимеры с различной молекулярной массой. Вещества, через которые осуществляется передача цепи и регулируется средняя молекулярная масса полимера, называют регуляторами. В качестве регуляторов применяют тетрахлорид углерода, тиолы, тиогликолевую кислоту и др.
Реакции обрыва и передачи цепи часто используют в практических целях для стабилизации мономеров при их хранении. Это необходимо для предотвращения преждевременной полимеризации мономеров и для управления процессом полимеризации в целом. Для этого часто при взаимодействии со свободными радикалами образуют малоактивные частицы, не способные в дальнейшем инициировать процесс полимеризации. Если следует только уменьшить скорость полимеризации, а не остановить процесс окончательно, применяют специальные вещества – замедлители.
Характер действия ингибиторов и замедлителей практически одинаков, а различие между ними скорее количественное, чем качественное.
Методом радикальной полимеризации получены такие известные полимеры, как поливинилхлорид, полистирол, бутадиенстирольные каучуки, полиметилметакрилат и др. По активности при радикальной полимеризации мономеры можно расположить в ряд: бутадиен > стирол > метилметакрилат > винилхлорид.
8.1.2. Ионная полимеризация
Если в радикальной полимеризации активным центром является радикал, то в ионной – ионы. Полимеризация, при которой ее активный центр – заряд иона – передается последовательно по макромолекулярной цепи при ее росте, называется ионной полимеризацией.
Ионная полимеризация, как и радикальная, – цепной процесс. Однако растущая макромолекула при ионной полимеризации в отличие от радикальной представляет собой (в процессе роста) не свободный радикал, а ион – катион или анион. В зависимости от этого различают катионную (карбониевую) и анионную (карбанионную) полимеризации.
Ионная полимеризация протекает в присутствии катализаторов, способствующих образованию ионов. Но, в противоположность инициаторам, они не входят в состав полимера, то есть не расходуются в процессе полимеризации; поэтому ионная полимеризация называется также каталитической.
Особенностью ионной полимеризации является ее очень высокая скорость при низких температурах (от –50 до –70 °С). Эта скорость зависит от полярности среды, в которой протекает полимеризация.
По ионному механизму могут полимеризоваться соединения с кратными связями: >С=С С=О, −С≡N и гетероциклические соединения с неустойчивым циклом, например
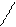
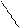
8.1.2.1. Катионная (карбониевая) полимеризация
Этот тип полимеризации протекает через образование катионов. В этом случае используют катализаторы, обладающие электроноакцепторными свойствами. Присоединяя молекулу мономера, они образуют катион – ион карбония . Катализаторами катионной полимеризации могут быть протонные кислоты HClO4 , H2 SO4 , HCl и катализаторы Фриделя – Крафтса (AlCl3 , ВF3 , TiCl4 , FeCl3 , SiCl4 и др.). Катионную полимеризацию можно ускорить с помощью добавок – сокатализаторов НВ : вода, кислоты и другие вещества, являющиеся донорами протонов. Сокатализаторы существенно влияют на активность катализаторов, которые способны взаимодействовать с ними.
По катионному механизму получаются, например, производные этилена с электронодонорными заместителями, карбонильные гетероциклические соединения, а также нитрилы (изобутилен, триоксан, тетрагидрофуран). Катионная полимеризация протекает через три основные стадии.
1. Инициирование. На этой стадии происходит взаимодействие катализатора (АlСl3 ) и сокатализатора (НВ) с образованием комплексного соединения, которое проявляет свойства сильной кислоты:
AlCl3 + HB ® [AlCl3 B] – H + эта кислота, отдавая протон молекуле мономера, превращает его в карбониевый ион, уравновешенный комплексным противоионом (ионная пара ):
[AlCl3 B] – H + + CH2 =CHR ® CH3 −C + HR + AlCl3 B – (s,p-сопряжение).
Большое значение имеет характер заместителя в мономере. Электронодонорные заместители создают избыток электронной плотности на противоположном конце молекулы мономера и этим способствуют присоединению протона (или положительно заряженного иона). Таким образом, в катионной полимеризации особую активность могут проявлять такие мономеры, как пропилен, бутилен, изобутилен, диены.
2. Рост цепи . В процессе роста цепи поляризованные молекулы мономера присоединяются к растущему иону, «внедряясь» между макрокарбкатионом (со стороны его заряженной части) и противоионом (AlCl3 B – ):

3. Обрыв цепи . Рост цепи прекращается в результате отщепления (регенерации) от растущего иона комплексной кислоты или катализатора:

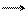
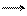
В результате обрыва цепи катализатор снова выделяется в свободном виде.
Суммарная скорость катионной полимеризации прямо пропорциональна концентрации катализатора, а средняя степень полимеризации от концентрации катализатора не зависит, но прямо пропорциональна концентрации мономера:
где [K] – концентрация катализатора,
[M] – концентрация мономера.
8.1.2.2. Анионная (карбанионная) полимеризация
Эта полимеризация протекает через стадию образования карбаниона. Катализаторами здесь служат электронодонорные вещества – основания, щелочные металлы, металлорганические соединения (бутилнатрий, трифенилметилнатрий, Al(C2 H5 )3 и его комплексы и др.), гидриды металлов (LiH, NaH), амид калия KNН2 . К анионной полимеризации более склонны акрилаты (СН2 =СН−СООR), стирол, диены. В качестве активного центра у них выступает карбанион.
Приведем механизм анионной полимеризации в присутствии катализатора (KNH2 ) в среде жидкого аммиака при низких температурах.

В присутствии металлорганических соединений (R–Na) образование активного центра происходит внедрением мономера по поляризованной связи металл – углерод:

Например, анионная полимеризация бутадиена-1,3 в присутствии катализатора С4 Н9 Li начинается с нуклеофильной атаки диена алкиланионом С4 Н9 – :

Электроноакцепторные заместители (R) в молекуле мономера способствуют присоединению аниона. Оттягивая электронную плотность, они создают дефицит электронов на конце молекулы, к которому присоединяется
отрицательно заряженная группа (NH2 – , R – ). В реакции анионной полимеризации могут активно участвовать метилметакрилат, акрилонитрил, метакрилонитрил и другие.

В процессе этой реакции, как и при катионной полимеризации, мономер занимает место между макрокарбкатионом и противоионом.
Обрыв цепи . Реакция передачи цепи на растворитель или мономер может вызвать прекращение роста макромолекулярной цепи:
Установлено, что скорость анионной полимеризации пропорциональна квадрату концентрации мономера и корню квадратному из концентрации катализатора:
V = k [M 2 ] 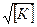
[K] – концентрация катализатора.
Активность карбаниона значительно снижается c увеличением стерического влияния (например, напряжения) в отдельных участках макромолекулы.
В качестве катализатора анионной полимеризации часто выступают щелочные металлы. Они способствуют окислительно-восстановительным реакциям, протекающим между этими металлами и мономерами. Образующиеся металлорганические соединения катализируют дальнейший рост макромолекулярной цепи:


Полимеризация в этом случае протекает на поверхности металла (натрия). Мономер (бутадиен), адсорбируясь на металле, поляризуется и реагирует с карбанионом. Однако образующийся натрийбутадиеновый (и натрийизопреновый) каучук нестереорегулярен.
Впервые синтез каучука из бутадиена методом анионной полимеризации с применением металлического натрия в промышленных масштабах был осуществлен в нашей стране.
Мономеры, вступающие в анионную полимеризацию, по реакционной активности можно расположить в ряд:
акрилонитрил > метакрилонитрил > метилметакрилат > стирол > бутадиен.
Сейчас методом анионной полимеризации осуществляется промышленное производство полиамидов, полимеров формальдегида, этиленоксида, силоксанов, каучуков.
8.1.2.3. Ионно-координационная полимеризация
Иногда называется стереоспецифической полимеризацией и отличается от ионной тем, что акту присоединения мономера предшествует его координация на активном центре или катализаторе. Координация мономера может иметь место как при анионной (что более характерно), так и при катионной полимеризации.
Анионно-координационная полимеризация диенов
В зависимости от условий полимеризации в полимерной цепи изопрена 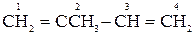
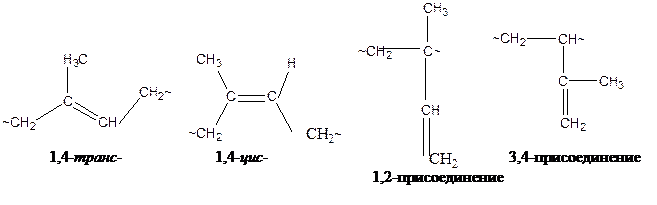 |
Цифры в названиях изомерных звеньев обозначают номер атома углерода, входящего в основную цепь молекулы изопрена.
Впервые полимеризацию изопрена в присутствии катализатора – металлического натрия – осуществил в 1932 году С. В. Лебедев, что привело к созданию промышленности синтетического каучука в России. В 1954 году А. А. Коротков получил из изопрена стереорегулярный каучук, применив в качестве катализатора литийорганические соединения. При полимеризации на литии или литийорганических соединениях стереорегулярный 1,4-цис -полиизопрен образуется лишь в углеводородных средах. Это объясняется координацией мономера на полярном, но не диссоциированном активном центре −С δ– −L δ+ , в результате чего мономерное звено принимает конфигурацию, соответствующую 1,4-цис -структуре:
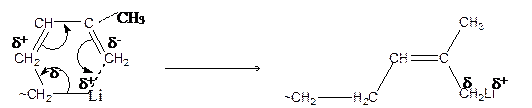 |
Добавление всего лишь нескольких процентов электронодонорных соединений – эфира, тетрагидрофурана, алкиламинов и других веществ – резко изменяет микроструктуру образующегося полиизопрена – становится преобладающей 1,4-транс- (80–90 %) и 3,4-структура (10–20 %). Электронодорное соединение способствует поляризации связи С−Li до разделения на ионы:
В этом случае микроструктуру цепи полимера определяет координация иона Li + с концевым звеном макроиона, которое имеет аллильную структуру. В аллильной структуре p-электроны делокализованы и, следовательно, два крайних атома углерода по электронной плотности эквивалентны. Для карбаниона это выражается следующим образом:
 |
С учетом этого координацию иона Li + с конечным звеном цепи изопрена, несущим заряд, можно представить циклической структурой.
Мономер может присоединяться как к первому, так и к третьему атому углерода, что приводит к 1,4-транс- или 3,4-структуре.
Полимеризация на катализаторах Циглера – Натта
В 1955 году немецкий химик Карл Циглер предложил каталитическую систему, состоящую из триэтилалюминия (С2 Н5 )3 Al и хлорида титана TiCl4 , для синтеза полиэтилена в мягких условиях – при температуре 50–80 °С и давлениях, не превышающих 1 МПа. Затем итальянский химик Джулио Натта использовал этот катализатор для получения кристаллизующихся полипропилена и полистирола. Для объяснения причины кристаллизации этих полимеров он впервые ввел понятие о стереорегулярных макромолекулах.
В настоящее время к группе катализаторов Циглера – Натта относят каталитические системы, образующиеся при взаимодействии органических соединений непереходных элементов I–III групп и солей переходных элементов IV–VIII групп. Известны гетерогенные и гомогенные катализаторы Циглера – Натта. На первых в основном получаются изотактические полимеры, на вторых могут быть получены также и синдиотактические.
Механизм анионно-координационной полимеризации в присутствии катализатора Циглера – Натта можно представить следующим образом. При взаимодействии Al(C2 H5 )3 и TiCl4 образуется активный комплекс:

Выпавший из раствора TiCl3 адсорбируется поверхностью хлордиэтилалюминия, создавая центры активации, к которым присоединяются молекулы мономера путем внедрения между атомом алюминия и этильной группой. Все последующие акты присоединения мономеров протекают с удлинением углеродной цепи комплекса:




При распаде комплекса образуется смесь высокомолекулярных продуктов стереорегулярного строения:



Сополимеризация – процесс образования сополимеров совместной полимеризацией двух или нескольких различных по природе мономеров. Этим методом получают высокомолекулярные соединения с широким диапазоном физических и химических свойств. Например, в результате сополимеризации бутадиена с акрилонитрилом образуется бутадиеннитрильный каучук (СКН), обладающий высокой стойкостью к маслам и бензинам. Из него изготовляют уплотнительные прокладки для деталей, соприкасающихся с маслами и растворителями:


Сополимеризацией изобутилена с изопреном получают бутилкаучук с высокой газонепроницаемостью:


На химическое состояние сополимеров в ионной сополимеризации оказывают влияние катализатор и растворитель.
При сополимеризации мономеры могут вести себя несколько иначе, чем при их раздельной полимеризации. В этом случае проявляется взаимное влияние различных мономеров, в результате чего реакционная способность одного из них сильно зависит от природы второго. Процесс сополимеризации еще более усложняется, если в реакции участвует несколько мономеров.
Сополимеризация широко используется в практике, поскольку является простым и очень эффективным методом модификации свойств крупнотоннажных полимеров. Наиболее распространена и изучена двухкомпонентная или бинарная сополимеризация.
Макромолекулы сополимеров состоят из элементарных звеньев всех мономеров, присутствующих в исходной реакционной смеси. Каждый мономер придает сополимеру, в состав которого он входит, свои свойства, при этом свойства сополимера не являются простой суммой свойств отдельных гомополимеров. Так, содержание небольшого количества стирола в цепях поливинилацетата повышает температуру стеклования последнего, устраняет свойство хладотекучести и увеличивает его поверхностную твердость.
Закономерности сополимеризации значительно сложнее, чем закономерности гомополимеризации. Если при гомополимеризации имеется один тип растущего радикала и один мономер, то при бинарной сополимеризации, в которой участвует всего два мономера, существует по крайней мере четыре типа растущих радикалов. Действительно, если два мономера А и В взаимодействуют со свободными радикалами R · , возникшими при распаде инициатора, образуются первичные радикалы, один из которых имеет концевое звено А , а второй – В :
Каждый первичный радикал может реагировать как с мономером А , так и с мономером В.
Реакции сополимеризации могут протекать как по радикальному, так и по ионному механизму. При ионной сополимеризации значительное влияние на процесс оказывает природа катализатора и растворителя. Поэтому сополимеры, получаемые из одних и тех же сомономеров при одинаковом исходном соотношении в присутствии разных катализаторов, имеют разный химический состав. Так, сополимер стирола и акрилонитрила, синтезированный в присутствии пероксидов, содержит 58 % стирольных звеньев. Вместе с тем, при анионной сополимеризации на катализаторе С6 Н5 MgBr содержание в макромолекулах звеньев стирола составляет 1 %, а при катионной полимеризации в присутствии SnCl4 – 99 %.
В практическом отношении интересны блок- и привитые сополимеры. В макромолекулах этих сополимеров существуют участки большой протяженности из звеньев обоих сомономеров.
Блоксополимеры получают разными методами. Во-первых, при анионной полимеризации одного мономера возникающие «живые» цепи, то есть макромолекулы, могут инициировать полимеризацию другого мономера
Во-вторых, при интенсивном механическом воздействии на разные полимеры происходит деструкция цепей и образование макрорадикалов. Макрорадикалы, взаимодействуя между собой, формируют блоксополимеры.
Блоксополимеры могут образовываться также из олигомеров за счет взаимодействия концевых групп.
Привитые сополимеры получают, как правило, взаимодействием мономера с полимером и реже взаимодействием двух разных полимеров между собой. Так как в этих процессах используются реакции передачи цепи с превращением полимерных молекул в макрорадикалы, в состав макромолекул часто вводят атомы или группы с повышенной подвижностью (например, бром), что ускоряет реакцию передачи цепи. Так, если в реакционной среде находится полимер на основе мономера СН2 =СНХ , мономер СН2 =СНY и инициатор, процесс образования привитого сополимера протекает так:
Сначала возникает макрорадикал:
Затем этот макрорадикал инициирует полимеризацию мономера с образованием боковых ветвей:
Получение блок- и привитых сополимеров почти всегда сопровождается образованием гомополимеров из присутствующих в зоне реакции мономеров.
8.3. Способы полимеризации
Способы проведения процессов полимеризации очень разнообразны. В промышленности применяют следующие способы полимеризации: блочный, в растворителе, эмульсионный, суспензионный, в твердой и газовой фазе.
А. Полимеризация в газовой фазе используется для получения ограниченного числа полимеров. Мономер – газ. Важным преимуществом газофазного способа является отсутствие растворителя и необходимости выделения готового полимера из раствора. Промышленное значение в настоящее время имеет лишь газофазная полимеризация этилена, протекающая в присутствии небольшого количества кислорода, играющего роль инициатора, при высоком давлении – до 2000 атм.
Б. Полимеризация в твердой фазе . Ее природа пока не установлена (ионный или радикальный характер). Особенность этой полимеризации в том, что она протекает при температурах ниже температуры плавления полимеров. Отсутствие жидкой фазы ограничивает возможность инициирования процесса, в частности возможность тепловой активации. Поэтому наиболее употребительными методами инициирования в твердой фазе являются радиационно-химические и фотохимические
В. Полимеризации в блоке подвергаются жидкие мономеры в присутствии растворенных в них инициаторов (могут быть органические примеси). Такую полимеризацию можно осуществлять по периодическому и непрерывному способу. В первом случае полимер образуется в формах, помещаемых в обогреваемые камеры. В зависимости от используемой формы готовое изделие может иметь вид пластины, трубы и т. д. Непрерывная полимеризация проводится в полимеризационных башнях. Мономер, проходя через башню, попадает в зоны с различной температурой, повышающейся в направлении продвижения полимера. В последнюю зону поступает готовый полимер, где он расплавляется и выдавливается в виде жгутов, которые нарезаются на гранулы (так получают, например, прозрачное органическое стекло из стирола и метилметакрилата).
Г. Полимеризация в растворителях осуществляется в среде, растворяющей либо мономер и полимер, либо только мономер. В первом случае продукт реакции – раствор полимера в растворителе. Этот продукт используют в виде лака или отделяют полимер от растворителя. Отделяют полимер отгонкой растворителя либо осаждением полимера, добавляя осадитель (например, воду). Во втором случае полимер по мере образования выпадает в твердом виде и может быть отделен фильтрованием. В растворе проводят главным образом ионную полимеризацию.
Д. Полимеризация в эмульсиях протекает с большими скоростями и позволяет получать полимеры с высокомолекулярной массой в виде порошка или водных эмульсий. При эмульсионной полимеризации мономер находится в диспергированном состоянии в водной среде, содержащей эмульгатор. Продукт полимеризации – водная дисперсия полимера – латекс . Выделяют полимер из латекса добавлением электролита для разрушения поверхностной пленки эмульгатора.
Е. Суспензионную полимеризацию проводят в жидкости, не растворяющей мономер, обычно в воде. Размер капель мономера в водной фазе в сотни раз больше (от 1 мкм до 1 мм), чем при эмульсионной полимеризации. Также добавляются эмульгаторы, образующие с каплями мономера дисперсию. Инициаторы – органические пероксиды, растворимые в мономере (не в воде). Получаемые частицы имеют форму бисера или гранул. Полимер легко отделяется от водной фазы в центрифуге без специальной коагуляции. Стабилизаторы суспензии легко отмываются с поверхности гранул, полимер содержит мало примесей. Недостаток метода – загрязнение сточных вод.
8.4. Высокомолекулярные соединения, получаемые
Наиболее распространенные ВМС, полученные методом полимеризации, относятся к группе виниловых полимеров с общей формулой
Свойства, структура, условия получения и области применения некоторых важнейших полимеров этого типа представлены в табл. 2.
Полимеры, получаемые реакцией полимеризации
Источник







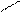
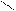
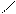
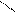


 0,816 нм
0,816 нм
 Н3 С СН2
Н3 С СН2 

 Н3 С СН2 С=СН СН2 −…
Н3 С СН2 С=СН СН2 −…
 −СН2
−СН2 


 0,48 нм 0,48 нм
0,48 нм 0,48 нм

 …−СН2 −СН−СН2 −СН−СН−СН2 −…
…−СН2 −СН−СН2 −СН−СН−СН2 −… −В−В−В−В−…
−В−В−В−В−… …−А−А−А−А−А−А−А−…
…−А−А−А−А−А−А−А−… (−СН2 −СН–)n
(−СН2 −СН–)n  ( –
( –  – )n
– )n  (−СН2 −СН–)n
(−СН2 −СН–)n  (−СН2 −СН−)n
(−СН2 −СН−)n  Cl
Cl (−СН2 −С−)n
(−СН2 −С−)n 
 …−СН2 −СН−СН2 −СН−…
…−СН2 −СН−СН2 −СН−… ОН
ОН


 СН2
СН2 




 ОН ОН
ОН ОН F F
F F
 (−С−С−)n
(−С−С−)n  (−СН2 −СН−)n
(−СН2 −СН−)n  (−СН2 −СН−)n
(−СН2 −СН−)n  Кристаллическая зона
Кристаллическая зона
 (−СН2 −СН−)n
(−СН2 −СН−)n  . −CH2 −ĊH−CH2 −CH2 −CH2 −…
. −CH2 −ĊH−CH2 −CH2 −CH2 −… Н
Н → . CH2 −CH−CH2 −CH2 −CH2 −…
→ . CH2 −CH−CH2 −CH2 −CH2 −…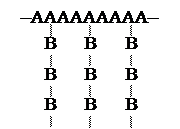 Реакции передачи цепи этого типа бывают межмолекулярными, приводящими к длинным боковым цепям, или внутримолекулярными, дающими короткие ответвления. В зависимости от легкости протекания процессов ветвления боковые цепи разветвленного полимера сами могут иметь разветвления, образуя дендритную структуру (греч. dendron – дерево). Соответствующий подбор мономеров при сополимеризации и условий синтеза обеспечивает получение линейных сополимеров, в которых структурные звенья чередуются −АВАВАВАВ− или содержатся в форме регулярных блоков с линейным расположением −АААААВВВВВ−, а также получение привитых сополимеров
Реакции передачи цепи этого типа бывают межмолекулярными, приводящими к длинным боковым цепям, или внутримолекулярными, дающими короткие ответвления. В зависимости от легкости протекания процессов ветвления боковые цепи разветвленного полимера сами могут иметь разветвления, образуя дендритную структуру (греч. dendron – дерево). Соответствующий подбор мономеров при сополимеризации и условий синтеза обеспечивает получение линейных сополимеров, в которых структурные звенья чередуются −АВАВАВАВ− или содержатся в форме регулярных блоков с линейным расположением −АААААВВВВВ−, а также получение привитых сополимеров СН2 =СН
СН2 =СН



 Н
Н . −СН2 −С*−.
. −СН2 −С*−.

 СН3 СН3 СН3 СН3
СН3 СН3 СН3 СН3 




 С * С * С * С *
С * С * С * С * Схематично:
Схематично:

 Н Х Х Н
Н Х Х Н Н Н или Н Н
Н Н или Н Н






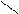
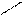

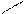

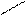
 С * С * С * С *
С * С * С * С *
 Х Н
Х Н


 Н Н СН3 Н СН3
Н Н СН3 Н СН3 




 С * С * С * С * С *
С * С * С * С * С *
 Н Х
Н Х  Н Н
Н Н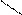 СН3
СН3 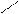
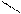
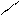

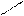
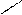 −СН2 СН2 С=СН
−СН2 СН2 С=СН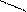
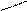
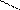 СН3 СН2 −СН2
СН3 СН2 −СН2 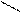
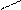
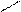 С=СН С=СН
С=СН С=СН X
X 
 CH=CH2 x −C=CH2
CH=CH2 x −C=CH2  −CH2 −C− −CH2 −C−
−CH2 −C− −CH2 −C− CH2 =CH−CH=CHCH3 → (−CH2 −CH=CH−C−) *
CH2 =CH−CH=CHCH3 → (−CH2 −CH=CH−C−) *