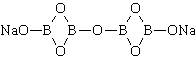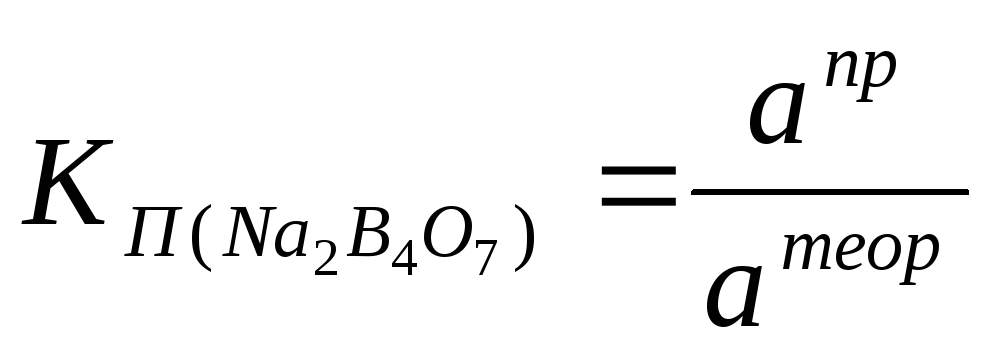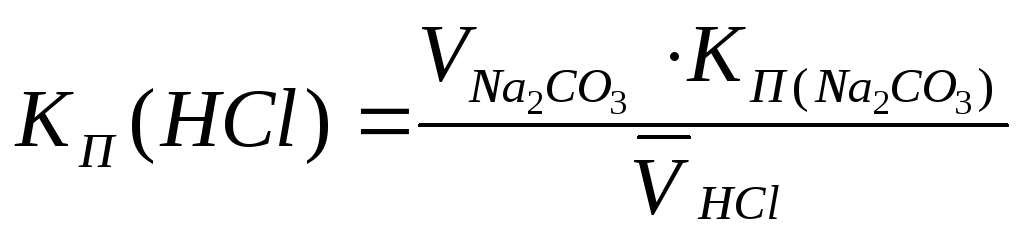Способы получения тетрабората натрия
Описание. Белые прозрачные легковыветривающиеся кристаллы или белый кристаллический порошок. Водный раствор имеет щелочную реакцию. Реакция глицериновых растворов кислая.
Получение. Минерал – бура; действие горячего раствора карбоната натрия на борокальциты или борную кислоту:
Растворимость. Растворим в воде, практически нерастворим в спирте, легко растворим в глицерине.
Подлинность. Реакция с куркумином (ГФ Х) Куркумовая бумага окрашивается в розовый или буровато-красный цвет ( SHAPE \* MERGEFORMAT 
Примеси. Допустимые: мышьяк, хлориды, сульфаты, железо.
1. Прямая ацидиметрия (ГФ Х):
Титрант – HCl , индикатор – метиловый оранжевый:
f экв ( Na 2 B 4 O 7 )=1/2, 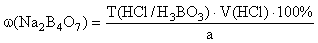
Хранение. В хорошо укупоренной таре.
Применение. Детоксицирующее и десенсибилизирующее средство (внутрь и внутривенно); инсектицид (наружно).
Источник
Способы получения тетрабората натрия
БУРА (декагидрат тетрабората натрия Na2B4O7·10 H2O) – большие бесцветные кристаллы, растворимые в воде, которые в сухом воздухе выветриваются c поверхности и плавятся при 61° С, при 320–380° С теряет кристаллизацонную воду. Безводный тетраборат натрия – бесцветное кристаллическое вещество с плотностью 2,367 г/см3, плавится при 741° С без разложения. Термически неустойчивым тетраборат натрия становится только при 1575° С. Коэффициент растворимости (в г на 100 г воды) равен 2,5 (при 20° С) и 24,3 (при 80° С).
В природе бура встречается главным образом в воде и донных осадках некоторых озер. Такие озера – не редкость в Индии и Тибете; природная бура из тех мест – минерал тинкал. В средневековые времена добытую здесь буру грузили в мешки из слоновых шкур и везли в Венецию, где очищали от примесей путем кристаллизации из водного раствора. Способы получения буры сохранялись в строжайшей тайне, их не знали даже европейские алхимики.
Тем не менее, алхимики отличали буру от соды, хотя как именно они это делали, неизвестно: ведь оба вещества схожи в том, что дают щелочную среду при растворении в воде и поэтому вытесняют аммиак из хлорида аммония.
Щелочная реакция раствора тетрабората натрия обусловлена тем, что в водном
растворе протекает реакция гидролиза c образованием в растворе борной кислоты B(OH) 3:
B4O7 2– + 7H2O 
а выделение аммиака при взаимодействии с NH4Cl отвечает уравнению:
Хотя в 16–17 вв. химики не имели представления о точном составе получаемых и используемых ими веществ, а об их свойствах судили по самым примитивным признакам, вроде пробы на вкус, им удавалось иногда сделать замечательные открытия. Так, голландский алхимик Вильгельм Гомберг, нагревая буру с серной кислотой H2SO4, выделил борную кислоту B(OH)3.
При этом протекала реакция:
А в 1751 Анри Дюамель де Монсо установил, что в составе буры, как и в составе соды, содержится элемент «натр». Можно только догадываться, как именно за три тысячи лет до нашей эры люди натолкнулись на буру. Возможно, индус-паломник, отдыхая на берегу озера, бросил в костер кусок неведомого белого вещества и заметил, что пламя стало зеленым, а вещество оплавилось и стало похоже на стекло. С этими особенностями буры были знакомы и жрецы Древнего Египта, которые умели делать пламя светильников зеленым. Позже, вероятно, обнаружили, что бура, как и сода, помогает отстирывать одежду от грязи (мыла еще не было). Постепенно люди научились использовать буру для дубления кож, в производстве стекла и глазурей, наконец, как лекарство – антисептик для промывания горла. Первое упоминание о буре в России встречается в 1709 в приходно-расходной книге Приказа рудных дел. В делах Петра I была найдена записка о необходимости получения буры из российских природных источников, которых оказалось немало. Тем не менее, буру еще долгое время ввозили в Россию из Венеции и из Англии.
В настоящее время буру используют очень широко: это антисептик и консервант, протрава (предварительная пропитка) для окрашивания тканей, сырье для получения борной кислоты, гербицидов, средств замедления коррозии (ингибиторов), моющих средств (умягчитель воды). Кроме того, бура служит одним из компонентов шихты (исходной смеси веществ) при получении глазурей, стекла и керамики.
Каждый ювелирных дел мастер привык иметь дело с бурой – это незаменимая составная часть флюсов при сварке и спайке благородных металлов (золота и серебра).
Источник
Тетраборат натрия
Термин «Бура» применяют по отношению к нескольким близким веществам: она может существовать в безводной форме, в природе чаще встречается в виде пятиводного или десятиводного кристаллогидрата:
Однако наиболее часто слово бура относят к соединению Na2B4O7·10H2O.
Тетраборат натрия (Бура) встречается в солевых отложениях, образованных при испарении сезонных озёр
Бура́ (декагидрат тетрабората натрия, Na2B4O7 · 10H2O) — прозрачные кристаллы, при нагревании до 400 °C полностью теряют воду. В воде бурагидролизуется, ее водный раствор имеет щелочную реакцию. С оксидами многих металлов бура при нагревани образует окрашенные соединения — бораты («перлы буры»).
Способы получения буры сохранялись в строжайшей тайне, их не знали даже европейские алхимики.
Тем не менее, алхимики отличали буру от соды, хотя как именно они это делали, неизвестно: ведь оба вещества схожи в том, что дают щелочную среду при растворении в воде и поэтому вытесняют аммиак из хлорида аммония.
Щелочная реакция раствора тетрабората натрия обусловлена тем, что в водном растворе протекает реакция гидролиза c образованием в растворе борной кислоты B(OH) 3:
а выделение аммиака при взаимодействии с NH4Cl отвечает уравнению:
Хотя в 16–17 вв. химики не имели представления о точном составе получаемых и используемых ими веществ, а об их свойствах судили по самым примитивным признакам, вроде пробы на вкус, им удавалось иногда сделать замечательные открытия. Так, голландский алхимик Вильгельм Гомберг, нагревая буру с серной кислотой H2SO4, выделил борную кислоту B(OH)3.
При этом протекала реакция:
А в 1751 Анри Дюамель де Монсо установил, что в составе буры, как и в составе соды, содержится элемент «натр». Можно только догадываться, как именно за три тысячи лет до нашей эры люди натолкнулись на буру. Возможно, индус-паломник, отдыхая на берегу озера, бросил в костер кусок неведомого белого вещества и заметил, что пламя стало зеленым, а вещество оплавилось и стало похоже на стекло. Позже, вероятно, обнаружили, что бура, как и сода, помогает отстирывать одежду от грязи (мыла еще не было). Постепенно люди научились использовать буру для дубления кож, в производстве стекла и глазурей, наконец, как лекарство – антисептик для промывания горла.
Аналитические реакции на катион натрия.
1. Реакция с ацетатом диоксоуран(VI)цинка Zn(UO2)3(CH3COO)8 c образованием жёлтого кристаллического осадка (фармакопейная реакция — ГФ) или жёлтых кристаллов тетра- и октаэдрической формы, нерастворимых в уксусной кислоте (МКС). Для повышения чувствительности реакции следует нагреть исследуемую смесь на предметном стекле.
NaCl + Zn(UO2)3(CH3COO)8 + CH3COOН + 9 H2O
Мешающие ионы: избыток ионов K + , катионы тяжёлых металлов (Hg2 2+ , Hg 2+ , Sn 2+ , Sb 3+ , Bi 3+ , Fe 3+ и др.). Реакция используется как дробная после удаления мешающих катионов.
2. Окрашивание бесцветного пламени горелки в жёлтый цвет (ГФ).
3. Реакция с пикриновой кислотой с образованием кристаллов пикрата натрия жёлтого цвета игольчатой формы, исходящих из одной точки (МКС).
Error: Reference source not found
Реакция используется как дробная только в отсутствие мешающих ионов (K + , NH4 + , Ag + ).
4. Реакция с гексагидроксостибатом(V) калия K[Sb(OH)6] с образованием белого кристаллического осадка, растворимого в щелочах.
NaCl + K[Sb(OH)6] 
Условия проведения реакции: а) достаточная концентрация Na + ; б) нейтральная реакция раствора; в) проведение реакции на холоду; г) потирание стеклянной палочкой о стенку пробирки. Мешающие ионы: NH4 + , Mg 2+ и др.
В кислой среде реагент разрушается с образованием белого аморфного осадка метасурьмяной кислоты HSbO3.
K[Sb(OH)6] + HCl 
H3SbO4 
Аналитические реакции на -ион.
1. С групповым реагентом BaCl2 + CaCl2
2. С куркумовой бумагой (ГФ).
Куркумовая бумага, смоченная раствором тетрабората натрия (или ортоборной кислоты) и несколькими каплями разбавленной хлороводородной кислоты, окрашивается при высушивании в розовый цвет, переходящий в зеленовато-чёрный при дальнейшем смачивании бумаги раствором аммиака. Мешают анионы-окислители, обесцвечивающие куркумовую бумагу.
3. Реакция этерификации с этиловым спиртом в присутствии концентрированной серной кислоты.
Na2B4O7 + H2SO4 + 5 H2O 
H3BO3 + 3 C2H5OH 
Методика: 0,2 г борной кислоты (или тетрабората натрия) помещают в фарфоровую чашку. Для дробного открытия выпаривают досуха 1 см 3 испытуемого раствора в фарфоровой чашке, прибавляют 1 см 3 концентрированной серной кислоты, 3 см 3 этанола и перемешивают. При зажигании смесь горит пламенем, окаймленным зелёным цветом. Выполнению реакции мешают хлорид-, бромид-, иодид-ионы. Их удаляют выпариванием с серной кислотой до появления «белого дыма».
Стандартизация 0,1 М раствора хлороводородной кислоты
по стандартному раствору тетрабората натрия (способ пипетирования)
А. Приготовление стандартного 0,1 М раствора тетрабората натрия Методика приготовления титрованного раствора по точной навеске приведена в таблице «Способы приготовления титрованных растворов» (тетраборат натрия растворяют в горячей воде) см. табл. 1 стр. 21.
Поправочный коэффициент раствора КП рассчитывают по формуле:
а пр – практическая навеска тетрабората натрия, г
а теор – навеска теоретическая тетрабората натрия, г.
Б. Установка КП 0,1 М раствора хлороводородной кислоты
Методика: Точно отмеривают пипеткой 10-15 см 3 стандартного раствора тетрабората натрия в колбу для титрования, прибавляют 1-2 капли раствора метилового оранжевого и титруют 0,1 М раствором хлороводородной кислоты до перехода жёлтой окраски в розовато-оранжевую.
Здесь и далее расчёт КП раствора с точностью до четвёртого знака после запятой, исходя из основного уравнения титриметрического анализа, производят по среднему значению из трёх параллельных титрований
в производстве эмалей, глазурей, оптических и цветных стекол;
при пайке в качестве флюса;
в бумажной и фармацевтической промышленности;
как дезинфицирующее и консервирующее средство;
в аналитической химии:
как стандартное вещество для определения концентрации растворов кислот;
для качественного определения оксидов металлов (по цвету перлов);
в фотографии — в составе медленно действующих проявителей в качестве слабого ускоряющего вещества; [1]
Источник
Тетраборат натрия
| Тетраборат натрия | |
|---|---|
 | |
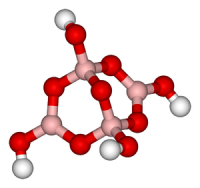 | |
| Традиционные названия | бура, боракс |
| Хим. формула | Na2B4O7 |
| Состояние | кристаллы |
| Молярная масса | 201,22 г/моль |
| Плотность | 2,37 ± 0,01 г/см³ |
| Т. плав. | 664 °C (β-модификация) 710 °C (γ-модификация) |
| Т. кип. | 1575 °C |
| Т. разл. | 2867 ± 1 °F |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 3,2 г/100 мл (25 °C) 10,5 г/100 мл (50 °C) |
| Растворимость в этаноле | 0,05 г/100 мл |
| Растворимость в ацетоне | 0,006 г/100 мл |
| ГОСТ | ГОСТ 8429-77 |
| PubChem | 10219853 |
| SMILES | |
| Кодекс Алиментариус | E285 |
| RTECS | VZ2275000 и ED4588000 |
| ChemSpider | 8395345 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Тетраборат натрия («бура», «боракс» (от лат. borax )) — неорганическое соединение, натриевая соль борной кислоты с химической формулой Na2B4O7, наиболее распространённое и используемое соединение бора, образует несколько кристаллогидратов, широко применяется в промышленности.
Содержание
Физические свойства
Имеет две метастабильные модификации: β и γ. β-модификация является ромбической с температурой плавления 664 °C, γ-модификация — моноклинная с температурой плавления 710 °C. Температура кипения — 1575 °C. Расплав застывает в стекловидную массу с плотностью 2,36 г/см 3 .
Химические свойства
Растворимость в воде составляет 3,2 г / 100 мл (25 °C), 10,5 г / 100 мл (50 °C), в этаноле — 0,05 г / 100 г (25 °C), ацетоне — 0,006 г / 100 г (25 °C), не растворим в диэтиловом эфире и глицерине. Реагирует с метанолом при растворении с образованием бороорганических соединений.
Образует несколько кристаллогидратов с разным содержанием воды. Эти кристаллогидраты и безводный тетраборат натрия Na2B4O7 обычно называют «бура». Примеры кристаллогидратов:
Однако наиболее часто «бурой» называют декагидрат Na2B4O7·10H2O. Эта соль представляет собой прозрачные кристаллы с молярной массой 381,43 г/моль, имеющие хорошую растворимость в тёплой воде. При нагревании свыше 400 °C полностью теряет кристаллизационную воду.
Так как тетраборат натрия является солью слабой кислоты и сильного основания, в воде гидролизуется. Водный раствор тетрабората натрия имеет щелочную реакцию.
Взаимодействует с сильными кислотами, образуя соответствующую соль и борную кислоту:
Многие соли металлов борной кислоты нерастворимы в воде и при взаимодействии в растворе их растворимых солей с тетраборатом натрия образующиеся бораты выпадают в осадок. На этом основано применение буры для «умягчения» воды:
С оксидами многих переходных металлов бура при сплавлении образует разнообразно окрашенные соединения — бораты «перлы буры». По окраске перлов можно судить о качественном химическом составе пробы.
Окрашивает пламя горелки в зелёный цвет (характерная реакция на соединения бора).
Получение
Десятиводную соль Na2B4O7·10H2O получают из природных минералов, например, буры или кернита, осуществляя их перекристаллизацию. Также для этой цели применяют химическое взаимодействие некоторых природных боратов (ашарита и улексита) с карбонатом или гидрокарбонатом натрия.
Может быть получен реакцией карбоната натрия и борной кислоты при нагреве, пропусканием углекислого газа через растворметабората натрия.
Применение
Тетраборат натрия применяется:
- как сырьё для получения борной кислоты и различных соединений бора;
- в производстве эмалей, глазурей, оптических и цветных стёкол, различных керамик;
- при пайке и плавке металлов в составе флюса;
- в бумажной и фармацевтической промышленности;
- в производстве строительных материалов как компонент антисептика для изготовления целлюлозного утеплителя «Эковата»
- как дезинфицирующее и консервирующее средство;
- для приготовления буферных растворов;
- в аналитической химии:
- как стандартное вещество для определения концентрации растворов кислот;
- для качественного определения оксидов металлов (по цвету перлов);
- в фотографии — в составе медленно действующих проявителей в качестве слабого ускоряющего вещества;
- как компонент моющих средств;
- как компонент косметики;
- как инсектицид в отравленных приманках для уничтожения тараканов.
В 1977 году мировое производство тетрабората натрия составило 1,5 млн тонн.
Нахождение в природе
Существуют многочисленные минералы, содержащие тетраборат натрия. К ним относятся:
- бура (боракс, тинкал) — минерал состава Na2B4O7·10H2O — декагидрат тетрабората натрия;
- кернит — тетрагидрат тетрабората натрия — Na2B4O7·4H2O;
- многочисленные минералы класса боратов, в которых помимо оксидов натрия и бора содержатся другие металлы, — кальций, магний, железо и др.;
- кристаллогидраты тетрабората натрия выпадают в осадок при пересыхании некоторых бессточных, сезонно пересыхающих солёных озёр, например, в озере Серлс, расположенном в пустыне Мохаве в США, и некоторых озёр в Турции.
Источник