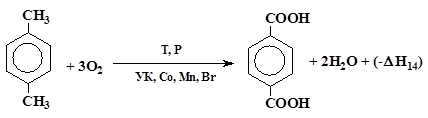Способы получения терефталевой кислоты
Области применения терефталевой кислоты
Из терефталевой кислоты синтезируют прозрачный термостойкий полимер полиэтилентерефталат. Его получают в результате поликонденсации этиленгликоля с терефталевой кислотой. Из него делают бутылки, полиэфирное волокно терилен (другое, более распространенное название – лавсан является сокращением от «ЛАборатория Высокомолекулярных Соединений Академии Наук»), упаковочные материалы, в том числе для пищевой промышленности, радиодеталей, химического оборудования
Для получения ПЭТФ пищевого назначения большое значение имеет содержание в ТФК примесей — продуктов неполного окисления параксилола, то есть необходима терефталевая кислота марки А, с минимальным содержанием примесей.
Исходя из этого, объемы производства терефталевой кислоты определяются в основном спросом со стороны производителей полиэфирной продукции. При этом спрос на ПЭТ пищевого назначения будет ниже по сравнению со спросом продукта на полиэтилентерефталат для производства.
Большое значение имеют эфиры терефталевой кислоты – диэтилтерефталат и диметилтерефталат.
В настоящее время довольно много крупных фирм в мире работают над проблемой получения диметилтерефталата в основном двумя путями:
1) этерификация метанолом «сырой» терефталевой кислоты (американские фирмы «Eastman Kodak», «Du Pont», японские «Toray Industries», «Kararay Vuka» и др.);
2) окисление параксилола до п-терефталевой кислоты, ее этерификация метанолом, последующее окисление метильной группы до кислотной и превращение в диметилтерефталат или совместное окисление параксилола, метилового эфира п-терефталевой кислоты и монометилового эфира терефталевой кислоты и последующая их этерификация.
Диметиловый эфир терефталевой кислоты является одним из важнейших химических продуктов, используемых для производства полиэфирных волокон, полиоксадиазолов, полибензимидазолов, алкидных смол и пластификаторов.
Можно утверждать, что терефталевая кислота и диметиловый эфир терефталевой кислоты являются важнейшими мономерами для производства полиэфирных. Одновременно они являются конкурентами за право считаться основным исходным мономером. До середины восьмидесятых годов производство диметилтерефталата было намного больше, чем производство терефталевой кислоты. Но в последнее десятилетие были разработаны способы получения ТФК высокой частоты, поэтому сейчас производство обоих материалов находится на довольно высоком уровне.
В отличие от полиэтилентерефталата, прежде всего известного своим применением в текстильной промышленности (полиэфирные волокна) и производстве пластиковых бутылок, ПБТ получил широкое распространение, именно, как конструкционный пластик. Области его применения включают машиностроение, автомобильную промышленность, электротехнику и электронику, радиотехнику, точную механику, бытовую технику, товары широкого потребления.
Полибутилентерефталат получают в две стадии по периодической или непрерывной схеме. На первой стадии синтезируют бис-(4-гидроксибутил)терефталат, на второй — проводят поликонденсацию. Бис-(4-Гидроксибутил)терефталат получают этерифика-цией терефталевой кислоты или переэтерификацией диметилтерефталата (этот метод преобладает в промышленности) 1,4-бутилен-гликолем.
Свойства терефталевой кислоты
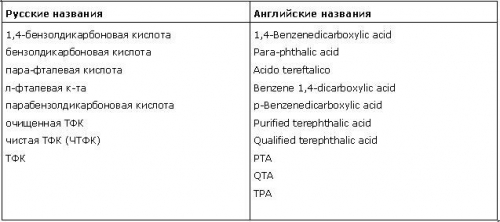
Таблица 1. Терефталевая кислота: синонимы и сокращения
Терефталевая кислота (ТФК) — бесцветное кристаллическое вещество, слабо растворима в воде, спиртах, диметилсульфоксиде. Терефталевая кислота представляет собой чистый белый порошок, получаемый путем окисления параксилола при наличии катализаторов и уксусной кислоты. Не образует мономерного ангидрида; при нагревании с уксусным ангидридом превращается в полимерный ангидрид. Взаимодействие терефталевой кислоты со спиртами приводит к образованию эфиров, из которых наиболее практическое значение имеет диметилтерефталат.
Таблица 2. Свойства терефталевой кислоты
Источник
Терефталевая кислота. Свойства, производство, применение и цена терефталевой кислоты
В Великобритании закрыли Lotte Chemical. Это дочерняя фирма одной из корейских компаний. Закрыт не весь завод , а блок производства терефталевой кислоты. Получение ее стало нерентабельным.
При этом, мировое потребление соединения растет. В чем логика? Учитывая спрос на реагент, его производство стали наращивать предприятия Китая . Завод Великобритании не выдержал ценовой конкуренции.
Стало выгоднее закупать сырье из Поднебесной, чем производить его самим. Только вот, зачем промышленникам нужна терефталевая кислота? Начнем с перечисления ее свойств. Они дадут понимание, где может пригодиться реагент.
Свойства терефталевой кислоты
Кислота относится к бензополикарбоновым. Карбоновыми именуют соединения с карбоксильными группами СООН. Под поликислотами подразумеваются те, в которых минимум 2 окисла. В каждом есть кислород. Собственно, поэтому фрагменты и названы окислами. Второй элемент , как правило, — неметалл.
Приставка «бензо» добавляется к названиям кислот , имеющим связь с бензилтолуолами. Это ароматические углеводороды, составные которых входят в терефталевую кислоту. Формула ее:- C8H6O4. Бензольное кольцо располагается посередине молекулы. Карбоксильные группы – по краям. Пространственная запись выглядит так: —
Теперь разберемся в секрете названия героини статьи . Фталевые кислоты – это класс простейших, двухосновных кислот с формулой C6H4 (CO2H)2. Терефталевое соединение является изомером обычного фталевого. Иначе говоря, состав у героини статьи такой же, молекулярная масса тоже, а вот строение иное. У фталевой версии оно такое: —
Внешне вещество кристаллическое. Агрегаты белесые. Запаха у них нет, на вкус кисловаты. Плавится порошок при 300-от градусах Цельсия. Если довести температуру до 496-ти, соединение самовоспламениться.
Однако, уже при 200-от градусах происходит декарбоксилирование. Так именую процесс отсоединение части карбоксильных групп. В итоге, образуются несколько соединений, в которых фрагментов COOH меньше, чем в исходной кислоте .
Растворить терефталевую кислоту в воде, хоть грей, хоть нет, невозможно. Зато, вещество взаимодействует с водными растворами щелочей. Эфир терефталевой кислоты можно получить, совместив ее со спиртом.
Так формируют, к примеру, демитилтерефталат. Он «рождается» при слиянии кислоты с метанолом. Продукт их реакции раздражает слизистые, зато, идеален для создания полимерных волокон и пленок.
Сложный эфир можно получить, совместив терефталевую кислоту и этиленгликоль. Продукт реакции тоже пригоден для пленок. А вот как используют саму терефталевую кислоту ? Вопрос поставлен. Настало время ответа.
Применение терефталевой кислоты
Терефталевая кислота применение нашла в области производства полимеров. Героиня статьи, как и ее продукт демитилтерефталат, токсична. Опыты проводили на кролика и крысах. Последние, получили по 10 граммов кислоты на килограмм веса и померли в течение двух недель.
Кроликам реагент наносили на кожу . Покровы отекали и покрывались корками. Но, в виде полиэтилентерефталата, который получают синтезом терефталевого соединения, вещество не опасно.
Полиэтилентерефталат – это термостойкий, прозрачный полимер. Именно из него, к примеру, делают лавсан. Нити из него используют медики. Материал покорил их прочностью. Делают из лавсана и материи.
Они сохраняют яркость красок, не мнутся, отлично держат тепло, крепки на разрыв. Минус одежд из лавсана лишь в отсутствии у тканей способности впитывать влагу. Наряды не гигиеничны, подходят для кратковременных выходов, но не постоянной носки.
Практичнее делать из полиэтилентерефталата пластиковую тару. Ее изготавливают не только для бытовых, промышленных нужд, но и пищевой отрасли. Это указывает на безопасность пластиковых упаковок, по крайней мере, если правильно ими пользоваться.
Полимеры делятся на классы и соответственно маркируются. Одну тару можно даже в микроволновку на пару минут поместить. В другие емкости из полиэтилентерефталата даже горячую воду налить нельзя, иначе они расплавятся.
Производство терефталевой кислоты
Героиня статьи, как и прочие кислоты , бывает технической, или же очищенной. Последняя, нужна для пищевой промышленности. Уровень загрязнения определяется наличием продуктов окисления параксилола. Это продукт кристаллизации ксилола нефти .
Между тем, именно окисление параксилола – основной способ промышленного получения терефталевой кислоты . Для реакции нужны чистый кислород и испарительное охлаждение. Уксусная кислота берется в качестве среды. Нужен, так же, катализатор. В его роли выступают соли кобальта , или марганца .
Окисление параксилола ведется в 3 ступени. Изначальная конверсия, то есть, переход в терефталевую кислоту равен лишь 40%. К ним приходят, выдерживая температуру в 180-200 градусов Цельсия. Потом ее еще повышают.
В итоге получается почти 100-процентное, чистое терефталевое соединение. Такое и в пищевой отрасли пригодится, и для защитных покрытий, и конструкционных материалов.
Правда, для последних, обычно, используют вторично переработанное сырье. Изделия из полиэтилентерефталата почти не гниют, для разложения нужны тысячелетия. Поэтому, вторичное использование полимера всячески поощряется.
Цена терефталевой кислоты
Купить терефталевую кислоту предлагают, в основном, оптом. За тонну просят примерно 700-1 500 долларов США. В переводе на рубли минимальный ценник – около 44 000, а максимальный – более 90 000. Это по текущему курсу в 63,5 рубля на 8-е декабря 2016-го года.
Экстримально низкие ценники на терефталевую кислоту встречаются у ряда российских и китайских предприятий при заказах от 5-ти тонн. Производители уверяют, что предлагают по 500 долларов за тонну соединение высокой очистки.
Некоторые производители, и вовсе, устанавливают минимальный заказ в 20 тонн. Можно найти и поставки небольшими объемами. Ряд баз химических реактивов продает терефталевую кислоту килограммами. За 1 000 граммов клиенты фирм отдают чуть больше 10-ти рублей.
Источник
Значение и получение терефталевой кислоты
Рубрика: 14. Общие вопросы технических наук
Дата публикации: 19.09.2013
Статья просмотрена: 11510 раз
Библиографическое описание:
Хатмуллина, Д. Д. Значение и получение терефталевой кислоты / Д. Д. Хатмуллина. — Текст : непосредственный // Технические науки: традиции и инновации : материалы II Междунар. науч. конф. (г. Челябинск, октябрь 2013 г.). — Т. 0. — Челябинск : Два комсомольца, 2013. — С. 86-88. — URL: https://moluch.ru/conf/tech/archive/87/3632/ (дата обращения: 20.11.2021).
Полимерные материалы и среди них химические волокна настоятельно входят в быт человека. До начала XX столетия применялись только те из них, которые являлись продуктами растительного и животного происхождения (хлопок, шерсть, лубяные волокна и т. д.). С появлением синтетических волокон последние стали быстро вытеснять натуральные волокна.
Важнейшими мономерами для производства полиэфирных волокон являются терефталевая кислота (ТФК) и диметилтерефталат (ДМТ).
Терефталевая кислота является одним из важнейших химических продуктов, используемых для производства полиэфирных волокон, полиоксадиазолов, полибензимидазолов, алкидных смол. Терефталевая кислота обладает большой прочностью, относительно высокой термостойкостью, а также высокие диэлектрические характеристики,которые позволяют применять полиэфирные материалы для производства шинного корда, транспортерных лент, приводных ремней, парусов, пожарных рукавов, электроизоляционных и других материалов. Из полиэфирных волокон (лавсан, терилен, дакрон) можно получать разнообразные материалы — длинный ворс, напоминающий мех, подходит для пошива пальто, курток, ковриков для ванной или мягких игрушек, а грубое прочное волокно пригодно для изготовления клиновых ремней, пожарных рукавов и ковровых покрытий.
Благодаря высокой устойчивости к сминанию и способности сохранять форму, хорошему внешнему виду и достаточно низкой стоимости полиэфирные волокна в чистом виде или в смеси с другими волокнами используют для изготовления широкого ассортимента товаров народного потребления: платяной и костюмной тканей, верхнего трикотажа, занавесей, постельного белья, изделий из искусственной замши и искусственного меха.
Приведенные выше свойства полиэфирных волокон обусловили наиболее крупнотоннажное производство по сравнению с производством волокон других видов.
Терефталевая кислота (1,4-бензолдикарбоновая кислота, п-фталевая кислота) является основным исходным продуктом для получения полиэтилентерефталата (ПЭТФ), гранулят которого в свою очередь используется для производства искусственного волокна, пластиковых бутылок, пленки, пластмассы.
Сырьем для производства терефталевой кислоты могут служить разные п-диалкилбензолы: п-ксилол, п-цимол, п-диэтил- и п-диизопропилбензол, а в последнее время применяется также толуол. Из окислителей наибольшее значение имеют азотная кислота и молекулярный кислород.
Из n-диалкилбензолов лучшим сырьем для окисления в терефталевую кислоту является п-ксилол. Он более доступен и, кроме того, при жидкофазном окислении п-ксилола молекулярным кислородом образуется преимущественно п-толуиловая кислота, для дальнейшего окисления которой требуется менее жесткие условия, чем для окисления промежуточных продуктов, образуемых другими n-диалкилбензолами.
В связи с развитием нефтехимической промышленности и значительным увеличением производства п-ксилола в известной степени утратили свое практическое значение способы получения диметилтерефталат (ДМТ) из толуола и п-цимола. Все большее значение приобретают процессы, позволяющие получать ТФК методом жидкофазного каталитического окисления п-ксилола с последующей ее этерификацией метанолом до ДМТ.
Процесс получения органической кислоты (терефталевой), далее технической терефталевой кислоты (ТФК) основан на реакции жидкофазного окисления параксилола (PX) кислородом воздуха в среде реакционного растворителя (RQ). В качестве катализатора используется раствор смеси кобальта (II) уксуснокислого 4‑водный и марганца (II) уксуснокислого 4-водный с добавлением промотора в виде тетрабромэтана (ТБЭ).
Брутто-реакция образования ТФК описывается схемой (1):
Тепловой эффект реакции Qp = (-∆Hр) = 326 ккал/г-моль.
Процесс проводят при температуре 185÷195°С под давлением 0,9÷1,1 МПа. Теплосъем — за счет испарения реакционного растворителя (уксусной кислоты) и реакционной воды, то есть процесс осуществляется «на кипу» при температуре, определяемой давлением (упругостью паров воды и уксусной кислоты с учетом наличия в паровой фазе инертов).
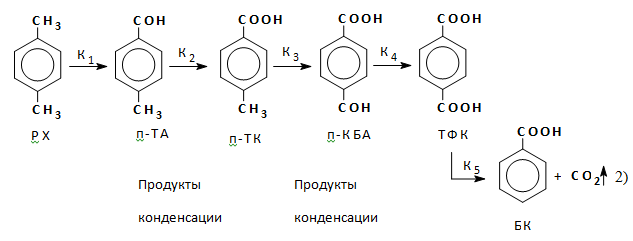
Механизм реакции — радикально-цепной с короткой цепью. Упрощенно реакцию можно рассматривать как последовательно-параллельную:
п-КБА — пара-карбоксибензальдегид, п-С6Н4(СОН)СООН,
БК — бензойная кислота, С6Н5СООН,
Кi — константа скорости I стадии реакций окисления.
Кроме образования бензойной кислоты и продуктов конденсации, основной побочной реакцией является деструктивное окисление уксусной кислоты и образование метилацетата (МА):
2СО2 + 2Н2O
Источник