Сульфид меди (I)
| Сульфид меди (I) | |
|---|---|
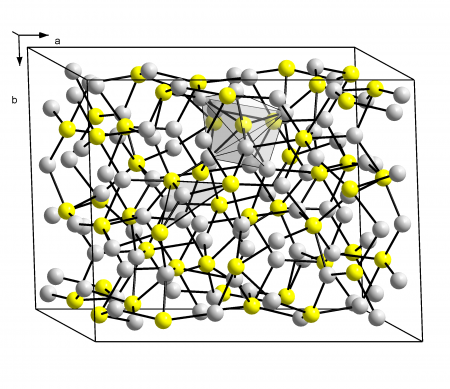 Кристаллическая структура халькозина | |
| Систематическое название | Моносульфид димеди |
| Другие названия | Сульфид меди (I) |
| Химическая формула | Cu2S |
| Эмпирическая формула | Cu2−XS, x = 0÷0,10 |
| Внешний вид | твердое вещество темно-серого цвета |
| Молярная масса | 159,16 г/моль |
| Температура плавления | 1129 °C (1402,15 К) |
| Температура разложения | 700 °C (в вакууме) |
| Фазовые переходы | 103 °C (ромб. → гекс.) 437 °C (гекс. → куб.) |
| Плотность | 5,81 г/см³ |
| Твёрдость по Моосу | 2,5÷3,0 |
| Растворимость в воде | 1,3⋅10 −15 г/100 мл |
| Произведение растворимости | 2,3⋅10 −48 |
| ПДК | в воздухе 4 мг/м 3 |
| Кристаллическая решётка | Орторомбическая |
| Стандартная энтальпия образования | −79 кДж/моль |
| Энтальпия плавления | +23,01 кДж/моль |
| Стандартная молярная энтропия | +121 Дж/(моль·К) |
| Стандартная энергия образования Гиббса | −86 кДж/моль |
| Регистрационный номер CAS | 22205-45-4 |
| Регистрационный номер EC | 244-842-9 |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). | |
Сульфид меди (I) — неорганическое вещество с формулой Cu2S . Относится к классу бинарных соединений. Может также рассматриваться как соль одновалентной меди и сероводородной кислоты.
Содержание
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Реакции при высоких температурах
- 3.2 Реакции в растворах
- 4 Получение
- 5 Применение
- 6 Влияние на здоровье
Нахождение в природе
Сульфид меди(I) в природе встречается в виде минерала халькозина (устаревшие названия: халькоцит, редрутит, медный блеск). Также, по составу данному соединению близок минерал джюрлеит, иногда называют джарлеит (подробнее см. Сульфиды меди). Основные свойства представлены в таблице.
| Халькозин | Джюрлеит | |
|---|---|---|
| Состав | Cu2S | Cu1,94S |
| Цвет | темно-серый | чёрный |
| Сингония | ромбическая | моноклинная |
| Плотность, г/см³ | 5,5—5,8 | 5,5—5,7 |
| Твердость | 2,5—3,0 | 2,2—2,4 |
Физические свойства
Сульфид меди (I) — твердое вещество темно-серого цвета, нерастворимое в воде и этаноле.
Cu2S существует в трёх кристаллических модификациях:
- α -Cu2S, ромбическая сингония, пространственная группа Ab 2m, параметры ячейки a = 1,1190 нм , b = 2,728 нм , c = 1,341 нм , Z = 96 , d = 5,81 г/см 3 ;
- β -Cu2S, гексагональная сингония, пространственная группа P 63/mmc, параметры ячейки a = 0,389 нм , c = 0,668 нм , Z = 2 , d = 5,78 г/см 3 ;
- γ -Cu2S, кубическая сингония, пространственная группа F m3m, параметры ячейки a = 0,5735 нм , Z = 4 , d = 5,60 г/см 3 .
Температуры фазовых переходов: α → β 103 °C, β → γ 437 °C.
Сульфид меди (I) склонен к образованию нестехиометрических соединений, свойства которых могут сильно отличаться от стехиометрических.
Химические свойства
Реакции при высоких температурах
При атмосферном давлении в инертной атмосфере:
Cu2S → >700∘C 2Cu + S
С водяным паром:
Cu2S + Cl2 → 300−400∘C 2CuCl + S
С сульфидом железа(II) и серой:
Cu2S + 2FeS + S → 800−1000∘C 2(Fe III Cu I )S2 2(Fe III Cu I )S2 + 5O2 + 2SiO2 → 1000∘C 2Cu + 2FeSiO3 + 4SO2
Реакции в растворах
Сульфид меди (I) не реагирует с соляной кислотой.
Растворяется в горячей концентрированной азотной кислоте, концентрированном растворе цианида калия:
Медленно растворяется в холодной концентрированной азотной кислоте, горячей концентрированной серной кислоте, концентрированном растворе аммиака:
Восстанавливает Fe 3+ до Fe 2+ (в растворе):
Получение
Сульфид меди (I) может быть получен одним из следующих способов.
Нагреванием металлической меди с серой в вакууме:
2Cu + S → 300−400∘C Cu2S
Нагреванием металлической меди в токе диоксида серы:
4Cu + SO2 → 600−800∘C Cu2S + 2CuO
Термическим разложением сульфида меди (II):
2CuS → 200−450∘C Cu2S + S
Нагреванием сульфида меди (II) в токе водорода:
Нагреванием оксида меди(I) с серой:
Монокристаллы сульфида меди (I) получают при помощи зонной плавки.
Применение
Руды, содержащие сульфид меди (I) — один из видов сырья для производства меди, медного купороса. Сульфид меди (I) — компонент медного штейна при пирометаллургическом получении меди. Также используется как полупроводник, компонент полупроводниковых сплавов.
Влияние на здоровье
Пыль сульфида меди (I) токсична, ПДК в воздухе 4 мг/м³.
Источник
Сульфид меди (I)
Сульфид меди(I) — неорганическое вещество с формулой
Реакции в растворах
Сульфид меди(I) не реагирует с соляной кислотой.
Растворяется в горячей концентрированной азотной кислоте, концентрированном растворе цианида калия:
Получение
Сульфид меди(I) может быть получен одним из следующих способов.
Нагреванием металлической меди с серой в вакууме:
Монокристаллы сульфида меди(I) получают при помощи зонной плавки.
Применение
Руды, содержащие сульфид меди(I) — один из видов сырья для производства меди, медного купороса. Сульфид меди(I) — компонент медного штейна при пирометаллургическом получении меди. Также используется как полупроводник, компонент полупроводниковых сплавов.
Влияние на здоровье
Пыль сульфида меди(I) токсична, ПДК в воздухе 4 мг/м³.
Источник
Сульфид меди (II)
| Сульфид меди (II) | |
|---|---|
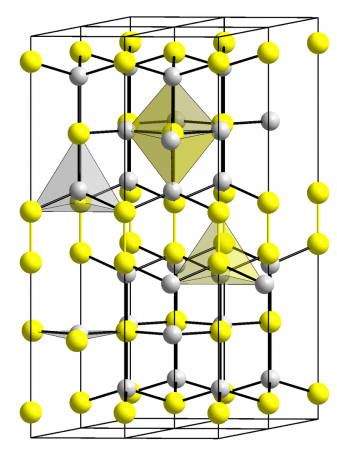 | |
| Систематическое наименование | Сульфид меди (II) |
| Традиционные названия | Сульфид меди, моносульфид меди |
| Хим. формула | CuS |
| Рац. формула | CuS |
| Состояние | твёрдое |
| Молярная масса | 95,61 г/моль |
| Плотность | 4,6 г/см³ |
| Показатель преломления | 1,45 |
| Рег. номер CAS | 1317-40-4 |
| PubChem | 14831 |
| Рег. номер EINECS | 215-271-2 |
| SMILES | |
| RTECS | GL8912000 |
| ChEBI | 51110 |
| ChemSpider | 14145 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфид меди (II) (моносульфид меди) — CuS, неорганическое бинарное соединение двухвалентной меди с серой. Чёрное, нерастворимое в воде и разбавленных растворах кислот вещество. Встречается в природе в виде редкого минерала ковеллина.
Получают прямым взаимодействием элементов или обменной реакцией солей двухвалентной меди с водорастворимыми сульфидами.
Полученный сухим путём (теплота образования из элементов 12 ккал/моль) сульфид меди довольно хорошо проводит электрический ток (а ниже 1,66 K становится сверхпроводником). Рентгеноструктурное исследование его кристаллов выявило их совершенно особую и сложную структуру: Одна треть атомов меди находится в центрах треугольников из атомов серы [d (CuS) = 2,19 Å], а две трети — в центрах тетраэдров [d (CuS) = 2,32 Å]; кроме того, две трети атомов серы представлены группировками S2 ([S2] 2− ), подобными имеющимся в пирите. В связи с этим строение кристалла CuS можно было бы уточнённо выразить формулой Cu I 4 Cu II 2 [S −1 2]2S −2 2 . Около 400 °C наступает заметное разложение сульфида по схеме 2CuS == Cu2S + S (давление диссоциации при 450 °C равно 80 мм рт. ст.). Известны также полисульфидные производные меди Cu2Sn (где n = 3 ÷ 6; а также CuS2) и её селенид CuSe (теплота образования из элементов 10 ккал/моль). Взаимодействием CuSO4 с насыщенным серой раствором полисульфида могут быть получены довольно устойчивые красные кристаллы тиосолей типа MCuS. (где M – NH4, K, Rb, Cs). Наименее растворима из них соль цезия.
Источник
Способ получения сульфида меди (i)
Изобретение относится к неорганической химии, в частности к получению сульфида меди (1), применяемому в качестве катализатора в органическом синтезе, при выплавке меди в цветной металлургии, при изготовлении химических источников тока. Целью изобретения является упрощение процесса и создание безотходной технологии. Способ заключается во взаимодействии стехиометрических количеств медьсодержащего и серосодержащего материалов в водной среде при нагреве с последующим охлаждением, фильтрацией суспензии и сушкой осадка. Новым в способе является использование порошков меди и серы в качестве медьсодержащего и серосодержащего материалов с суспендированием их при перемешивании в растворе сульфида щелочного металла при температуре 80 — 100°С, причем количество сульфидной серы в сульфиде щелочного металла составляет 2 — 5% от массы порошка серы и используется многократно.
РЕСПУБЛИК (я)5 С 01 G 3/12
ПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
;йКЯЙ- S, причем количество сульфидной серы в сульфиде щелочного .Ы, 1666446 А1
Целью изобретения является упрощение процесса и создание безотходной технологии. Способ заключается во взаимодействии стехиометрических количеств медьсодержащего и серосодержащего материалов в водной среде при нагреве с последующим охлаждением, фильтрацией суспензии и сушкой осадка. Новым в способе является использование порошков меди и серы в качестве медьсодер>кащего и серосодержащего материалов с суспендированием их при перемешивании в растворе сульфида щелочного металла при 80 — 100 С, причем количество сульфидной серы в сульфиде щелочного металла составляет 2-57, от массы порошка серы и используется многократно. металла составляет 2 — 5 от массы порошка серы, а фильтрат от фильтрации суспензии используют многократно в качестве исходного раствора для повторных синтезов.
Сущность способа заключается в том, что сульфид щелочного металла, взаимодействуя с порошком серы, образует небольшое количество растворимого полисульфида щелочного металла, например NazS, в котором сера более реакционноспособна, чем суспензия серы в водной среде. При взаимодействии полисульфида щелочного металла с медью образуется сульфид меди (I) и свободный сульфид щелочного металла, который способен к растворению следующей порции серы с повторным образованием полисульфида.
После полной выработки меди полисульфида в растворе не остается, и раствор опять содержит то же количество сульфида щелочного металла, что и в исходном растворе.
Таким образом, сульфид щелочного металла при малых концентрациях является катализатором процесса взаимодействия меди и серы, т.е. он ускоряет процесс получения сульфида меди (I), не расходуясь при этом.
Использование раствора с содержанием сульфидной серы меньшем, чем 2 от массы порошка серы. ведет к неполному превращению серы, а с содержанием больше 5 — к ухудшению качества продукта за счет появления в нем сульфида меди (й), т,е. к образованию смешанного сульфида одновалентной и двухвалентной меди.
Температура процесса ниже 80 С ведет к замедлению процесса и большему содержанию серы в осадке, После проведения реакции взаимодействия порошков меди и серы, полученную суспензию сульфида меди (I) охлаждают и фильтруют, причем осадок сульфида меди (I) промывают от сульфида натрия небольшим количеством дистиллированной воды и сушат при 105 С, а фильтрат с промывной водой используют в повторных синтезах в качестве исходного раствора сульфида натрия. Концентрация сульфида натрия в растворе при его многократном использовании практически не изменяется, так как присоединение к нему промывных вод конпенсируется убылью воды, теряемой при конденсации ее паров, Раствор сульфида щелочного металла имеет слабощелочную реакцию вследствие гидролиза, поэтому процесс по предлагаемому способу можно проводить в серийном аппарате, выполненном в отличие от прототипа из углеродистой стали.
Пример 1. В колбу с пропеллерной мешалкой заливают 1,5 л дистиллированной воды, добавляют 5 г безводного сульфида натрия, нагревают раствор до 80 С и при перемешивании загружают 64 г серы, предварительно просеянной через сито с размером ячеек 0,5 мм. После образования однородной суспензии ее нагревают до
100 С и небольшими порциями в течение 30 мин загружают порошок меди. После исчезновения в суспензии частиц серы желтого цвета, например через 8 ч после окончания загрузки меди суспензию охлаждают и фильтруют на воронке Бюхнера, осадок сульфида меди (I) промывают 100 мм дистиллированной воды, Фильтрат с промывной водой в количестве, 1,5 л и концентрацией сульфида натрия 3,3 r/л собирают для последующих синтезов, а осадок сульфида меди (1) сушат в сушильном шкафу при 105 С до воздушно-сухого состояния, Пример 4, В колбу с обратным холодильником заливают 1 л фильтрата, полученного в примере 2, добавляют 0,5 л дистиллированной воды и 5 г безводного сульфида натрия, При этом содержание сульфидной серы в растворе составляет
5,3 от массы загружаемого порошка серы, Далее процесс ведут аналогично примеру 2, Сульфид меди, полученный в этих условиях, не отвечает требованиям, предъявляемым к готовому продукту, так как содержит сульфид меди (II), 45
Пример 5. В колбу заливают 1 л фильтрата, полученного в примере 4, и 0,5 л дистиллированной воды, нагревают до 70 С и ведут загрузку при перемешивании 64 г серы и 254 r порошка меди, Содержание сульфидной серы в примере составляет
Количество сульфидной серы в растворе сульфида щелочного металла (или в фильтрате) составляет 3,2 от массы загруженного порошка серы, 5 Выход сульфида меди (1) составляет 315 г или 99 от теоретического выхода.
Пример 2. В колбу с пропеллерной мешалкой и обратным холодильником заливают 1,5 л фильтрата от предыдущего опыта, 10 подают воду в обратный холодильник, нагревают фильтрат до 85 С и загружают 64 г порошка серы.
В образовавшуюся однородную суспензию небольшими порциями в течение 1 ч
15 загружают 254 г порошка меди, По окончании загрузки меди в течение 12 ч поддерживают температуру суспензии 85 С, после чего ее охлаждают и фильтруют. Осадок сульфида меди промывают 100 мл дистилли20 рованной воды и сушат при 105 С, а фильтрат в количестве 1,5 л с содержанием сульфидной серы 3,2 от массы загруженного порошка серы собирают для последующих синтезов.
25 Выход сульфида меди (I) составляет 314
r (98,6 от теоретического выхода).
Пример 3, В колбу с обратным холодильником заливают 0,5 л фильтрата, полученного в примере 2, но суспензию не
30 доводят до кипения, поддерживая температуру 98 С.
Через 12 ч нагрев прекращают, причем сера полностью не прореагировала, о чем свидетельствуют включения желтого цвета, 35 поэтому продукт по своему качеству не отвечает требованиям, предъявляемым к сульфиду меди (I) Содержание сульфидной серы в примере составляет 1,1 от массы загруженного порошка серы.
3,6ф от массы загруженного порошка серы.
После нагрева в течение 18 ч наблюдаются включения серы желтого цвета. Продукт не отвечает требованиям, предъявляемым к сульфиду меди (I), Составитель Л.Темирова
Редактор Т.Лазоренко Техред М.Моргентал Корректор О.Кундрик
Заказ 2493 Тираж 298 Подписное
ВНИИПИ Государственного комитета по изобретениям и открытиям при ГКНТ СССР
113035, Москва, Ж-35, Раушская наб„4/5
Производственно-издательский комбинат «Патент», r, Ужгород, ул.Гагарина, 101
Таким образом, проведение процесса в предлагаемых условиях позволяет упростить процесс за счет снижения температуры его от 160-180 до 80-100 С и тем самым исключается необходимость осуществления процесса в автоклавных условиях. Кроме того, способ обеспечивает безотходную технологию за счет возврата фильтрата в голову процесса, Формула изобретения
Способ получения сульфида меди (1), включающий обработку медьсодержащего реагента водным раствором сульфида ще5 лочного металла при нагревании, отделение осадка целевого продукта фильтрацией и сушку его, о т л. и ч а ю шийся тем, что, с целью упрощения процесса, в качестве медьсодержащего реагента используют
10 медный порошок, а обработку ведут при 80100 С в присутствии элементарной серы, причем раствор для обработки берут в количестве, обеспечивающем содержание сульфидной серы в реакционной среде 2 — 5 от
Источник








