- Получение соляной кислоты сульфатным методом
- Сульфатная кислота: формула и химические свойства
- Разнообразие названий
- Сульфатная кислота: формула и строение молекулы
- История открытия
- Физические свойства
- Химические свойства
- Особые свойства серной кислоты
- Способы получения в промышленности
- Синтез в лаборатории
- Самые распространенные соли
- Сульфатный щелок
- Основные области применения
Получение соляной кислоты сульфатным методом
Сульфатный метод – это самый старый метод получения соляной кислоты. Его используют, когда есть потребность в 
Сульфатный метод протекает по следующим реакциям:
Сырьем для получения хлористого водорода и сульфата натрия служат поваренная соль (обычно измельченная каменная соль – бузун) и купоросное масло – 92 % – 93 % – я серная кислота. Менее концентрированную серную кислоту не применяют, так как в этом случае хлористый водород был бы чрезмерно разбавлен парами воды, что затруднило бы получение концентрированной соляной кислоты. Применение крупнозернистой выварочной соли предпочтительнее вследствие ее пористости – она легко пропитывается кислотой с образованием однородной массы. Однако выварочная соль содержит переменное количество влаги, что затрудняет дозировку сырья и регулирование температурного режима печей. Каменная соль характеризуется постоянной влажностью, но она более загрязнена примесями.
Реакция между хлористым натрием и серной кислотой – эндотермическая.
Взаимодействие хлористого натрия с серной кислотой начинается даже при 0 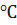
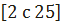
Реакция между поваренной солью и серной кислотой осуществляется в механических или во вращающихся печах.
На рисунке 1 показана механическая сульфатная печь. Она предназначена для получения хлороводорода, представляет собой муфель, под (чаша) 12 и свод 11 которого сложены из фасонных огнеупорных и кислотостойких шамотных плит. Под муфелем и над ним расположены дымоходы. Толщина плит пода 120 мм; свод муфеля для облегчения передачи тепла к реакционной массе делают более тонким – 30 мм. Внутреннюю кладку печи и топки выполняют из шамотного, а наружную – из простого кирпича. Под печью расположен привод мешалки. Поваренная соль через загрузочную воронку непрерывно поступает в центр муфеля с помощью шнекового питателя 8. Туда же по трубе подается купоросное масло. Оно поступает в укрепленный на головке вала и вращающийся вместе с ним распределитель 13 кислоты, имеющий форму чайника, через носик которого сливается в муфель.
1 – шахтная топка; 2 – загрузочная коробка для топлива; 3 – колосниковая решетка; 4 – зольник; 5 – топочный порог; 6 – канал для вторичного воздуха; 7 – загрузочная воронка для соли; 8 – загрузочный шнек для соли; 9 – солевая труба; 10 – кислотная труба; 11 – свод муфеля; 12 – под муфеля; 13 – питатель – распределитель кислоты; 14 – головка мешалки; 15 – вал мешалки; 16 – коронная шестерня привода мешалки; 17 – люк для выхода сульфата натрия; 18 – холодильно – размольный барабан для сульфата; 19 – труба для отвода хлористого водорода.
Рисунок 1 – Механическая сульфатная печь (вертикальный разрез)
Перемешивание поваренной соли и кислоты и передвижение реакционной массы по поду муфеля от центра к периферии производится укрепленной на чугунном валу 15 мешалкой с четырьмя плечами, расположенными крестообразно, на каждом из которых имеется по два (всего восемь) термосилидовых или чугунных гребков с керамическими или корборундовыми наконечниками. Вращение вала (0,75 – 1,25 об/мин) производится через зубчатую передачу электромотором мощностью 4,5 квт при диаметре муфеля 4,25 м и 6,8 квт при диаметре муфеля 5,5 м.
Обогрев муфеля, температуру в котором поддерживают в пределах 500 
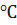
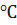
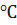

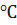
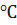
Полученный хлористый водород отправляется на абсорбцию. В соответствии с этим абсорбционные установки сооружены таким образом, чтобы обеспечить наиболее полный отвод тепла гидратации HCl. Обычно газ вначале охлаждают в длинных газопроводах и керамических холодильниках. Охлаждение совмещают с осушкой газа, что дает возможность получать более концентрированную соляную кислоту до 37 % 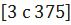
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Источник
Сульфатная кислота: формула и химические свойства
Одна из самых первых минеральных кислот, которая стала известна человеку, — это серная, или сульфатная. Не только сама она, но и многие ее соли использовались в строительстве, медицине, пищевой промышленности, в технических целях. До сих пор в этом отношении ничего не изменилось. Ряд характеристик, которыми обладает сульфатная кислота, делают ее просто незаменимой в химических синтезах. Кроме этого, практически во всех отраслях быта и промышленности находят применение ее соли. Поэтому подробно рассмотрим, что она собой представляет и в чем заключаются особенности проявляемых свойств.
Разнообразие названий
Начнем с того, что названий у этого вещества немало. Среди них есть и те, что образуются по рациональной номенклатуре, и те, которые исторически сложились. Итак, это соединение обозначают как:
- сульфатная кислота;
- купоросное масло;
- серная кислота;
- олеум.
Хотя термин «олеум» не совсем подходит для данного вещества, поскольку является смесью серной кислоты и высшего оксида серы — SO3.
Сульфатная кислота: формула и строение молекулы
С точки зрения химической аббревиатуры записать формулу данной кислоты можно так: H2SO4. Очевидно, что молекула состоит из двух катионов водорода и аниона кислотного остатка — сульфат-иона, имеющего заряд 2+.
При этом внутри молекулы действуют следующие связи:
- ковалентная полярная между серой и кислородами;
- ковалентная сильно полярная между водородом и кислотным остатком SO4.
Сера, имея 6 неспаренных электронов, образует две двойные связи с двумя атомами кислорода. Еще с парой — одинарные, а те, в свою очередь, — одинарные с водородами. В результате строение молекулы позволяет быть ей достаточно прочной. В то же время катион водорода очень подвижен и легко уходит, ведь сера и кислород гораздо больше по электроотрицательности. Стягивая электронную плотность на себя, они предоставляют водороду частично положительный заряд, который при отсоединении становится полным. Так формируются кислые растворы, в которых находится Н + .
Если говорить о степенях окисления элементов в соединении, то сульфатная кислота, формула которой H2SO4, легко позволяет рассчитать их: у водорода +1, у кислорода -2, у серы +6.
Как и в любой молекуле, суммарный заряд равен нулю.
История открытия
Сульфатная кислота известна людям с самой древности. Еще алхимики умели получать ее методами прокаливания разных купоросов. С самого IX века люди получали и использовали это вещество. Позже в Европе Альберт Магнус научился извлекать кислоту в процессе разложения железного купороса.
Однако ни один из способов выгодным не был. Затем стал известен так называемый камерный вариант синтеза. Для этого сжигали серу и селитру, а выделяющиеся пары поглощали водой. В результате формировалась сульфатная кислота.
Еще позже англичане сумели найти самый дешевый метод получения данного вещества. Для этого использовался пирит — FeS2, железный колчедан. Его обжиг и последующее взаимодействие с кислородом до сих пор составляют один из самых главных промышленных способов синтеза серной кислоты. Такое сырье более доступное, дешевое и качественное для больших объемов производства.
Физические свойства
Есть несколько параметров, в том числе и наружные, по которым отличается от других сульфатная кислота. Физические свойства ее можно описать в нескольких пунктах:
- При стандартных условиях — жидкость.
- В концентрированном состоянии является тяжелой, маслянистой, за что и получила название «купоросное масло».
- Плотность вещества — 1,84 г/см 3 .
- Не имеет цвета и запаха.
- Обладает выраженным «медным» вкусом.
- Растворяется в воде очень хорошо, практически неограниченно.
- Гигроскопична, способна улавливать как свободную, так и связанную воду из тканей.
- Нелетучая.
- Температура кипения — 296 о С.
- Плавление при 10,3 о С.
Одна из важнейших особенностей данного соединения заключается в способности гидратироваться с выделением большого количества теплоты. Именно поэтому еще со школьной скамьи детям внушается, что добавлять воду к кислоте ни в коем случае нельзя, а только наоборот. Ведь по плотности вода легче, поэтому будет скапливаться на поверхности. Если резко добавить ее к кислоте, то в результате реакции растворения выделится настолько большое количество энергии, что вода вскипит и начнет разбрызгиваться вместе с частицами опасного вещества. Это может вызвать сильные химические ожоги кожи рук.
Поэтому следует тоненькой струйкой вливать кислоту в воду, тогда смесь сильно нагреется, но вскипания не произойдет, а значит, разбрызгивания жидкости тоже.
Химические свойства
С точки зрения химии данная кислота является очень сильной, особенно если это концентрированный раствор. Она двухосновная, поэтому диссоциирует ступенчато, с образованием гидросульфат- и сульфат-аниона.
В целом ее взаимодействие с различными соединениями соответствует всем основным реакциям, характерным для этого класса веществ. Можно привести примеры нескольких уравнений, в которых принимает участие сульфатная кислота. Химические свойства проявляются в ее взаимодействии с:
- солями;
- оксидами и гидроксидами металлов;
- амфотерными оксидами и гидроксидами;
- металлами, стоящими в ряду напряжений до водорода.
В результате подобных взаимодействий практически во всех случаях образуются средние соли данной кислоты (сульфаты) либо кислые (гидросульфаты).
Особенной чертой также является то, что с металлами по обычной схеме Me + H2SO4 = MeSO4 + H2↑ реагирует лишь раствор данного вещества, то есть разбавленная кислота. Если же взять концентрированный или сильно насыщенный (олеум), то продукты взаимодействия будут совсем иными.
Особые свойства серной кислоты
К таковым относится как раз взаимодействие концентрированных растворов с металлами. Так, существует определенная схема, отражающая весь принцип таких реакций:
- Если металл активный, то в результате происходит образование сероводорода, соли и воды. То есть сера восстанавливается до -2.
- Если металл средней активности, то в результате — сера, соль и вода. То есть восстановление сульфат-иона до свободной серы.
- Металлы низкой химической активности (после водорода) — сернистый газ, соль и вода. Сера в степени окисления +4.
Также особыми свойствами сульфатной кислоты являются способности окислять некоторые неметаллы до их высшей степени окисления и вступать в реакции со сложными соединениями и окислять их до простых веществ.
Способы получения в промышленности
Сульфатный процесс получения серной кислоты складывается из двух основных типов:
Оба являются самыми распространенными способами в промышленности во всех странах мира. Первый вариант основан на использовании в качестве сырья железного колчедана или серного пирита — FeS2. Всего выделяют три этапа:
- Обжиг сырья с образованием в качестве продукта горения сернистого газа.
- Пропускание этого газа через кислород над ванадиевым катализатором с образованием серного ангидрида — SO3.
- В поглотительной башне осуществляется растворение ангидрида в растворе сульфатной кислоты с формированием раствора высокой концентрации — олеума. Очень тяжелая маслянистая густая жидкость.
Второй вариант — это практически то же самое, но в качестве катализатора используются оксиды азота. С точки зрения таких параметров, как качество продукции, стоимость и энергозатраты, чистота сырья, производительность, первый способ более эффективен и приемлем, поэтому чаще используется именно он.
Синтез в лаборатории
Если необходимо получить серную кислоту в небольших количествах для лабораторных исследований, то лучше всего подходит способ взаимодействия сероводорода с сульфатами малоактивных металлов.
В этих случаях происходит образование черных сульфидов металлов, и как побочный продукт образуется серная кислота. Для небольших исследований такой вариант подходит, однако чистотой такая кислота отличаться не будет.
Также в лаборатории можно провести качественную реакцию на сульфатные растворы. Самым распространенным реактивом является хлорид бария, так как ион Ва 2+ вместе с сульфат-анионом выпадает в белый осадок — баритовое молоко: H2SO4 + BaCL2 = 2HCL + BaSO4↓
Самые распространенные соли
Сульфатная кислота и сульфаты, которые она образует, являются важными соединениями во многих отраслях промышленности и быта, в том числе и пищевой. Самыми распространенными солями серной кислоты являются следующие:
- Гипс (алебастр, селенит). Химическое название — водный кристаллогидрат сульфата кальция. Формула: CaSO4. Используется в строительстве, медицине, целлюлозно-бумажной промышленности, изготовлении ювелирных изделий.
- Барит (тяжелый шпат). Сульфат бария. В растворе представляет собой молочный осадок. В твердом виде — прозрачные кристаллы. Используется в оптических приборах, рентгеновских излучениях, для изготовления изолирующего покрытия.
- Мирабилит (глауберова соль). Химическое название — кристаллогидрат сульфата натрия десятиводный. Формула: Na2SO4*10H2O. Применяется в медицине как слабительное средство.
Можно привести в качестве примеров много солей, которые имеют практическую значимость. Однако упомянутые выше — самые распространенные.
Сульфатный щелок
Данное вещество представляет собой раствор, который образуется вследствие термической обработки древесины, то есть целлюлозы. Главное назначение этого соединения — получение на его основе сульфатного мыла методом отстаивания. Химический состав сульфатного щелока следующий:
- лигнин;
- гидроксикислоты;
- моносахариды;
- фенолы;
- смолы;
- летучие и жирные кислоты;
- сульфиды, хлориды, карбонаты и сульфаты натрия.
Существуют два основных вида данного вещества: белый и черный сульфатный щелок. Белый уходит на целлюлозно-бумажное производство, а черный используется для получения сульфатного мыла в промышленности.
Основные области применения
Ежегодное производство серной кислоты составляет 160 млн. тонн в год. Это очень значительная цифра, которая говорит о важности и распространенности данного соединения. Можно выделить несколько отраслей и мест, где необходимо использование сульфатной кислоты:
- В аккумуляторах в качестве электролита, особенно в свинцовых.
- На заводах, где производятся сульфатные удобрения. Основная масса данной кислоты идет именно на изготовление минеральных подкормок для растений. Поэтому заводы по производству серной кислоты и изготовлению удобрений чаще всего строят рядом.
- В пищевой промышленности в качестве эмульгатора, обозначаемого кодом Е513.
- В многочисленных органических синтезах в качестве водоотнимающего средства, катализатора. Так получают взрывчатые вещества, смолы, чистящие и моющие средства, капроны, полипропилен и этилен, красители, химические волокна, сложные эфиры и прочие соединения.
- Используют в фильтрах для очистки воды и изготовления дистиллированной воды.
- Применяют при добыче и обработке редких элементов из руды.
Также много серной кислоты уходит на лабораторные исследования, где ее получают местными способами.
Источник