- Сульфат калия: способы получения и химические свойства
- Способ получения
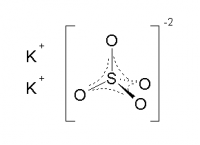
- Качественная реакция
- Химические свойства
- Сульфат калия — формула, свойства и получение вещества
- Описание вещества
- Получение соединения
- Химические свойства
- Промышленное применение
- Сульфат калия
- Содержание
- История
- Нахождение в природе
- Физические свойства
- Получение
- Химические свойства
- Применение
- Сведения о безопасности
Сульфат калия: способы получения и химические свойства
Сульфат калия K2SO4 — соль щелочного металла калия и серной кислоты. Белый, термически устойчивый. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 174,26; относительная плотность для тв. и ж. состояния d = 2,662; tпл = 1074º C; tкип > 2000º C
Способ получения
1. В результате взаимодействия при надпероксида калия и серы образуется сульфат калия:
2. Оксид калия реагирует с оксидом серы. В результате реакции образуется сульфат калия:
K2O + SO3 = K2SO4
3. В результате реакции между гидроксидом калия и серной кислотой происходит образование сульфата калия и воды:
4. Гидросульфат калия при 240 ºС разлагается с образованием сульфата калия и серной кислоты:
5. При взаимодействии концентрированного гидроксида калия и гидросульфата калия образуется сульфат калия и вода:
6. Сульфат калия взаимодействует с хлоридом калия при 450–700º C с образованием сульфата калия и соляной кислоты:
7. Твердый хлорид калия реагирует с концентрированной серной кислотой в состоянии кипения. В результате реакции образуется сульфат калия и газ хлороводород:
8. При температуре выше 500º С твердый сульфид калия взаимодействует с кислородом, образуя сульфат калия:
Качественная реакция
Качественная реакция на сульфат калия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария , сульфат калия образует сульфат бария и хлорид калия:
Химические свойства
1. Сульфат калия может реагировать с простыми веществами :
1.1. Сульфат калия реагирует с углеродом при температуре 900º C. При этом образуются сульфид калия и угарный газ:
1.2. С водородом сульфат калия реагирует при температуре 600º C, в присутствии катализатора Fe2O3 с образованием сульфида калия и воды:
2. Сульфат калия вступает в реакцию со многими сложными веществами :
2.1. Сульфат калия взаимодействует с гидроксидами :
2.1.1. Сульфат калия реагирует с гидроксидом бария с образованием гидроксида калия и сульфата бария:
2.2. Сульфат калия может реагировать с кислотами :
2.2.1. При взаимодействии с концентрированной серной кислотой твердый сульфат калия образует гидросульфат калия:
2.3. Сульфат калия может взаимодействовать с оксидами :
2.3.1. Сульфат калия реагирует с оксидом серы (VI) . Взаимодействие сульфата калия с оксидом серы (VI) приводит к образованию пиросульфата калия:
2.4. Сульфат калия реагирует с солями :
2.4.1. Сульфат калия взаимодействует с хлоридом бария . При этом образуются хлорид калия и осадок сульфат бария:
Источник
Сульфат калия — формула, свойства и получение вещества
Металлы первой подгруппы периодической системы называют щелочными. Эти вещества обладают высокой химической активностью: взаимодействуют с водой, галогенами, кислотами, образуя соответствующие соли, многие из которых имеют важное значение для различных отраслей промышленности и сельского хозяйства. Например, сульфат калия (формула K2SO4) — это удобрение, оказывающее положительное влияние на растения.
Описание вещества
Это соединение было известно еще в Средние века. Представляет собой соль калия и серной кислоты. Основные свойства:
Сингония — определенные элементы симметрии, описывающие порядок и расположение атомов в молекуле.
Сульфат калия (химическая формула K2SO4) — бесцветные кристаллы, хорошо растворимые в воде. В чистом виде (без примесей) в природе встречается редко — есть только несколько месторождений, расположенных в Польше и США (Калифорния). Также в небольших количествах его обнаруживали и в России (Крым, Северо-Восточный регион).
Калия сульфат содержится в водах соленых озер. Примеси этого вещества есть во многих минералах:
- леонит;
- глазерит;
- полигалит, и некоторых других.
Сернокислый калий не подвержен гидролизу. Он не растворяется в спирте (C2H5OH — этанол) и в концентрированных щелочах.
Получение соединения
Из-за того, что вещество в природе встречается редко, но имеет большое промышленное значение, методам получения K2SO4 уделяется значительное внимание. Основные производственные способы синтеза заключаются в проведении обменных реакций хлорида кальция с солями серной кислоты:
2KCl + 2MgSO4 → K2SO4 + 2MgCl2.
2KCl + Na2SO4 → K2SO4 + 2NaCl.
2KCl + FeSO4 → K2SO4 + FeCL2.
Химически чистое соединение получают воздействием серной кислотой на твердый хлорид:
2KCl + H2SO4 → K2SO4 + HCl.
В лабораториях пользуются немного другими способами, позволяющими получить нужное соединение. Основные из них:
Существует достаточно большое количество реакций, в результате которых будет образовываться сернокислый калий (другое название соединения). Преимуществом выбора того или иного метода будет химическая чистота получаемого вещества и экономическая целесообразность.
Химические свойства
С точки зрения химии, соединение ведет себя как типичная средняя соль. Для него характерны такие реакции:
Примечание: кислотный остаток SO4 (сульфат-анион — не путать с СО4) является двухвалентным, поэтому, чтобы правильно составить уравнения реакций, нужно этот момент учитывать — формула сернокислого калия пишется как K2SO4, а не KSO4.
Промышленное применение
Аграрная отрасль — основной потребитель калийной селитры (другое название соединения). Оно используется в качестве удобрения для подкормки почвы. Ценность продукта заключается в его способности ускорять обменные процессы в клетках растений, улучшать их сопротивляемость различным грибковым поражениям.
Недостаток калия (K) приводит к тому, что у растений нарушается углеводный баланс, это влечет за собой уменьшение образования крахмала и сахаров, снижение устойчивости растений к заболеваниям. Определить нехватку элемента можно и по внешним признакам:
Причем недостаток K может возникнуть из-за самих растений: некоторые из них слишком активно «вытягивают» его из почвы. В таких случаях внесение удобрения — необходимость.
Еще один вариант применения сернокислого калия — в качестве исходного сырья при получении гидросульфата (KHSO4). Это соединение требуется во многих отраслях промышленности:
Незаменим он и для науки: химики-аналитики используют KHSO4, чтобы перевести некоторые соединения в легкорастворимые формы.
В странах Европейского союза сульфат калия используют как пищевую добавку биодобавку — регулятор кислотности (стабилизатор) при производстве алкогольных напитков, добавляют в дрожжевые закваски при хлебопечении и даже иногда заменяют им соль в диетических продуктах.
Источник
Сульфат калия
| Сульфат калия | |
|---|---|
 | |
 | |
| Систематическое наименование | сульфат калия |
| Традиционные названия | сернокислый калий |
| Хим. формула | K2SO4 |
| Состояние | белое кристаллическое вещество |
| Молярная масса | 174.259 г/моль |
| Плотность | 2.66 г/см³ |
| Т. плав. | 1069 °C |
| Т. кип. | 1689 °C |
| Т. всп. | негорюч °C |
| Мол. теплоёмк. | 131,4 Дж/(моль·К) |
| Энтальпия образования | −1437,7 кДж/моль |
| Растворимость в воде | |
| Растворимость в остальных веществах | слабо растворим в глицерине, нерастворим в ацетоне, спирте, CS2 |
| Кристаллическая структура | ромбическая |
| ГОСТ | ГОСТ 4568-95 ГОСТ 4145-74 |
| Рег. номер CAS | 7778-80-5 |
| PubChem | 24507 |
| Рег. номер EINECS | 231-915-5 |
| SMILES | |
| Кодекс Алиментариус | E515(i) |
| RTECS | TT5900000 |
| ChEBI | 32036 |
| ChemSpider | 22915 |
| ЛД50 | 6600 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфат калия — неорганическое соединение. Химическая формула K2SO4.
Содержание
История
Сульфат калия был известен с начала 14-го века, изучен Глаубером, Бойлом и Тахеусом. В 17 веке он был назван arcanuni или sal duplicatum — эти названия были для кислот и щелочных солей.
Нахождение в природе
В природе находится на месторождениях калийных солей. Присутствует в водах солёных озёр.
Физические свойства
Бесцветные кристаллы, ромбическая сингония (a = 0,742 нм, b = 1,001 нм, c = 0,573 нм, Z = 4, пространственная группа Pnam). При температуре выше 584 °C переходит в гексагональную модификацию (a = 0,5947 нм, c = 0,8375 нм, Z = 2, пространственная группа P63/mmc).
Хорошо растворим в воде, не подвергается гидролизу. Нерастворим в концентрированных растворах щелочей или в чистом этаноле.
Получение
Минеральные формы чистого сульфата калия относительно редки. Минерал арканит (англ. Arcanite ) состоит из чистого K2SO4, представляет собой белые или прозрачные кристаллы, встречается в Калифорнии (США).
Есть много минералов, содержащих соли калия:
Промышленные методы получения основаны на обменных реакциях KCl с различными сульфатами и в результате сульфат калия, как правило, сильно загрязнён побочными продуктами:
Наиболее чистый продукт получают, обрабатывая твёрдый хлорид калия концентрированной серной кислотой:
Прокаливанием с углём минерала лангбейнита:
В лабораторной практике применяют следующие методы:
Сульфат калия получается при нагреве сульфита калия до температуры в 600 °C:
Окисление серы бихроматом калия:
Взаимодействием сульфата аммония и гидроксид калия:
(NH4)2SO4 + 2KOH → K2SO4 + 2NH3↑ + 2H2O 
Химические свойства
Как соль двухосновной кислоты образует кислые соли:
Как все сульфаты взаимодействует с растворимыми соединениями бария:
Восстанавливается до сульфида:
С оксидом серы образует пиросульфат:
Применение
Основной потребитель сульфата калия — сельское хозяйство. Сульфат калия является ценным бесхлорным удобрением. Эффективность сульфата калия лучше проявляется на бедных калием дерново-подзолистых почвах гранулометрического состава и торфяных почвах. На черноземных почвах он применяется обычно под культуры, которые усваивают много калия и натрия (сахарная свёкла, подсолнечники, плодовые, для корнеплодов, овощей). На каштановых и серозёмных почвах используют в зависимости от вида культуры, технологии выращивания и содержания калия в почве. Сульфат калия намного эффективнее влияет на величину урожая и его качество, если его применять в комплексе с азотными и фосфорными удобрениями. На кислых почвах действие сульфата калия повышается на фоне использования извести.
Калий повышает содержание сахаров и витаминов в выращиваемой продукции, а подкормки в конце августа-сентября способствуют лучшему зимованию плодово-ягодным и декоративным деревьям и кустарникам. Используется на различных почвах, под все культуры, а также для комнатного и балконного цветоводства. Сульфат калия пригоден для всех способов внесения: основного (при перекопке почвы весной или осенью) и для подкормки в течение вегетационного периода.
Применяется в первую очередь под культуры, чувствительные к хлору (картофель, табак, лён, виноград, цитрусовые и др.). Наличие в удобрении сульфат-иона положительно влияет на урожай растений семейства крестоцветных (капуста, брюква, турнепс и др.) и бобовых, потребляющих много серы.
Также сульфат калия используется в производстве стекла, различных квасцов и других соединений калия, как флюс в металлургии. В Европейском союзе допущен в качестве использования как пищевая добавка E515.
Сведения о безопасности
Следующие действия сульфатом калия на части тела могут вызвать:
- Глаза: попадание пыли может вызвать механическое раздражение,
- Кожа: попадание на кожу может вызвать раздражение,
- Проглатывание: употребление в пищу больших количеств может вызвать раздражение желудочно-кишечного тракта,
- Вдыхание: при вдыхании может вызвать раздражение дыхательных путей,
- При хроническом употреблении сульфата калия: отравления могут возникать в редких случаях длительного воздействия.
Источник















