Трансплантация костного мозга и стволовых клеток
Общие принципы
Трансплантация костного мозга (ТКМ) / стволовых кроветворных клеток периферической крови (ТСКК) — метод лечения гематологических, онкологических и аутоиммунных заболеваний, при котором пациенту после проведения интенсивной иммуносупрессивной терапии с применением больших дозы цитостатических препаратов (иммуносупрессантов), вводят предварительно заготовленный костный мозг или стволовые кроветворные клетки периферической крови (СКК). Ежегодно в мире выполняется около 150 000 ТКМ и ТСКК, причем количество операций постоянно увеличивается.
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
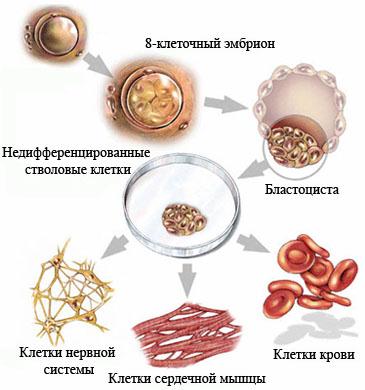
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 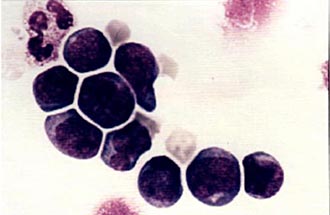 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Выделяют два основных вида ТКМ:
- 1)аллогенную (АллоТКМ) — при которой больному вводится костный мозг от родственного или неродственного совместимого донора;
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
- 2)аутологичную (АутоТКМ) — когда реципиент получает предварительно заготовленный собственный костный мозг;
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Аллогенная трансплантация костного мозга:
- 1) острые лейкозы;
- 2) хронический миелолейкоз;
- 3) тяжелая апластическая анемия;
- 4) гемоглобинопатии;
- 5) врожденные иммунодефициты и нарушения метаболизма.
Аутологичная трансплантация костного мозга:
- 1) злокачественные лимфомы;
- 2) некоторые солидные опухоли;
- 3) аутоиммунные заболевания.
В связи с ограниченным количеством родственных гистосовместимых доноров, которые имеются лишь у 20- 25% больных, в последние годы нашла применение АлТКМ от неродственных HLA-идентичных доноров. Для этих целей созданы международные регистры, позволяющие подобрать потенциального донора костного мозга и оптимизировать прогноз у пациентов, для которых АллоТКМ предпочтительнее (острые лейкозы, хронический миелолейкоз) или является методом выбора (апластическая анемия, гемоглобинопатии, иммунодефициты, нарушения метаболизма). Общее число зарегистрированных доноров в мире превышает 5 миллионов человек, в том числе в России — около 10 тысяч.
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
При любой методике ТКМ/ТСКК можно выделить следующие этапы:
- 1) определение показаний и противопоказаний;
- 2) выбор донора (при аллогенной трансплантации);
- 3) получение костного мозга/стволовых клеток их обработка, хранение и введение;
- 4) кондиционирование (иммуносупрессивная терапия);
- 5) профилактика и лечение осложнений периода цитопении;
- 6) профилактика и лечение поздних осложнений.
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
При некоторых заболеваниях трансплантация является методом выбора (тяжелые формы апластической анемии, гемоглобинопатии, врожденных иммунодефицитов и нарушений метаболизма). В ряде случаев ТКМ/ТСКК проводится при солидных опухолях и аутоиммунных заболеваниях. Данная методика имеет возрастные ограничения: АутоТКМ/ТСКК может быть выполнена у лиц моложе 65 лет, АллоТКМ от HLA-идентичного родственника — моложе 55 лет, неродственная АллоТКМ — моложе 50 лет.
Проведение трансплантации противопоказано при:
- 1) нарушении функции внутренних органов (почек, печени, легких, сердечно-сосудистой системы);
- 2) активной инфекции;
- 3) плохом общесоматическом статусе (индекс ВОЗ > I)
- 4) резистентном к химиотерапии рецидиве солидной опухоли или
- онкогематологического заболевания;
- 5) рефрактерности к трансфузиям тромбоцитов.
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
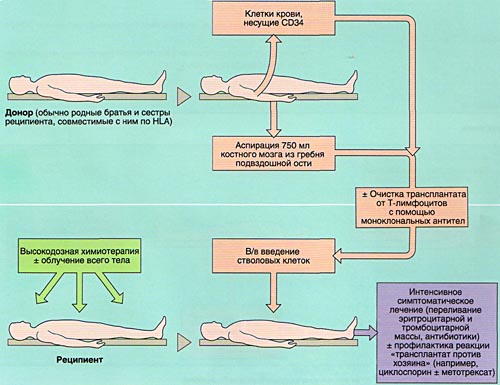
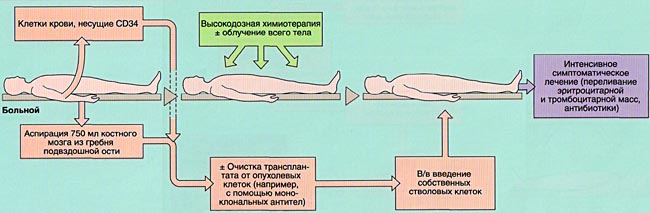
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
Аспирация костного мозга производится под эндотрахеальным наркозом из задних гребней подвздошной кости, при необходимости — также из передних гребней и грудины. Для этого используют удлиненные иглы типа иглы Кассирского и шприцы объемом 20 см3, содержащие гепарин. Во избежание значительного разведения периферической кровью из каждого прокола кости аспирируют не более 5-6 мл костномозговой взвеси, которую фильтруют и помещают в специальные контейнеры. В каждом контейнере подсчитывают количество ядросодержащих клеток. Для восстановления кроветворения при АутоТКМ требуется получить не менее 1,5×106 ядросодержащих клеток на кг массы тела реципиента, при родственной АллоТКМ — не менее 2х106/кг (у больных апластической анемией — не менее 3х106/кг), при неродственной АлТКМ — не менее 3х106/кг. Объем аспирируемой костномозговой взвеси составляет около 1,5 л.
Для сохранения жизнеспособного костного мозга перед АутоТКМ (между аспирацией и инфузией клеток проходит от 2-3 недель до нескольких лет) после фракционирования его консервируют в жидком азоте под защитой криопротектора (чаще всего — диметилсульфоксида).
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
Задача кондиционирования — обеспечить глубокую депрессию иммунной системы, а при онкологических заболеваниях и уничтожение оставшихся опухолевых клеток при умеренной токсичности для других органов и систем, а также создании условий для успешного приживления трансплантата.
Для проведения кондиционирования используются стандартные протоколы, в которых указываются дни, часы, дозы и длительность введения цитостатиков, симптоматических препаратов (антибактериальных, седативных, противорвотных и др., объем и характер инфузии), при необходимости — порядок проведения лучевой терапии. Протоколы кондиционирования различаются в зависимости от характера заболевания и типа трансплантации.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Профилактика инфекционных осложнений начинается в среднем за 2 недели до трансплантации и включает:
- 1) помещение больного в стерильный бокс и проведение необходимых санитарно-гигиенических мероприятий (обработка кожи, слизистых оболочек и перианальной области дезинфицирующими растворами);
- 2) подавление микрофлоры кишечника с помощью антибактериальных и противогрибковых препаратов.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Приживление костного мозга или СКК периферической крови констатируют по результатам анализа костного мозга. Вскоре количество нейтрофилов достигает > 0,5*109/л, а тромбоцитов > 20>
Источник
Что такое стволовые клетки и как их получают?
С каждым годом о стволовых клетках говорят все чаще: они используются в различных областях медицины, а также в косметологии. Но что такое стволовые клетки, откуда их берут, и каждый ли человек имеет доступ к этому уникальному оздоровительному ресурсу?
Что такое «стволовые клетки»
Это так называемые «незрелые» или недифференцированные клетки, которые есть в организме каждого живого многоклеточного существа. То есть, организм любого млекопитающего, в том числе, человека, снабжен определенным «запасом» стволовых клеток. Их главные особенности — возможность самообновляться и образовывать новые такие же клетки, делиться, а также принимать функции любых тканей и органов (это называется дифференциацией клеток). Впервые термин «стволовая клетка» стали использовать в 1909 году. Роль этих клеток изучали ученые во многих странах мира в течение практически всего ХХ века, постоянно дополняя знания о роли стволовых клеток в организме и возможностях их использования. Также применяется термин «аутологичные» (собственные) стволовые клетки.
Из стволовых клеток в период внутриутробного развития формируются все внутренние органы, сосуды, кожа, все остальные ткани. Так как процесс дифференциации клеток происходит до рождения, наибольшее количество стволовых клеток содержит именно развивающийся организм, а к моменту появления на свет больше всего стволовых клеток сохраняется в пуповинной крови, ткани пуповины и плаценте.
В организме взрослого человека тоже есть стволовые клетки. Это своего рода «ремкомплект», которые организм использует для того, чтобы помочь восстановлению и обновлению органов и тканей. Но чем старше человек, тем стволовых клеток меньше, и тем меньше возможностей «починить» пострадавший орган. Снижение количества стволовых клеток и замедление их производства организмом — естественный процесс, являющийся частью процесса физического старения.
Лечение стволовыми клетками
В 70-х годах ХХ века стало популярным омоложение стволовыми клетками — «инъекции молодости», которые могли позволить себе западные актеры и советская партийная номенклатура: тем, кто не хотел поддаваться влиянию возраста и имел достаточно средств, вводили (трансплантировали) стволовые клетки для активизации процессов омоложения организма. Сегодня препараты стволовых клеток активно применяются в косметологии и геронтологии.
Огромный интерес и перспективы для науки представляют возможности биопрепаратов стволовых клеток в лечении многих болезней, в том числе — тяжелых и ранее считавшихся неизлечимыми. Список этих заболеваний достигает нескольких десятков.
Широкие возможности открывает терапия стволовыми клетками в реконструктивной медицине. Во многих странах мира, в том числе — в Украине их применяют при лечении химических и термических ожогов высокой степени. Благодаря способности стволовых клеток дифференцироваться в клетки любых тканей организма, они помогают восстановить поврежденный кожный покров на больших участках. Если при этом используются аутологичные стволовые клетки, отсутствует риск отторжения, возможный при применении донорского материала.
Еще одна перспективная сфера применения препаратов стволовых клеток — кардиология. Уже сейчас в Украине проводятся их клинические испытания при ишемической кардиомиопатии, нарушениях сократительной функции сердца. Биопрепарат стволовых клеток может помочь пациентам с тяжелыми сердечными патологиями выжить в ожидании трансплантации сердца.
В нашей стране также проводятся исследования эффективности препарата стволовых клеток при циррозе печени, у врачей в Украине и других странах уже есть практика успешного применения биопрепарата при тяжелых патологиях поджелудочной железы.
Использование недифференцированных клеток может продлить жизнь и значительно улучшить ее качество людям с сахарным диабетом. Известно, что при этом заболевании развиваются различные по степени тяжести поражения сосудов, из-за чего возникают трофические язвы на ногах, так называемая «диабетическая стопа», поражаются артерии. Сейчас на завершающей стадии клинические испытания препарата стволовых клеток при этих патологиях. Все эти исследования проводятся в Украине. В мире также получено много положительных результатов использования препаратов стволовых клеток при лечении рассеянного склероза, болезни Крона, болезни Паркинсона, сердечной недостаточности, ревматоидного артрита, лейкозов, злокачественных опухолей разных локализаций.
Стволовые клетки человека: какими они бывают
Стволовые клетки бывают разными в зависимости от происхождения, то есть — в зависимости от того, из какого исходного материала их получают. Кроме эмбриональных и фетальных стволовых клеток, получение которых имеет серьезные этические ограничения, существует также возможность выделения «незрелых» клеток без какого-либо вреда для организма, не противоречащая моральным и этическим нормам. К полученным таким образом стволовым клеткам относятся:
- Постнатальные («взрослые») стволовые клетки. Это клетки взрослого организма, которые, как уже было сказано, содержатся и производятся в нем в небольшом количестве. Проблема в том, что такие клетки часто находятся на определенной стадии дифференцировки, а это значительно сужает возможности их применения. Однако есть и преимущества: можно получить аутологичные постнатальные стволовые клетки, а это означает, что реципиент не будет их отторгать после трансплантации, так как это его собственный биологический материал.
- Стволовые клетки пуповинной крови. Относятся к постнатальным стволовым клеткам, но из всех клеток взрослого, зрелого организма они в наименьшей степени дифференцированы. Это означает, что в случае необходимости их можно использовать при широком спектре заболеваний, в геронтологии, восстановительной медицине, ведь они имеют наибольший «ремонтный» потенциал, дифференцируясь в клетки тех органов или тканей, которые необходимо «починить».
В зависимости от «задач», которые могут выполнять незрелые клетки организма, их разделяют на три вида:
- Гемопоэтические стволовые клетки называются также кроветворными, так как они дифференцируются в клетки крови. Они содержатся как в пуповинной крови, так и в костном мозге — именно их часто используют для трансплантации при злокачественных заболеваниях крови.
- Мезенхимальные стволовые клетки называют стромальными и мультипотентными. Их особенность заключается в способности дифференцироваться в клетки костной, хрящевой и жировой ткани. Эти клетки выделяют из пуповинной крови, пупочного канатика, плаценты. Они активно используются в терапии диабетической стопы (тяжелого осложнения сахарного диабета, при восстановлении кожных покровов), а также заболеваний опорно-двигательного аппарата, в частности — суставов.
- Тканеспецифичные клетки являются прогениторными, то есть, «клетками-предшественницами». Они содержатся в органах и тканях, организм задействует их при необходимости обновления клеточной массы того или иного органа или ткани. В отличие от других недифференцированных стволовых клеток, которые могут делиться неограниченное количество раз, тканеспецифичные клетки такой способности не имеют.
В терапевтических целях используют гемопоэтические и мезенхимальные стволовые клетки, чаще всего — выделенные из пуповинной крови, пупочного канатика и плаценты.
Стволовые клетки пуповинной крови: преимущества
Главная особенность стволовых клеток пуповинной крови — они могут быть аутологичными. Родители, сохранившие пуповинную кровь (а часто также пуповину и плаценту) родившегося ребенка, обеспечивают ему пожизненную страховку на случай тяжелого заболевания или травмы. Ежегодно в мире совершаются новые открытия в медицине, связанные с возможностями применения биопрепаратов стволовых клеток. Поэтому в будущем ребенок, имеющий такую «страховку», получит лекарство от множества возможных болезней. Так как выделенные стволовые клетки являются аутологичными, при трансплантации не возникнет иммунного конфликта и новые клетки не будут отторгаться организмом.
Одно из преимуществ сбора пуповинной крови — полная безопасность и безболезненность процесса. Получение стволовых клеток из этого биологического материала, а также из пупочного канатика и плаценты, не противоречит никаким этическим нормам.
Аутологичные стволовые клетки можно использовать не только непосредственно для ребенка, из крови которого они выделены. Они также в некоторых случаях могут подойти для лечения его родных братьев и сестер, иногда — кого-либо из родителей, ведь есть вероятность иммунного сходства с родными донора.
Из сохраненных стволовых клеток также можно получить биопрепарат, который используют в косметологических целях и в геронтологии для омоложения организма.
Итак, главные преимущества сбора и хранения клеток пуповинной крови и плаценты:
- Безопасность и доступность сбора в любом роддоме.
- Полное иммунное сходство при дальнейшем использовании.
- Возможность использования клеток для близких родственников.
- Этичность и гуманность: при выделении клеток организм не страдает и для него нет никаких рисков.
Хранение стволовых клеток
Стволовые клетки пуповинной крови, а также биологический материал, выделенный после сбора плаценты и пуповины, хранится в Криобанке. Здесь вы можете увидеть, как происходят все процессы, связанные с обработкой и хранением пуповинной крови, плаценты и пуповины, в нашем Криобанке.
После предварительной подготовки выделенные стволовые клетки подвергаются криозаморозке и сохраняются в специальных емкостях с жидким азотом любое количество времени. Как только они понадобятся владельцу, Криобанк выдаст их по первому требованию и доставит в полной сохранности в любую клинику, где будет использоваться биопрепарат. Все о хранении стволовых клеток пуповинной крови вы можете узнать на нашем сайте или у консультантов Криобанка Института клеточной терапии.
Источник