Способы получения солей видеоурок
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Соли»
С солью люди знакомы еще из глубокой древности. Значение соли отражено во многих пословицах и поговорках: «Хлеб да соль» — такое пожелания использовали люди вовремя приема пищи, в этом выражении подчеркивалось значение соли наравне с хлебом. Хлеб и соль стали символом гостеприимства и радушия русской души. Говорят: «Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается, двое людей за 2 года съедают пуд соли (16 кг). Каждый человек в год потребляет 3 – 5,5 кг соли.
В названиях многих городов и поселков присутствует слово соль: Соликамск, Соль-Илецк, Усолье, Солт-Лейк-Сити, Солтвиль, Зальцбург и др.
Соли образуют мощные отложения в земной коре. В Соль-Илецке, толщина пласта соли превышает 1,5 км. Огромное количество соли содержится в воде морей и океанов. Солью, извлеченной из Мирового океана, можно было бы засыпать сушу земного шара слоем 130 м. Во многих странах Азии и Африки соль добывают из соляных озер, а в европейских странах – из соляных шахт.
Соли могут иметь различную окраску: голубую, синюю, фиолетовую розовую и т.д. Некоторые озера имеют окраску из-за присутствия в них окрашенных солей. Например: Розовое, Красное, Малиновое.
Слово «соль» мы часто используем в повседневной жизни, а в химии соли – сложные вещества, состоящие из ионов металла и кислотного остатка.
По составу соли схожи с кислотами, но в кислотах атом водорода и кислотный остаток, в солях – ион металла и кислотный остаток. Поэтому соли являются продуктами замещения атомов водорода в кислоте на ионы металла. Например, поваренная соль – NaCl – продукт замещения атома водорода в соляной кислоте – HCl – на ион натрия. Заряд иона натрия 1+, хлора 1-, т.к. соединение электронейтрально, то формула поваренной соли – Na + Cl — .
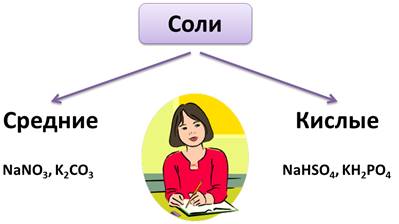
Все соли делятся на средние соли и кислые. В состав средней соли входят ионы металла и кислотного остатка, кислые соли состоят из ионов металла и кислотного остатка, содержащего 1 или 2 иона водорода. Посмотрите, NaNO3, K2CO3 – средние соли, а NaHSO4, KH2PO4 – кислые соли. Кислые соли образуют только многоосновные.
Выведение формулы соли
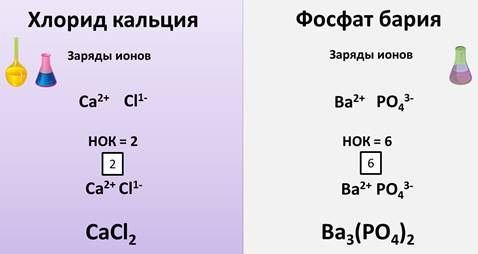
Если нужно вывести формулу хлорида кальция, то поступают следующим образом, обозначают заряды ионов, из которых состоит соль – Ca 2+ , Cl 1- . Заряд иона кальция 2+, т.к. это металл II A группы, у хлора заряд 1-, т.к. в соляной кислоте заряд иона хлора 1-. Находим наименьшее общее кратное числовых значений зарядов ионов кальция и хлора, т.е. 2 и 1, оно равно 2. Находим индексы, разделив наименьшее общее кратное на величины зарядов: 2 делим на 2 = 1. Индекс у кальция 1, он не пишется, 2 делим на 1 = 2, значит, индекс у хлора 2. Записываем формулу: CaCl2.
Аналогично выводят формулы солей кислородсодержащих кислот. Выведем формулу фосфата бария – бариевой соли фосфорной кислоты. Обозначаем заряды ионов, из которых состоит соль, т.е. у Ва будет 2+, т.к. это металл II A группы, у РО4 – кислотного остатка фосфорной кислоты будет 3-, т.к. в составе кислоты 3 атома водорода. Находим наименьшее общее кратное числовых значений зарядов ионов бария и фосфат-иона. Наименьшее общее кратное 6, 6 делим на 2 = 3, значит, индекс у бария 3, индекс у фосфат-иона будет 2, т.к. 6 делим на 3 = 2. Отсюда, формула будет иметь вид – Вa3(PO4)2.
Для того чтобы дать название солей, поступают следующим образом: сначала называют ион кислотного остатка в именительном падеже, затем ион металла в родительном падеже. Если металл имеет переменную степень окисления, то при названии солей в скобках римскими цифрами указывают численное значение степени окисления. Например, соль Al2(SO4)3 называется сульфат алюминия, т.к. кислотный остаток серной кислоты – SO4 2- имеет название – сульфат.
Назовем соль Fe(NO3)3. Название начинаем с иона кислотного остатка – остаток азотной кислоты называется нитрат, добавляем название иона металла. Получается нитрат железа, т.к. железо имеет переменную степень окисления, то в скобках указываем численное значение степени окисления. В данном случае, степень окисления железа +3, поэтому соль называется нитрат железа (III).
По растворимости в воде соли делят на: растворимые в воде, малорастворимые и нерастворимые. Для того чтобы определить растворима или нерастворима соль в воде, используют таблицы растворимости. Если на пересечении иона металла и кислотного остатка стоит буква «Р», значит, соль растворима в воде, если на пересечении стоит буква «М», значит, соль малорастворима, если буква «Н», то нерастворима. Из таблицы видно, что соли азотной кислоты – нитраты, все растворимы, почти все соли соляной кислоты – хлориды тоже растворимы, за исключением AgCl, PbCl2. Растворимы соли натрия и калия. Растворимы все соли серной кислоты – сульфаты, кроме BaSO4, PbSO4, CaSO4, Ag2SO4. Нерастворимы все фосфаты, силикаты, карбонаты, силикаты, сульфиды, кроме этих солей для натрия и калия.
Рассмотрим несколько примеров солей.
Поваренная соль – NaCl – хлорид натрия, хорошо растворяется в воде, она очень важна для человека, животных и растений: в крови создает условия для жизни красных кровяных телец, в мышцах способствует возбудимости, в желудке образует соляную кислоту. Хлорид натрия используют для получения натрия, хлора, соляной кислоты, приготовления пищи, консервирования.
Карбонат кальция – СаСО3 – нерастворимая в воде соль, из нее построены раковины моллюсков, покровы раков, кораллы. Остатки коралловых полипов образуют атоллы и коралловые рифы. Наиболее известен Большой Барьерный риф в Австралии. Их раковины за много миллионов лет сформировали пласты соединений кальция – известняк. Мрамор, используемый в строительстве, тоже имеет формулу СаСО3, как и мел, который добывают из меловых гор или карьеров. Из известняка получают негашеную и гашеную известь, которую используют в строительстве. Из карбоната кальция строят свой скелет наземные животные. Мрамор идет на изготовление статуй, им отделаны станции метро.
Фосфат кальция – Са3(РО4)2 – нерастворим в воде. Это основная часть фосфоритов и апатитов. Из них производят фосфорные удобрения, без которых невозможно получить высокие урожаи. Кроме того, фосфат кальция входит в состав костей животных.
Источник
Химические свойства и способы получения солей
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например , оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например , гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например , гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например , гидроксид меди (II) реагирует с серной кислотой:
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например , гидроксид цинка (II) реагирует с соляной кислотой:
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например , аммиак реагирует с соляной кислотой:
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например , соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например , гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например , при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например , гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например , кислород окисляет сульфит натрия до сульфата натрия:
7. Еще один способ получения солей — взаимодействие металлов с неметаллами . Таким способом можно получить только соли бескислородных кислот.
Например , сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах . Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например , железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например , хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например , хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например , гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
Например , гидроксокарбонат меди (II) диссоциирует в две ступени:
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Например , сульфат алюминия-калия диссоциирует в одну ступень:
Смешанные соли диссоциируют также одноступенчато.
Например , хлорид-гипохлорид кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например , тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
2. Соли взаимодействуют с кислотными и амфотерными оксидами . При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например , карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например , сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например , гидрокарбонат калия взаимодействует с гидроксидом калия:
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например , сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например , гидрокарбонат калия взаимодействует с гидросульфатом калия:
Некоторые кислые соли могут реагировать со своими средними солями.
Например , фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например , железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например , при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например , нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
- Галогениды серебра (кроме AgF):
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
- Карбонаты и гидрокарбонаты:
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
7. Соли проявляют восстановительные свойства . Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например , йодид калия окисляется хлоридом меди (II):
8. Соли проявляют и окислительные свойства . Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Источник