Водородные соединения азота
С водородом азот образует два соединения: аммиак NH3 и гидразин N2H4(H2N – NH2). Наибольшее значение имеет аммиак.
В лаборатории получают слабым нагреванием смеси хлорида аммония с гидроксидом натрия:
NH4Cl + NaOH = NaCl + NH3 + H2O
Основным промышленным способом получения аммиака является синтез его из азота и водорода
( Катализатор Pt; t = 450 — 500 0 С; Р = 250 атм)
Равновесие обратимой реакции смещается вправо действием высокого давления ≈ 30МПа.
NH3 – бесцветный газ с резким характерным запахом, почти в 2 раза легче воздуха. Молекула NH3 поляризована – общие электронные пары сдвинуты к азоту. Кроме того, у атома азота остается неподеленной пара электронов. Это дополнительно увеличивает полярность и обуславливает многие свойства аммиака. Жидкий аммиак, подобно воде, хороший растворитель ионных соединений. Молекулы в жидком аммиаке ассоциированы за счет образования водородных связей.
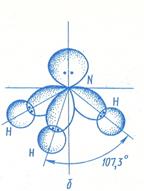
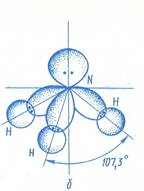
Расположение связей в аммиаке тетраэдрическое, причем неподеленная пара электронов атома азота занимают одну из вершин тетраэдра.
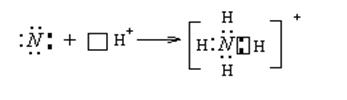
Аммиак – очень реакционно-способное вещество. Для него характерны реакции окисления и присоединения (благодаря неподеленной паре электронов). Наличие неподеленной пары определяет основные свойства аммиака, который может присоединять протон, образуя ион аммония NH4 + .
NH3 очень хорошо растворим в воде, но максимальная концентрация ω(NH3)= 25%. В растворе имеют место равновесия:
NH4OH ↔ NH4 + + OH – KдNH4OH = 1,8 • 10 — 5
Основная масса NH3 в растворе находится в виде гидрата аммиака NH3 · H2O. Поэтому, хотя NH4OH диссоциирует почти нацело, его условно считают слабым основанием. Поскольку азот в NH3 имеет низкую степень окисления –3, аммиак является восстановителем в ряде реакций.
В кислороде аммиак горит без катализатора:
а в присутствии катализатора платины
При нейтрализации раствора аммиака кислотами образуются растворы солей аммония, содержащие ион NH4 + .
В этих реакциях ион аммония подобен ионам одновалентных металлов.
При замещении в молекуле аммиака 3-х атомов водорода получаются нитриды, содержащую группу N -3 , 2-х атомов водорода – имиды NН -2 , одного атома водорода — амиды NН2 — .
2 NH3 + 6Na = 2Na3N +3H2 нитрид натрия
NH3 +2Na = Na2HN + H2 имид натрия
2 NH3 +2Na = 2NaH2N + 3H2 амид натрия
NH3 всегда — восстановитель, окисляется до N2 или NO.
t
На этом свойстве основано применение NH3 и его солей в процессе пайки металлов – снятие оксидной пленки с поверхности.
CuO + NH4Cl = Cu +N2 +HCl + H2O
Источник
Водородные соединения азота
Химия азота
Азот (лат. nitrogenium) в свободном состоянии газ без цвета и запаха. Азот – основной компонент атмосферы Земли (78,09% по объему или 75,6% по массе, всего около 4·10 15 т). Мы живем в азотной атмосфере, умеренно обогащенной кислородом и в малых количествах другими химическими элементами.
В космосе он занимает 4-е место вслед за водородом, гелием и кислородом. В живых организмах его до 0,3% в виде соединений. Растения, получая азот из почвы в виде минеральных солей, используют его для синтеза белков, витаминов и других жизненно важных веществ.
Азот относится к органогенам, наряду с углеродом, водородом и кислородом – элементы, которые чаще всего содержатся в органических веществах. Все важнейшие части клеток (протоплазма и ядро) построены из белковых веществ. Без белка нет жизни, а без азота нет белка.
Свободный азот несколько легче воздуха. Он плохо растворим в воде. Прочность молекулы азота велика. Даже при 3300°С только одна из тысяч молекул N2 распадается на атомы. Поэтому свободный азот в обычных условиях инертен к подавляющему большинству веществ. Для того чтобы азот вступил в химическую реакцию, требуется предварительная активация его молекул путем нагревания, облучения, действие катализатора или другими способами.
Из металлов свободный азот реагирует в обычных условиях только с литием, образуя нитрид:
6 Li + N 2 = 2 Li 3 N
С Na, Ca, Mg реакция идет только при нагревании. С кислородом азот взаимодействует только в электрической дуге (или при грозовом разряде в атмосфере):
N 2 + O 2 = 2 NO
С водородом реакция идет при нагревании (t ≈ 450-500 0 С), под давлением и в присутствии катализатора
Причина инертности молекулярного азота – крайне прочная ковалентная неполярная связь. Два атома в молекуле удерживаются одной σ — связью и двумя π- связями. Т.е. связи в молекуле азота неравноценны. На разрушение молекулы азота на атомы затрачивается довольно большое количество энергии:
N 2 = 2 N ∆ H 0 = 946 кДж/моль
Строение молекулы N2
Водородные соединения азота
С водородом азот образует два соединения: аммиак NH 3 и гидразин N 2 H 4 (H2N – NH2). Наибольшее значение имеет аммиак.
В лаборатории получают слабым нагреванием смеси хлорида аммония с гидроксидом натрия:
NH 4 Cl + NaOH = NaCl + NH 3 + H 2 O
Основным промышленным способом получения аммиака является синтез его из азота и водорода
N 2 + 3 H 2 ↔ 2 NH 3 ∆ Н 0 = — 82,4
( Катализатор Pt ; t = 450 — 500 0 С; Р = 250 атм)
Равновесие обратимой реакции смещается вправо действием высокого давления ≈ 30МПа.
NH3 – бесцветный газ с резким характерным запахом, почти в 2 раза легче воздуха. Молекула NH3 поляризована – общие электронные пары сдвинуты к азоту. Кроме того, у атома азота остается неподеленной пара электронов. Это дополнительно увеличивает полярность и обуславливает многие свойства аммиака. Жидкий аммиак, подобно воде, хороший растворитель ионных соединений. Молекулы в жидком аммиаке ассоциированы за счет образования водородных связей.
Расположение связей в аммиаке тетраэдрическое, причем неподеленная пара электронов атома азота занимают одну из вершин тетраэдра.
Аммиак – очень реакционно-способное вещество. Для него характерны реакции окисления и присоединения (благодаря неподеленной паре электронов). Наличие неподеленной пары определяет основные свойства аммиака, который может присоединять протон, образуя ион аммония NH 4 + .
NH3 очень хорошо растворим в воде, но максимальная концентрация ω(NH3)= 25%. В растворе имеют место равновесия:
Основная масса NH3 в растворе находится в виде гидрата аммиака NH3 · H2O. Поэтому, хотя NH4OH диссоциирует почти нацело, его условно считают слабым основанием. Поскольку азот в NH3 имеет низкую степень окисления –3, аммиак является восстановителем в ряде реакций.
В кислороде аммиак горит без катализатора:
4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O ,
а в присутствии катализатора платины
4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O
При нейтрализации раствора аммиака кислотами образуются растворы солей аммония, содержащие ион NH4 + .
В этих реакциях ион аммония подобен ионам одновалентных металлов.
NH3 всегда — восстановитель, окисляется до N2 или NO.
t
На этом свойстве основано применение NH3 и его солей в процессе пайки металлов – снятие оксидной пленки с поверхности.
CuO + NH4Cl = Cu +N2 +HCl + H2O
Аммиак участвует в реакциях комплексообразования, где NH3 является лигандом – донором электронов.
Водные растворы NH3 используют для получения гидроксидов металлов.
Соли аммония все растворимы в воде, разлагаются при температуре различным образом
С оксидами азота связаны серьезные экологические проблемы. Увеличение их концентрации в атмосфере приводит к образованию азотной кислоты и соответсвенно кислотных дождей.
N2O3 взаимодействует с водой, образует неустойчивую азотистую кислоту HNO2, которая существует только в разбавленных растворах, так как легко разлагается
HNO2 может быть более сильным восстановителем, чем HNO3, о чём свидетельствуют значения стандартных электродных потенциалов.
HNO 3 + 2 Н + + 2е = HNO 2 + Н2О Е 0 = + 0,93 В
HNO2 + Н + + 1 е = NO + H2O Е 0 = + 1,10 В
HNO2 + 1e = NO + H + Е 0 = + 1,085 В
Ее соли нитриты – устойчивы. HNO2 — кислота средней силы (К ≈ 5 · 10 –4 ). Наряду с кислотной диссоциацией в незначительной степени идет диссоциация с образованием NO + и OH – .
Степень окисления азота в нитритах промежуточная (+3), поэтому в реакциях он может вести себя и как окислитель, и как восстановитель, т.е. обладает окислительно-восстановительной двойственностью.
Сильные окислители переводят NO2 – в NO3 – .
Сильные восстановители обычно восстанавливают HNO2 до NO.
Может происходить также процесс диспропорционирования, одновременного увеличения и уменьшения степени окисления атомов одного и того же элемента.
3 HNO 2 = HNO 3 + 2 NO + H 2 O
Нитриты обладают токсичностью: переводят гемоглобин в метгемоглобин, не способный переносить кислород и они служат причиной образования в продуктах питания нитрозааминов R2N–NO – канцерогенных веществ.
Важнейшее соединение азота – HNO 3
Азотная кислота – важнейший продукт основной химической промышленности. Идет на приготовление взрывчатых веществ, лекарственных веществ, красителей, пластических масс, искусственных волокон и др. материалов.
HNO3 – бесцветная жидкость с резким удушливым запахом, дымящая на воздухе. В небольших количествах образуется при грозовых разрядах и присутствует в дождевой воде.
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету или при нагревании процесса разложения
4 HNO 3 = 4 NO 2 + 2 H 2 O + O 2
HNO3 – очень опасное вещество.
Важнейшее химическое свойство HNO3 состоит в том, что она является сильным окислителем и поэтому взаимодействует почти со всеми металлами кроме Au, Pt, Rh, Ir, Ti, Ta, металлы Al, Fe, Co, Ni и Cr она «пассивирует». Кислота же в зависимости от концентрации и активности металла может восстанавливаться до соединений:
+4 +3 +2 +1 0 -3 -3
и также образуется соль азотной кислоты.
Как правило, при взаимодействии азотной кислоты с металлами не происходит выделения водорода. При действии HNO3 на активные металлы может получаться водород. Однако атомарный водород в момент выделения обладает сильными восстановительными свойствами, а азотная кислота – сильный окислитель. Поэтому водород окисляется до воды.
Свойства концентрированной и разбавленной HNO 3
1) Действие концентрированной HNO3 на малоактивные металлы (Cu, Hg, Ag)
2) Действие разбавленной HNO3 на малоактивные металлы
3) Действие концентрированной кислоты на активные металлы
4) Действие разбавленной HNO3 на активные металлы
Образование продуктов зависит от концентрации, чем выше концентрация, тем менее глубоко она восстанавливается. Реагирует со всеми металлами, кроме Au, Pt, W. Концентрированная HNO3 не взаимодействует при обычных условиях с Fe, Cr, Al, которым она пассивирует, но при очень сильном нагревании реагирует с этими металлами.
Большинство неметаллов и сложных веществ восстанавливается HNO3 до NO (реже NO2).
HNO3 – сильная одноосновная кислота, образует только средние соли -нитраты, которые получают действием ее на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Их растворы обладают незначительными окислительными свойствами.
При нагревании нитраты разлагаются; нитраты щелочных металлов превращаются в нитриты и выделяется кислород.
Состав других продуктов зависит от положения металла в РСЭП.
Левее Mg = MeNO2 + O2
MeNO3 = Mg – Cu = MeO + NO2 + O2
Источник
Соединения азота с водородом.
Пространственная структура молекулы NH3 близка к тетраэдрической, так как атом азота предоставляет для связывания с водородом не чистые р-орбитали, а sp 3 -гибридные орбитали. При этом неподеленная электронная пара тоже находится на sp 3 -гибридной орбитали. Благодаря неподеленной электронной пары, молекула аммиака проявляет оснóвные свойства, образуя с катионом водорода ковалентную связь по донорно-акцепторному механизму, в результате чего возникает комплексный ион – катион аммония, в котором катион водорода Н + — комплексообразователь, а молекула NH3 – лиганд
Н + □ + :NH3 = [NH4] +
При обычных условиях аммиак – газ (Ткип. == -33 0 С). Вследствие полярности молекулы и ее способности образовывать водородные связи аммиак хорошо растворяется в воде. При растворении в воде аммиак взаимодействует с ней, образуя слабое основание – гидрат аммиака NH3*Н2О, диссоциирующее с образованием иона аммония:
Аммиачная вода имеет запах аммиака и называется нашатырным спиртом.
С сильными кислотами аммиак образует соли аммония:
При нагревании щелочного раствора гидрата аммиака из него улетучивается аммиак, что определяется посинением универсальной индикаторной бумажки, помещенной над раствором:
Эта реакция является качественной реакцией на катион NH4 + и на присутствие аммиака в системе.
Соли аммония термически неустойчивы и разлагаются при нагревании:
В тех случаях, когда анион аммонийной соли содержит окислитель, при высокой температуре происходит реакция внутримолекулярного окисления-восстановления, в которой атом азота аммония, имеющий степень окисления -3, выступает восстановителем:
Аммиак не горит на воздухе, но сгорает в чистом кислороде:
Продуктом окисления аммиака другими окислителями является азот:
Получение аммиака.
В лаборатории аммиак получают действием щелочи на соли аммония при нагревании:
В промышленности аммиак синтезируют из азота воздуха. Реакция синтеза аммиака из азота и водорода – обратимая, гомогенная, экзотермическая реакция, в результате которой происходит уменьшение объемов газообразных веществ, так как из 4-х объемов газовой смеси образуется 2 объема аммиака:
Для увеличения выхода конечного продукта в данной системе, в соответствии с принципом Ле Шателье, следует понизить температуру, увеличит давление и систематически удалять аммиак из зоны реакции.
Кислородные соединения азота.
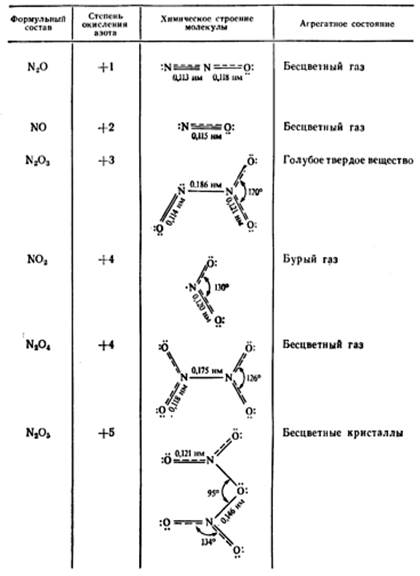
Азот образует с кислородом следующие оксиды: N2O, NO, N2O3, NO2, N2O5. Непосредственным окислением молекулярного азота получается лишь один NO. Другие оксиды образуются при восстановлении или окислении NO. На воздухе NO практически мгновенно окисляется до NO2:
Оксиды N2O и NO – несолеобразующие оксиды. Остальные оксиды азота – кислотные. При поглощении водой оксида N2O3 образуется азотистая кислота, при взаимодействии N2O5c водой образуется азотная кислота:
Оксид азота (IV) NO2 является смешанным оксидом, так как при его растворении образуется сразу две кислоты – HNO2 и HNO3:
Это реакция диспропорционирования.
При растворении NO2 в щелочах образуются соответствующие соли – нитриты и нитраты:
В окислительно-восстановительных реакциях оксиды азота (за исключением N2O5) могут быть и окислителями и восстановителями, так как содержат атомы азота в промежуточных степенях окисления:
Окислительно-восстановительная двойственность NO2 проявляется и при взаимодействии его с водой (см. выше).
Азотистая кислота
Малоустойчивая, слабая кислота.
Соли этой кислоты – нитриты гидролизуются в водном растворе по аниону, создавая щелочную среду:
В окислительно-восстановительных реакциях нитриты выступают или окислителями, или восстановителями в зависимости от свойств второго реагента:
Азотная кислота.
В молекуле HNO3 степень окисления атома азота +5, а его валентность равна IV. Атом азота может образовывать только четыре ковалентные связи (три за счет неспаренных р-электронов по обменному механизму и одну за счет неподеленной электронной пары по донорно-акцепторному механизму).
Соли азотной кислоты – нитраты – хорошо растворимы в воде и не подвергаются гидролизу по аниону.
В окислительно-восстановительных реакциях соли азотной кислоты и сама кислота являются только окислителями. Причем окислительная активность азотной кислоты намного выше активности солей и зависит от концентрации кислоты в растворе. Азот в степени окисления +5, входящий в состав азотной кислоты, является настолько сильным окислителем в сравнении с катионом водородом, что среди продуктов восстановления азотной кислоты никогда не выделяется водород. Как правило, при окислении неметаллов и малоактивных металлов азотной кислотой выделяется ее устойчивые оксиды: NO2 (если кислота концентрированная) и NO (если кислота разбавленная):
В зависимости от активности восстановителей и концентрации самой кислоты могут образовываться и другие продукты: NH4 + , N2, N2O
Очень сильным окислителем является смесь концентрированных кислот HNO3+HCl (в объемном соотношении 1:3), называемая царской водкой. Эта смесь кислот способна растворять «благородные» металлы:
Соли азотной кислоты – нитраты — термически неустойчивы из-за внутримолекулярных окислительно-восстановительных превращений, в которых окислителем выступает N +5 , а восстановителем – О -2 . Нитраты разлагаются на кислород и соединение, состав которого зависит от природы катиона металла, входящего в состав соли. Когда в состав соли входят катионы щелочного или щелочноземельного металла, т.е. очень активных металлов, стоящих в ряду активности от Li до Mg включительно, то процесс идет до образования нитритов и кислорода:
Если в состав соли входит катион металла средней активности от Al до Cu включительно, процесс разложения идет до оксида металла, оксида азота(IV) и кислорода:
Особое положение занимает нитрат аммония, при термическом разложении которого образуется N2O:
Вследствие сильных окислительных свойств нитритов и нитратов эти соединения чрезвычайно токсичны для организма человека, так как окисляют гемоглобин, вследствие чего он теряет способность переносить кислород из легких в ткани.
Получение азотной кислоты.
В промышленности азотную кислоту получают из аммиака путем его каталитического окисления до оксида азота(II). Полученный оксид азота окисляют до NO2, затем поглощают водой в присутствии кислорода под давлением:
Таким образом получают азотную кислоту с концентрацией 65%.
Азотная кислота – один из важнейших продуктов в химической промышленности. Около 75% производимой кислоты используется для получения минеральных удобрений. Кроме того, она расходуется на получение взрывчатых веществ, ракетного топлива и различных органических нитросоединений.
Азотные удобрения содержат азот в качестве основного питательного элемента для растений. Основные виды азотных удобрений: NaNO3 – чилийская селитра, KNO3 – калийная селитра, NH4NO3 –аммонийная селитра, NH3 – жидкий аммиак, CO(NH2)2 – мочевина. Растения усваивают азот в форме нитрат-аниона, поэтому аммиак, катион аммония и мочевина должны быть предварительно окислены почвенными бактериями в анион NO3 — . При избыточной концентрации нитратов в почве овощи быстро развиваются и созревают, но не успевают перерабатывать нитраты и накапливают их, что наносит большой вред человеку и ускоряет гниение овощей при хранении.
Вопросы для контроля
1. Какие элементы составляют главную подгруппу пятой группы? Каковы закономерности изменения свойств элементов сверху вниз?
2. Какова электронная формула элементов подгруппы азота? Какие валентности и степени окисления характерны для них в соединениях?
3. Охарактеризуйте: а) характерные валентности; б) характерные степени окисления азота. Приведите примеры соединений с различными степенями окисления азота.
4. Какой тип химической связи в молекуле азота?
5. Каковы важнейшие формулы кислотных оксидов элементов подгруппы азота и соответствующих им гидроксидов вам известны?
6. Какие оксиды азота вам известны? Дайте им названия. Укажите валентность и степень окисления азота в каждом оксиде. Какой оксид азота применяется в медицине для наркоза?
7. Опишите физические и химические свойства азотной кислоты.
Задачи и упражнения для самостоятельной работы
1. Смешали 5 г аммиака и 5 г хлороводорода. Что оказалось в избытке и какова масса этого избытка?
2. Вычислить объемы (при н.у.) азота и водорода, необходимые для получения 17 г аммиака.
3. На реакцию с 50 мл раствора сульфата аммония израсходовано 30 мл 2 М раствора хлорида бария. Вычислить молярность раствора сульфата аммония. Сколько граммов сульфата аммония содержалось в 1 л раствора?
4. Соединением 3,648 г Mg с азотом получено 5,048 г нитрида магния. Найдите его формулу.
5. Составьте уравнения реакции азотной кислоты с оксидом железа (III), гидроксидом цинка, карбонатом кальция. Сколько молей азотной кислоты расходуется на реакции с 10 г каждого из этих соединений?
6. Составьте уравнения реакций окисления свинца и серебра разбавленной азотной кислотой, зная, что свинец окисляется до Pb +2 , а серебро – до Ag + .
7. Составьте уравнение реакции окисления кобальта концентрированной азотной кислотой, принимая во внимание, что образуется соль трехвалентного кобальта.
8. Сернистая кислота H2SO3 окисляется азотной кислотой до серной кислоты H2SO4. При этом азотная кислота восстанавливается до оксида азота (II). Составьте уравнение реакции.
9. Сколько литров и молей аммиака требуется для получения 6,3 кг азотной кислоты, считая потери в производстве равными 5%?
10. Какой объем 1 М раствора гидроксида натрия требуется для нейтрализации 50 мл 2 м раствора азотной кислоты?
11. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выделяется бурый газ и газ, образующий с известковой водой Са(ОН)2 белый осадок. Напишите уравнения реакций.
12. Какова массовая доля каждой из образующихся солей, если через 300 г 5,6%-го раствора гидроксида калия пропустили 5,6 л оксида азота (IV)?
Глава X. Фосфор
Электронная конфигурация фосфора 1s 2 2s 2 2p 6 3s 2 3p 3 . В отличие от азота, фосфор имеет во внешнем слое свободные d-орбитали и поэтому образуют соединения, в которых проявляет валентность V. Фосфор существует в природе только в связанном состоянии, причем в основном в виде фосфатов, где он имеет степень окисления +5. Кроме этого существуют соединения, в которых фосфор проявляет и другие возможные степени окисления: -3 и +3. Элементарный фосфор имеет три аллотропные модификации, различающиеся кристаллической структурой: белый, красный, черный. Наиболее реакционноспособным является белый фосфор, который неустойчив уже при обычных условиях. В темноте белый фосфор светится, так как его окисление кислородом воздуха сопровождается свечением.
Фосфор как неметалл взаимодействует с активными Ме, проявляя свойства окислителя и образуя фосфиды:
Фосфиды – соли очень слабой кислоты фосфина РН3, поэтому они легко разлагаются кислотами и даже водой с образованием газообразного фосфина:
В реакциях с галогенами, кислородом и серой фосфор проявляет наиболее для него характерные свойства восстановителя. При избытке окислителя образуются соединения фосфора (V), а при недостатке – соединения фосфора (III):
2P + 3Cl2 = 2PCl3 (хлорид фосфора III)
2P + 5Cl2 = 2PCl5 (хлорид фосфора V)
При окислении фосфора концентрированными азотной или серной кислотами образуется ортофосфорная кислота:
Источник