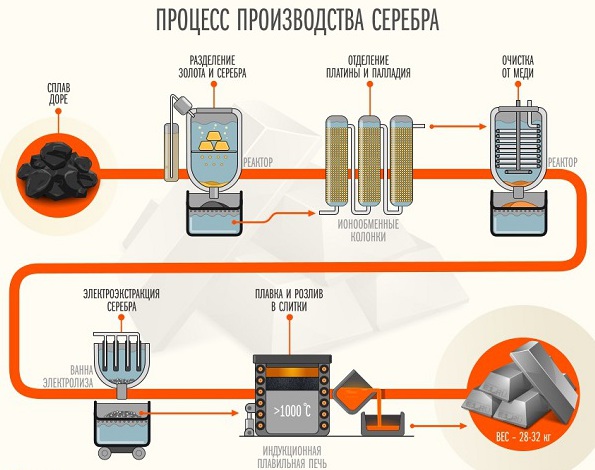
Способы получения серебра
Пирометаллургический метод
Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырье содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°:
Затем обожженный концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди:
Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
Электролизный метод
Электролиз раствора сульфата меди:
Способы получения серебра
Для отделения серебра от пустой породы используется цианидный метод. Метод основан на растворении серебра в растворе цианида натрия за счет окисления кислородом воздуха и перехода в анионный комплекс, с последующим вытеснением цинковой пылью по обменной реакции:
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag.
Основную часть серебра добывают в качестве побочного продукта при переработке свинцово-цинковых и медных руд.
Для получения золота используются его основные физические и химические свойства: присутствие в природе в самородном состоянии, способность реагировать лишь с немногими веществами (ртуть, цианиды). С развитием современных технологий более популярными становятся химические способы.
В 1947 году американские физики Ингрем, Гесс и Гайдн проводили эксперимент по измерению эффективного сечения поглощения нейтронов ядрами ртути. В качестве побочного эффекта эксперимента было получено около 35 мкг золота. Таким образом, была осуществлена вековая мечта алхимиков — трансмутация ртути в золото. Однако экономического значения такое производство золота не имеет, так как обходится во много раз дороже добычи золота из самых бедных руд.
Свойства простых веществ, оксидов, гидроксидов и солей.
Соединения двухвалентной меди
Оксид меди (II) — чёрного цвета. Восстанавливается под действием сильных восстановителей (например, CO) до меди. Обладает основным характером, при нагревании растворяется в кислотах:
CuO + H2SO4 
CuO + 2HNO3 
Гидроксид меди (II) Cu(OH)2 — нерастворимое в воде вещество светло-голубого цвета. Образуется при действии щелочей на соли меди (II):
CuSO4 + 2NaOH 

При нагревании чернеет, разлагаясь до оксида:
Cu(OH)2 
Типичное основание. Растворяется в кислотах.
Cu(OH)2 + 2HCl 
Cu(OH)2 + 2H+ 
Растворяется в растворе аммиака с образованием комплексного соединения (координационное число меди – 4) василькового цвета (реактив Швейцера, растворяет целлюлозу):
Cu(OH)2 + 4NH3 
Малахит Cu2(OH)2CO3. Искусственно можно получить по реакции:
2CuSO4 + 2Na2CO3 + H2O 

Разложение малахита:
Cu2(OH)2CO3 

Серебро и его соединения
Благородный металл, устойчивый на воздухе. При потускнении серебра происходит реакция Гепара:
4Ag + 2H2S + O2 
В ряду напряжений находится правее водорода, поэтому растворяется только в кислотах — окислителях:
3Ag + 4HNO3(разб.) 

Ag + 2HNO3(конц.) 

2Ag + 2H2SO4(конц.) 

В соединениях серебро обычно проявляет степень окисления +1.
Растворимый нитрат серебра AgNO3 используется как реактив для качественного определения Cl-, Br-, I-:
Ag+ + Cl- 

Ag+ + Br- 

Ag+ + I- 

(Способность этих осадков образовывать растворимые комплексные соединения уменьшаются в ряду AgCl – AgBr – AgI). На свету галогениды серебра постепенно разлагаются с выделением серебра.
При добавлении растворов щелочей к раствору AgNO3 образуется тёмно-коричневый осадок оксида серебра Ag2O:
2AgNO3 + 2NaOH 
Осадки AgCl и Ag2O растворяются в растворах аммиака с образованием комплексных соединений (координационное число серебра – 2):
AgCl + 2NH3 
Ag2O + 4NH3 + H2O 
Аммиачные комплексы серебра взаимодействуют с альдегидами (реакция серебряного зеркала):
| O II | O II | |||
| R – | C | + [Ag(NH3)2]OH  R– R– | C | + Ag  + NH3 + NH3  |
| I H | I O | -NH4 |
Золото и его соединения
Золото — мягче Cu и Ag, ковкий металл; легко образует тончайшую фольгу; благородный металл, устойчив как в сухом, так и во влажном воздухе. Растворим только в смеси концентрированных соляной и азотной кислот («царской водке»):
Au + HNO3 + 4HCl 

Реагирует с галогенами при нагревании:
2Au + 3Cl2 
Соединения термически не очень устойчивы и разлагаются при нагревании с выделением металла. Комплексообразователь (комплексы золота (III) обладают координационными числами 4, 5 и 6).
Физиологическое действие серебра. Следы серебра (порядка 0,02 мг/кг веса) содержатся в организмах всех млекопитающих. Но его биологическая роль недостаточно изучена. У человека повышенным содержанием Ag (0,03 мг на 1000 г свежей ткани, или 0,002 вес.% в золе)характеризуется головной мозг. Интересно, что в изолированных ядрах его нервных клеток — нейронах — серебра гораздо больше(0,08 вес.% в золе). С пищевым рационом человек получает в среднем около 0,1 мг. Ag в сутки. Ионы серебра обладают исключительно сильно выраженными бактерицидными свойствами. Ничтожного количества этих ионов, перешедших из металла в воду достаточно, чтобы она не портилась неограниченное время. Очистка больших количеств воды на основе бактерицидного действия серебра особенно удобно производится электрохимическим путём. Нижний предел бактерицидного действия серебра оценивается содержанием его в воде порядка 0,001 мкг/л. Как и все тяжёлые металлы, серебро при избыточном поступлении в организм токсично.
Золото — основной драгоценный металл, его государственное значение
Золото во всем мире считается главным драгоценным металлом. Этот благородный металл, относят к семи металлам древности, известные еще в эпоху каменного века. Золото в природе встречается в виде золотых самородков, имеющие небольшое количество примесей или в виде естественных сплавов золота с другими металлами, например сплав электрум, содержащий в своем составе золото и серебро или другие металлы: медь и железо.
Источник
Получение серебра: методы получения серебра и его соединений
Рассмотрим некоторые способы получения серебра, а также остановимся на его физических и химических свойствах. Этот металл привлекал человека еще в далекие античные времена. Своему наименованию серебро обязано санскритскому слову «аргента», что переводится как «светлый». От слова «аргента» пошло и латинское «аргентум».
Интересные факты о происхождении
Существует множество версий о происхождении этого загадочного металла. Все они связаны с Древним миром. К примеру, в Древней Индии серебро ассоциировали с Луной и Серпом – древнейшим орудием земледельца. Отблеск этого благородного металла подобен свету Луны, поэтому в алхимический период серебро обозначали символом Луны.
Серебро на Руси
В древней Руси мерой стоимости различных предметов являлись бруски серебра. В тех случаях, когда какой-то предмет торговли стоил меньше всего бруска, от него отрубали часть, соответствующую указываемой стоимости вещи. Эти части назывались «рублями», Именно от них пошло название принятой в России денежной единицы — рубль.
Еще за 2500 лет до нашей эры египетские воины применяли серебро для лечения боевых ран. Они накладывали на них тонкие пластины серебра, и раны быстро заживали. В русской православной церкви святую воду для прихожан выдерживали только в серебряных сосудах. С середины прошлого века появились такие отрасли промышленности, как фотография, электротехника, радиоэлектроника, что привело к резкому росту спроса на серебро, его изъятию из денежного оборота.
Высокая электропроводность, хорошая пластичность, невысокая температура плавления, небольшая химическая активность серебра заинтересовала и радиотехников.
Характеристика свойств
Все способы получения серебра основываются на его свойствах. Это металл белого цвета, практически не меняющийся под действием кислорода воздуха при комнатной температуре. Из-за присутствия в воздухе сероводорода, он со временем покрывается темным налетом сульфида серебра Ag2S. Удаляют данное соединение с поверхности серебряного изделия механически, применяя чистящие пасты либо тонкий зубной порошок.
Серебро довольно устойчиво к воде. Соляная, а также разбавленная серная кислота и царская водка на него не действуют, так как на поверхности металла образуется защитная пленка его хлорида AgCl.
Получение нитрата серебра основывается на способности металла вступать в реакцию с азотной кислотой. В зависимости от ее концентрации в продуктах реакции помимо серебра могут находиться оксиды азота (2 или 4).
Получение оксида серебра осуществляется путем добавления раствора щелочи к нитрату серебра. Получаемое соединение имеет темно-коричневый цвет.
Области применения
Благодаря физическим и механическим свойствам именно серебром покрывают радиодетали для повышения электрической проводимости и коррозионной устойчивости. Металлическое серебро используется при изготовлении серебряных электродов для различных видов современных аккумуляторов. Вопросами электролитического серебрения и никелирования достаточно долго занимались специалисты в области гальванотехники: А. Ф. и П.Ф. Симоненко, А. П. Сапожников и др. И.М. Федоровский перенес вопрос, касающийся антикоррозийной стойкости покрытий, из лаборатории в промышленное производство. Соединения серебра (AgBr, AgCl, AgI) применяются для производства кино- и фотоматериалов.
Электролиз растворов солей
Рассмотрим получение серебра электролизом его солей. Собирается электрическая схема, в которой в качестве источника тока выступает гальванический сухой элемент. Максимальный ток в цепи не должен превышать 0,01 А. При применении сухой батарейки (4,5 В) ток ограничивается с помощью добавки проводника с сопротивлением не больше 1000 Ом.
Ванной для процесса серебрения может служить любой стеклянный сосуд. Анодом ванны выступает пластинка металла, имеющего толщину 1 мм и площадь чуть побольше, чем у самой детали. Серебро выбирают для анодного покрытия. В качестве рабочего раствора (электролита) для получения серебра выступает раствор ляписа. До опускания в ванну для серебрения необходимо обезжирить и отполировать деталь, затем протереть ее зубной пастой.
После удаления жира она промывается проточной водой. Судить о полном обезжиривании можно по равномерному смачиванию всей поверхности детали водой. При промывке пользуются пинцетом, чтобы на детали не оставались жировые следы от пальцев. Сразу после промывки деталь фиксируется на проволоке и помещается в ванну. Время получения серебра при серебряном аноде составляет 30 — 40 минут.
Если в качестве анода выбирается нержавеющая сталь, в таком случае скорость процесса меняется. Получение серебра из нитрата будет составлять 30 минут.
Вынутую из ванны деталь качественно промывают, обсушивают, начищают до блеска. При образовании темного осадка серебра ток снижается, для этого подключается дополнительное сопротивление. Это позволяет повысить качество получения серебра электрохимическим способом. Для равномерности покрытия в процессе электролиза деталь периодически поворачивается. Можно отложить металл на латунь, сталь, бронзу.
Химизм процесса
С какими процессами связано получение серебра? Реакции основываются на расположении металла после водорода в ряде стандартных электродных потенциалов. На катоде будет происходить восстановление катионов серебра из его нитрата в чистый металл. На аноде осуществляется окисление воды, сопровождающееся образованием газообразного кислорода, поскольку ляпис образован кислородсодержащей кислотой. Суммарное уравнение электролиза имеет следующий вид:
4Ag NO3 + 2Н2О электролиз 4Ag + О2 + 4HNO3
Получение в лаборатории
Рабочим раствором (электролитом) может стать отработанный фиксаж, в котором присутствуют катионы серебра. Галогениды этого металла образуют с тиосульфатом ряд комплексных солей. При электролизе на катоде выделяется серебро – металл. Получение его подобным способом сопровождается и выделением серы, что приводит к появлению на его поверхности тонкого черного слоя сульфида серебра.
Добыча и открытие
Первые упоминания о добыче серебра связаны с месторождениями, которые были обнаружены финикиянами на Кипре, в Сардинии, Испании, Армении. Металл присутствовал в них в соединении с серой, хлором, мышьяком. Удавалось обнаруживать и самородное серебро внушительных размеров. К примеру, крупнейшим самородком серебра является образец, вес которого составлял тринадцать с половиной тонн. При очистке природных самородков расплавленным свинцом получался тусклый металл. В Древней Греции его именовали Электроном, предугадывая его отличные электропроводные свойства.
В настоящее время электролизом получают плотный слой металлического серебра. В качестве электролита применяют не только нитрат, но и цианиды. Отделение от меди серебра осуществляют выполняя электролиз из холодного раствора, в составе которого около одного процента серной кислоты, 2-3% персульфата калия. Порядка 20 мг металла можно отделить от меди за 20 минут, используя напряжение около 2 В.
В процессе электролиза в растворе должен оставаться избыток персульфата калия. Также среди вариантов разделения этих металлов можно рассмотреть электролиз кипящей уксуснокислой смеси. В настоящее время используются методики, предполагающие применение комплексантов. В растворе, который содержит ион этилендиаминтетрауксусной кислоты (ЭДТА) при кислой среде, серебро осаждается за 25 минут. Его отделяют от пластины путем электролитического осаждения на протяжении 2,5-3 часов.
От висмута и алюминия серебро отделяют путем проведения электролиза азотнокислого раствора при условиях, аналогичных разделению его смеси с медью.
Заключение
Отметим, что получение ацетиленида серебра является качественной реакцией в органической химии на присутствие в смеси ацетилена и других алкинов, в которых тройная связь располагается в первом положении. В промышленных масштабах серебро используется в электротехнической и металлургической промышленности. Оно является побочным продуктом при переработке комплексных сульфидов металлов, в составе которых есть аргенит (сульфид серебра).
В процессе пирометаллургической переработки полиметаллических сульфидов цинка, меди серебро извлекается вместе с основными металлами в качестве серебросодержащих соединений. Для того чтобы проводить обогащение чистым серебром серебросодержащего свинца, используют процесс Паркеса либо Паттисона. Второй способ основывается на охлаждении расплавленного свинца, в котором есть серебро. У металлов разные температуры плавления, поэтому они будут поочередно осаждаться и выделяться из раствора. Оставшуюся жидкость Патиссон предложил подвергать окислению в струе воздуха. Процесс сопровождался образованием оксида двухвалентного свинца, который удаляли, а серебро, остававшееся в расплавленном виде, очищали от примесей.
Еще в Древней Греции применялся метод получения серебра путем купелирования.
Данная технология применяется и в настоящее время в промышленности. Метод основывается на способности расплавленного свинца окисляться кислородом, содержащимся в атмосфере.
Источник