Серная кислота
Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.
Получение
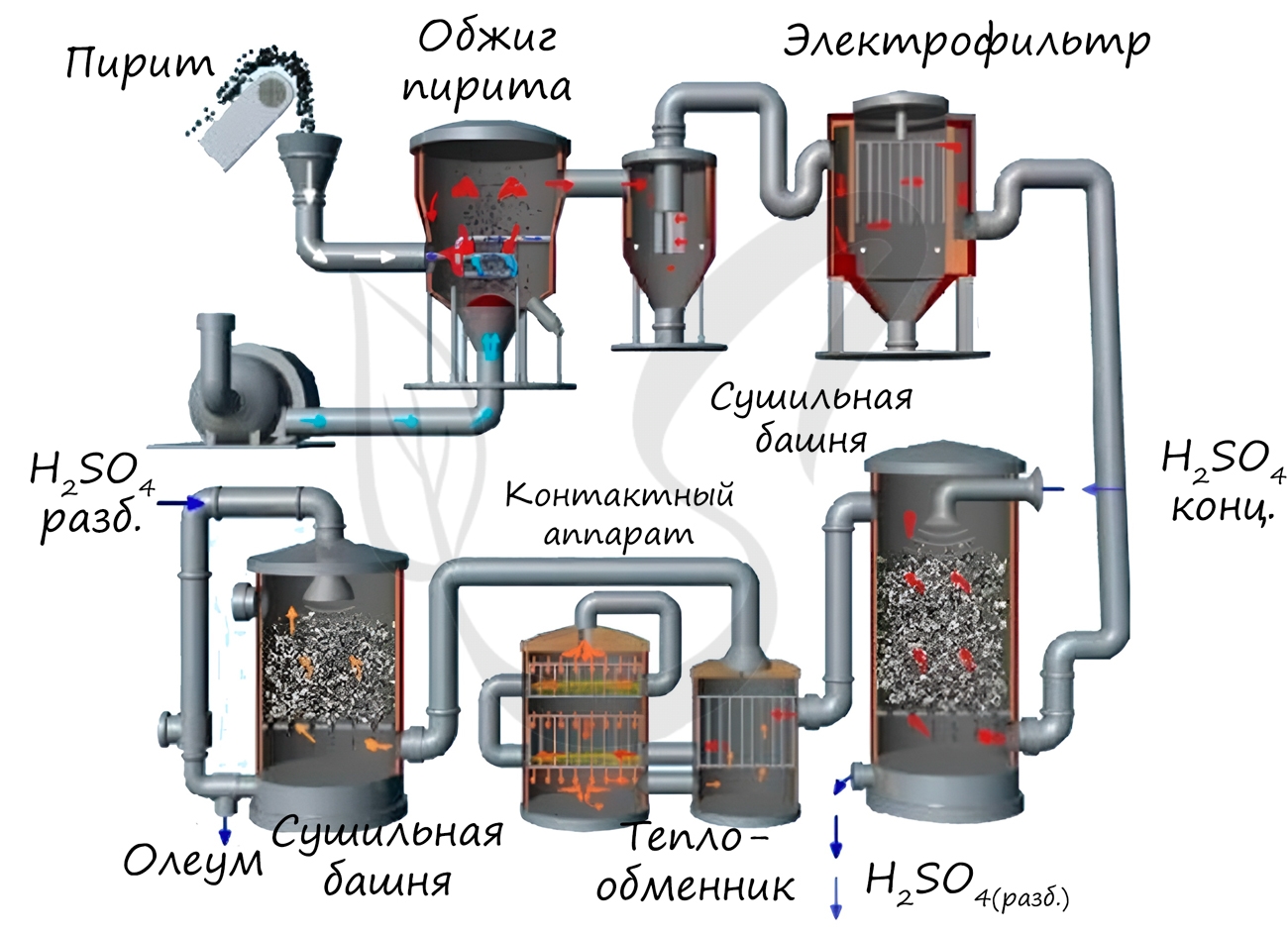
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
В водном растворе диссоциирует ступенчато.
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
Реакции с металлами
Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Серная кислота
Получение серной кислоты
Сернистая кислота
Серная кислота
Серная кислота H2SO4 — одна из сильных двухосновных кислот. В разбавленном состоянии она окисляет почти все металлы, кроме золота и платины. Интенсивно реагирует с неметаллами и органическими веществами, превращая некоторые из них в уголь. При приготовлении раствора серной кислоты всегда надо её приливать к воде, а не наоборот, во избежание разбрызгивания и вскипания воды. При 10 °С затвердевает, образуя прозрачную стекловидную массу. При нагревании 100-процентная серная кислота легко теряет серный ангидрид (триокись серы SO3) до тех пор, пока её концентрация не составит 98 %. Именно в таком состоянии её обычно и используют в лабораториях. В концентрированном (безводном) состоянии серная кислота — бесцветная, дымящаяся на воздухе (из-за паров), маслянистая жидкость с характерным запахом (Т кипения=338 °С). Она является очень сильным окислителем. Это вещество обладает всеми свойствами кислот:
Химические свойства серной кислоты
— химическая реакция с металлами:
2H2SO4 + Cu → CuSO4 + SO2 +2H2O — в этом случае кислота является концентрированной.
Получающийся раствор синего цвета — CuSO4 — раствор медного купороса. Серную кислоту еще называют купоросным маслом, так как при реакциях с металлами и их оксидами образуются купоросы. Например, при химической реакции с железом (Fe) — образуется светло-зелёный раствор железного купороса.
— химическая реакция с основаниями и щелочами (или реакция нейтрализации)
— химическая реакция с серой (кислота — концентрированная, реакция — при нагревании):
— химическая реакция с солями (например, со стиральной содой Na2CO3):
Получение серной кислоты

Серную кислоту получают окислением серы (S) сначала до оксида серы (сернистого газа SO2), а затем окислением сернистого газа до триоксида серы (сернистого ангидрида SO3) (на рисунке слева):
S + O2 → SO2
— сернистый газ — с удушливым запахом серы.
SO2 + O2 → SO3. Эта химическая реакция производится на катализаторе (оксиде ванадия V2O5). Вещество SO3 — сернистый ангидрид — очень гигроскопичное кристаллическое прозрачное вещество, жадно поглощающее воду с образованием серной кислоты:
Сернистая кислота
Сернистая кислота — или Н2SO3 — так называют водный раствор оксида серы (SO2) в воде. На самом деле такого химического вещества не существует, его используют лишь для удобства составления химических уравнений реакций.
Раствор SO2 в воде, имеет кислую среду. Такому раствору присущи все свойства кислот, в том числе реакция нейтрализации.
Сернистая кислота (или правильнее сказать — раствор сернистого газа в воде) образует два вида солей: сульфиты и гидросульфиты. Эти соли являются восстановителями.
Н2SO4 + NaOH → NaНSO3 + Н2O — такая реакция протекает при избытке сернистой кислоты
Сернистая кислота обладает отбеливающим действием. Всем известно, что подобным действием обладает и хлорная вода. Но отличие заключается в том, что в отличии от хлора сернистый газ не разрушает красители, а образует с ними неокрашенные химические соединения!
Кроме основных свойств кислот сернистая кислота способна обесцвечивать раствор марганцовки по следующему уравнению:
В этой реакции образуется бледно-розовый раствор, состоящий из сульфатов калия, марганца. Окраска обусловлена именно сульфатом марганца.
Сернистая кислота способна обесцветить бром
В этой реакции образуется раствор, состоящий сразу из 2-х сильных кислот: серной и бромной.
Если хранить сернистую кислоту при доступе воздуха, то этот раствор окисляется и превращается в серную кислоту
Источник
Урок №14. Серный ангидрид и серная кислота
Повторите темы уроков 9 класса:
Оксид серы (VI)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость, «дымит» на воздухе, поглощая пары воды.
Способы получения
Оксид серы (VI) получают в реакциях окисления:
SO 2 + NO 2 = SO 3 + NO
Разложением сульфата железа (III):
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
2. Серный ангидрид – типичным кислотный оксид, взаимодействует с щелочами и основными оксидами.
SO 3 + 2NaOH ( избыток) = Na 2 SO 4 + H 2 O
SO 3 + NaOH ( избыток) = NaHSO 4
SO 3 + MgO = t = MgSO 4
3. Серный ангидрид – очень сильный окислитель:
SO 3 + 2KI = I 2 + K 2 SO 3
3SO 3 + H 2 S = 4SO 2 + H 2 O
5SO 3 + 2P = P 2 O 5 + 5SO 2
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO 3 в H 2 SO 4
РЕАКЦИИ СЕРНОЙ КИСЛОТЫ
Химические свойства разбавленной серной кислоты
H 2 SO 4 — сильная двухосновная кислота, водный раствор изменяет окраску индикаторов (лакмус и универсальный индикатор краснеют)
1) Диссоциация протекает ступенчато:
(первая ступень, образуется гидросульфат – ион)
HSO 4 — → H + + SO 4 2-
(вторая ступень, образуется сульфат – ион)
H 2 SO 4 образует два ряда солей — средние (сульфаты) и кислые (гидросульфаты)
2) Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn 0 + H 2 +1 SO 4 (разб) → Zn +2 SO 4 + H 2 0 ↑
Zn 0 + 2H + → Zn 2+ + H 2 0 ↑
3) Взаимодействие с основными и амфотерными оксидами:
CuO + H 2 SO 4 → CuSO 4 + H 2 O
CuO + 2H + → Cu 2+ + H 2 O
4) Взаимодействие с основаниями:
H 2 SO 4 + 2NaOH → Na 2 SO 4 + 2H 2 O
Если кислота в избытке, то образуется кислая соль:
H 2 SO 4 + NaOH → NaНSO 4 + H 2 O
H 2 SO 4 + Cu(OH) 2 → CuSO 4 + 2H 2 O
2H + + Cu(OH) 2 → Cu 2+ + 2H 2 O
5) Обменные реакции с солями:
Серная кислота – сильная нелетучая кислота, вытесняет из солей другие менее сильные кислоты:
MgCO 3 + H 2 SO 4 → MgSO 4 + H 2 O + CO 2 ↑
MgCO 3 + 2H + → Mg 2+ + H 2 O + CO 2 ↑
Н 2 SO 4 + 2NaHCO 3 = Na 2 SO 4 + CO 2 ↑ + H 2 O
H 2 SO 4 + Na 2 SiO 3 = Na 2 SO 4 + H 2 SiO 3 ↓
Качественная реакция на сульфат-ион
BaCl 2 + H 2 SO 4 → BaSO 4 ↓ + 2HCl
Ba 2+ + SO 4 2- → BaSO 4 ↓
Образование белого осадка BaSO 4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
6) Реагирует с аммиаком
Химические свойства концентрированной серной кислоты
1. С водой образуются гидраты:
H 2 SO 4 + nH 2 O = H 2 SO 4 ·nH 2 O + Q
Органические вещества обугливаются!
2H 2 SO 4 + C = CO 2 + 2SO 2 + 2H 2 O
2. Серная кислота окисляет неметаллы
неМе + H 2 SO 4 (конц.) = H 2 O + SO 2 + Кислотный гидроксид
, где степень окисления неметалла – высшая
C + 2H 2 SO 4 = 2H 2 O + CO 2 + 2SO 2
S + 2H 2 SO 4 = 3SO 2 + 2H 2 O
2P + 5H 2 SO 4 = 2H 3 PO 4 + 5SO 2 + 2H 2 O
3. Взаимодействие серной кислоты с металлами
H 2 SO 4 (конц.) + Me = t = соль + H 2 O + Х
Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO 2 . С активными металлами может восстанавливаться до серы S, или сероводорода Н 2 S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании образуется газа SO 2 :
6H 2 SO 4 (конц.) + 2Fe = t = Fe 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
6H 2 SO 4(конц.) + 2Al = t = Al 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H 2 SO 4 (конц.) + Cu = CuSO 4 + SO 2 ↑ + 2H 2 O
2H 2 SO 4 (конц.) + Hg = HgSO 4 + SO 2 ↑ + 2H 2 O
2H 2 SO 4 (конц.) + 2Ag = Ag 2 SO 4 + SO 2 ↑ + 2H 2 O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg + 4H 2 SO 4 = 3MgSO 4 + S + 4H 2 O
При взаимодействии со щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H 2 SO 4 (конц.) + 4Zn = 4ZnSO 4 + H 2 S↑ + 4H 2 O
4. Взаимодействие с восстановителями
Концентрированная серная кислота окисляет галогеноводороды и сероводород при комнатной температуре:
3H 2 SO 4 (конц.) + 2KBr = Br 2 ↓ + SO 2 ↑ + 2KHSO 4 + 2H 2 O
5H 2 SO 4 (конц.) + 8KI = 4I 2 ↓ + H 2 S↑ + K 2 SO 4 + 4H 2 O
H 2 SO 4 (конц.) + 3H 2 S = 4S↓ + 4H 2 O
СОЛИ СЕРНОЙ КИСЛОТЫ
1) Разложение сульфатов
Термически устойчивые сульфаты – сульфаты щелочных металлов (в том числе лития), они плавятся не разлагаясь
Остальные сульфаты при нагревании разлагаются на оксид серы(IV), оксид металла и кислород:
2CuSO 4 = t = 2CuO + SO 2 + O 2 (SO 3 )
2Al 2 (SO 4 ) 3 = t = 2Al 2 O 3 + 6SO 2 + 3O 2
2ZnSO 4 = t = 2ZnO + SO 2 + O 2
2Cr 2 (SO 4 ) 3 = t = 2Cr 2 O 3 + 6SO 2 + 3O 2
Следует быть осторожнее с сульфатами железа (II) и хрома (II) , эти металлы при наличии окислителя склонны окисляться до степени окисления +3, а тут как раз выделяется кислород:
4FeSO 4 = t = 2Fe 2 O 3 + 4SO 2 + O 2
Так как оксиды тяжёлых и благородных металлов разлагаются сами, разложение их сульфатов следует записывать до металла:
Ag 2 SO 4 = t = 2Ag + SO 2 + O 2
HgSO 4 = t = Hg + SO 2 + O 2
2) Сульфаты проявляют окислительные свойства и могут взаимодействовать с восстановителями, восстанавливаясь до сульфидов.
CaSO 4 + 4C = CaS + 4CO
3) Многие средние сульфаты образуют устойчивые кристаллогидраты
Na 2 SO 4 ∙ 10H 2 O − глауберова соль
CaSO 4 ∙ 2H 2 O − гипс
CuSO 4 ∙ 5H 2 O − медный купорос
FeSO 4 ∙ 7H 2 O − железный купорос
ZnSO 4 ∙ 7H 2 O − цинковый купорос
Na 2 CO 3 ∙ 10H 2 O − кристаллическая сода
Источник